力清之说明书
Pitavastatin Calcium Tablets
匹伐他汀钙
本品活性成份为匹伐他汀钙。
化学名称:(+)-双{(3R,5S,6E)-7-[2-环丙基-4-(4-氟苯基)-3-喹啉基]-3,5-二羟基-6-庚烯酸}钙
化学结构式:
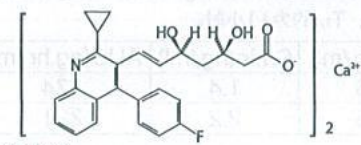
分子量:880.98
本品为淡粉色薄膜衣片,除去薄膜衣后显橙色。
高胆固醇血症、家族性高胆固醇血症。
注意事项:
1.用前必须进行充分检查,确认患有高胆固醇血症、家族性高胆固醇血症后再考虑使用本制剂。
2.由于对家族性高胆固醇血症中纯合体没有使用经验,所以在治疗上只有判定为不得不使用的
情况,才考虑作为LDL-血液成分部分清除等非药物疗法的辅助治疗而考虑使用本制剂。
通常,成人1日1次,口服匹伐他汀钙1~2mg。
按照年龄和治疗反应适宜增减剂量,在LDL胆固醇降低不充分的情况下可以增量,每日最大给药
量为4mg。
注意事项:
1.肝病患者给药时,初始给药量为每日1mg,最大给药量为每日2mg。(参照[慎重给药] [药代动
力学]项)
2.由于随着本制剂给药量(血药浓度的)的增加,可 能会有横纹肌溶解症有关的不良事件的发生,
因此增量至4mg时,要充分注意CK(CPK)升高、肌红蛋白尿、肌肉痛及无力感等横纹肌溶解症前
期症状。[国外临床试验中8mg以上的给药由于横纹肌溶解症及相关不良事件的发生而终止。]
3.中度和重度肾功能不全(分别是肾小球滤过率30~59m/min/ 1.73m2和1 5~29ml/min/1.73m2
不接受血液透析的)以及接受血液透析的终末期肾脏疾病的患者给药时,初始给药量为一日一次,
每次1mg,最大给药量为一日一次,每次2mg。
本药在日本批准上市前进行的临床试验,886 例中有 197 例(22.2%)出现了不良反应。自(他)觉症状的不良反应 50 例(5.6%),主要症状包括腹痛、药疹、倦怠感、麻木、瘙痒等。临床检查值异常有 167 例(18.8%),主要是 γ-GTP 升高、CK(CPK)升高、血清 ALT(GPT)、血清 AST(GOT)升高等。
上市后的安全性监测中 20,002 例中有 1,210 例(6.0%)出现了不良反应。(第 5 次安全性定期报告时)
在中国事实的进口临床试验中,在服用匹伐他汀的 227 例患者中,有 23 例(10.1%)出现了不良反应。其中主要表现为胃肠功能障碍,2 mg 剂量组出现胃肠功能障碍的发生率为 6.3%,0.9% 的病人在使用中肝脏转氨酶升高超过 3 倍以上,在 4 mg 组有 1 例(1/109)出现 CK 大于 10 倍的升高。
1.严重不良反应
横纹肌溶解症(发生率不明):可能会出现以肌肉痛、乏力感、 CK(CPK)升高、血及尿中的肌红蛋白升高为特征的横纹肌溶解症,伴随横纹肌溶解症的发生,可能会出现急性肾功能衰竭等严重的肾功能障碍,出现这种情况时,应停止给药。
肌病(发生率不明):可能会出现肌病,所以如出现广泛的肌肉痛、肌肉压痛或明显 CK(CPK)升高时须停止给药。
肝功能障碍、黄疸(不到 0.1%):可能会出现伴随 AST(GOT)、ALT(GPT)显著升高的肝功能障碍、黄疸,所以应定期进行肝功能检查,发现异常应停止给药,进行妥善处理。
血小板减少(发生率不明):可能会出现血小板减少,所以应注意进行血液检查,发生异常应停止给药,进行妥善处理。
2.其他不良反应:(日本资料)
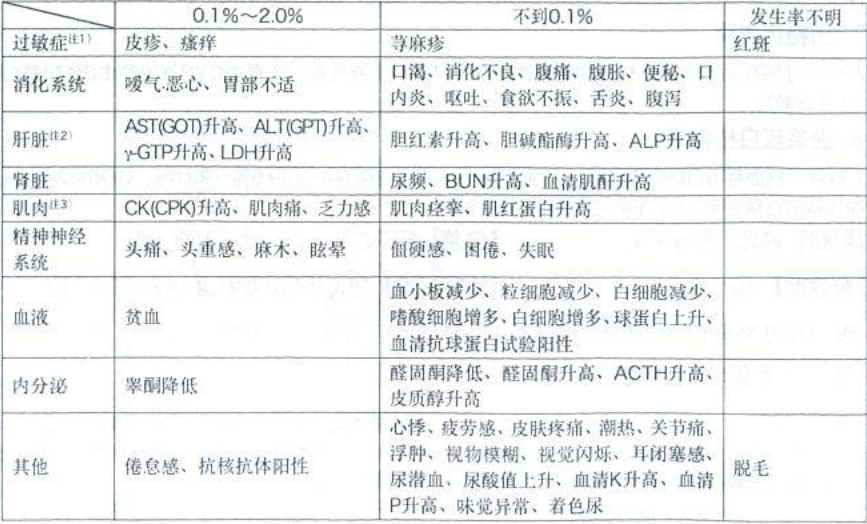
注1)此时应停止给药。
注2)进行充分的观察、出现异常情况应作停止给药等安善处理。
注3)有可能出现横纹肌溶解症的前期症状,所以应充分观察,必要时停止给药。
发生频率根据批准时及安全性监测的合计计算出来。
3.其他报告中他汀类药品的不良反应
1)他汀类药品的.上市后监测中有高血糖反应、糖耐量异常、糖化血红蛋白水平升高、新发糖尿病、
血糖控制恶化的报告,部分他汀类药品亦有低血糖反应的报告。
2)上市后经验:他汀类药品的国外上市后监测中有罕见的认知障碍的报道,表现为记忆力丧失、
记忆力下降、思维混乱等,多为非严重、可逆性反应,一般停药后即可恢复。
1.下列患者禁止给药:
对本制剂成份有既往过敏史的患者。
重症肝病患者或胆道闭塞的患者[这些患者服用本药可能导致血药浓度升高,不良反应发生频率增高,并有使肝功能进一步恶化的可能。](参照[药代动力学]项)
正服用环孢菌素的患者[可能导致血药浓度升高、不良反应发生频率增高。可能发生横纹肌溶解症等严重的不良反应](参照[药物相互作用][药代动力学]项)
孕妇及可能妊娠的妇女和哺乳期妇女。(参照[孕妇及哺乳期妇女用药]项)
2.以下患者原则上禁止给药,但如有必要可慎重给药:
肾功能相关的临床检查值异常的患者,只限于判断本药与贝特类药物在临床上不得不合并用药的情况。[易引起横纹肌溶解症。](参照[药物相互作用]项)
1. 慎重给药(以下患者需慎重给药)
肝病患者或有既往史的患者、酒精中毒者(本药物主要分布和作用与肝脏,有使肝功能进一步恶化的可能。另外,对酒精中毒者,有易出现横纹肌溶解症的报告。)
肾病患者或有既往史的患者。(横纹肌溶解症的报告病例大多是有肾功能障碍的患者,另外发现伴随横纹肌溶解症可以发生急剧的肾功能恶化。)
正在服用贝特类药物(苯扎贝特等)、烟酸的患者[易出现横纹肌溶解症](参照[药物相互作用]项)。
甲状腺机能低下症患者、遗传性肌疾病(肌营养障碍等)或有家族史患者、药物性肌障碍的既往史患者[有易出现横纹肌溶解症的报告。]
老年患者(参照[老年患者用药])
2. 重要的基本注意事项
在使用本药的情况下以下几点要充分注意。
使用本药前,首先采用治疗高胆固醇血症的基本疗法-食物疗法,以及减少如高血压、吸烟等引起缺血性心脏病的危险因素和进一步运动疗法。
从服药开始到 12 周之间至少要检查肝功能 1 次,以后定期(如半年 1 次)检查。
服药过程中要定期检查血中脂质值,如发现对治疗无反应时应停止给药。
3. 使用注意事项
交付患者本药剂时,指导患者讲 PTP 包装的药剂从 PTP 板中取出后服用。(有由于误服 PTP 板,硬角刺入食道黏膜,引起穿孔,并发纵隔炎等严重合并症的报告。)
4. 其他注意事项
狗的经口给药试验(3 mg/kg/日以上 3 个月、1 mg/kg/日以上 12 个月)发现有白内障的发生。但其他动物(大鼠、猴子)未见类似情况发生。
药物过量尚无特殊治疗措施。一旦出现药物过量,应根据需要采取对症治疗及支持性治疗措施。由于大量匹伐他汀与血浆蛋白结合,血液透析不能明显加速匹伐他汀的清除。
对于儿童的用药安全性尚未确立(无使用经验)。一般来说,老年人生理机能下降,因此出现不良反应时应该注意减少用药量。有报告表明,老年人容易发生横纹肌溶解症。安全性尚不能确定。大鼠围产期和哺乳期试验表明,1mg/kg以上剂量组的孕鼠在分娩前或分娩后某一时期有死亡。家兔的致畸敏感期试验结果表明,0.3mg/kg以上剂量组的孕兔有死亡现象。有报道显示,给予大鼠大量的其它HMG-CoA还原酶抑制剂,胎鼠出现骨骼畸形。另有报道显示,孕妇在怀孕的开始3个月服用其它HMG-CoA还原酶抑制剂,胎儿有出现先天性畸形。哺乳期的妇女禁止使用。大鼠乳汁中有药物分泌。
本制剂几乎不被肝的药物代谢酶 P 450(CYP)代谢(CYP2C9 有很少的代谢)。
1. 合并用药禁忌(不要合并使用)
2.原则合并用药禁忌(原则上不合并使用)
肾功能检查异常的患者,原则上是不能合并用药的,只有在临床上判断为不得不使用的情况下才可以慎重合并使用。
3.合并用药注意事项(合并用药时须注意的事项)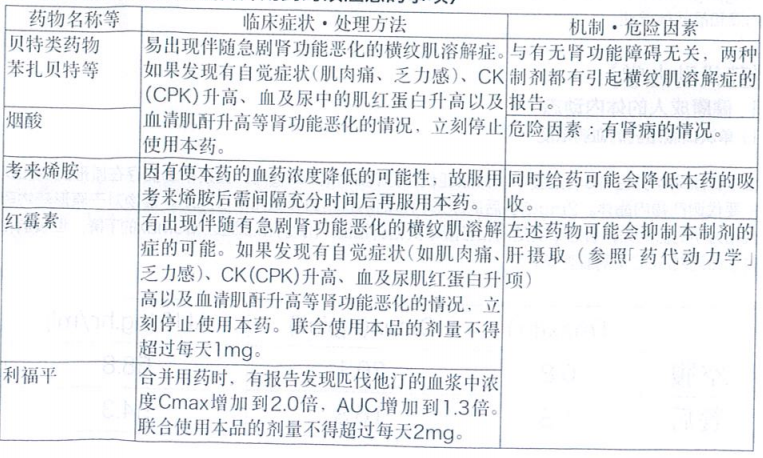
Kowa Company,Ltd.,Nagoya Factory
86978555000205,86978555000212,86978555000236
匹伐他汀钙是通过拮抗性抑制合成胆固醇途径所必须的限速酶-HMG-CoA 还原酶,从而阻止肝脏内胆固醇的合成。其结果促进了肝脏内的 LDL 受体表达,使从血中到肝脏的 LDL 摄取增加,因此血浆总胆固醇下降。另外,由于肝脏内持续的胆固醇合成障碍,也导致了向血液中分泌的 VLDL 减少,从而血浆中的甘油三酯下降。
1.HMG-CoA 还原酶的抑制作用
匹伐他汀在利用大鼠的肝微粒体的试验中,对 HMG-CoA 还原酶具有拮抗性的阻断作用,阻断作用的 IC50值为 6.8nM (体外试验)。
2.胆固醇的合成抑制作用
匹伐他汀钙在利用人肝癌由来细胞(HepG2)的试验中,对于胆固醇合成抑制作用呈浓度相关性(体外试验)。
另外,经口给药的肝脏抑制胆固醇的合成作用是有选择性的(大鼠)。
3.降血脂作用
口服匹伐他汀钙可显著降低血浆中的总胆固醇和甘油三酯(狗、豚鼠)。
4.抑制脂质蓄积和内膜肥厚的作用
匹伐他汀钙可以抑制载有氧化的 LDL 的巨噬细胞(小鼠单球由来株细胞)内胆甾醇酯的蓄积(体外试验)。另外,经口服给药对于颈动脉磨损的模型也有明显的抑制内膜肥厚的作用(兔子)。
5.作用机制
LDL 受体表达的促进作用
匹伐他汀钙对于 HepG2 细胞的 LDL 受体 mRNA 的表达起促进作用,增加 LDL 的结合量,摄取量,ApoB 的分解量(体外试验)。另外,口服时,与用量正相关地促进 LDL 受体的表达(豚鼠)。
VLDL 分泌降低作用
口服匹伐他汀钙,可明显的降低 VLDL-甘油三酯的分泌(豚鼠)。
6.对心电图QTc的影响
在一项174名健康受试者参与的随机、双盲、安慰剂对照、4组平行和莫西沙星阳性对照试验,
本品每日剂量高达1 6mg (每日最高推荐剂量的4倍)时,未导致有显著临床意义的QTc间期延长
或心率改变。
1)致癌性、致突变性、生殖力损害
在小鼠92周的致癌性研究中,给予匹伐他汀75mg/kg/日的最大耐受剂量,最大的全身暴露(基于
AUC)是4mg/日临床最大剂量时的26倍,没有发生药物相关的肿瘤。在大鼠92周的致癌性研究
中,匹伐他汀以1、5、25mg/kg/日灌胃时,甲状腺滤泡细胞瘤的发病率在25mg/kg/8 (人最大剂
量4mg/日的基于AUC全身暴露的295倍)时显着增加。在转基因小鼠(Tg rasH2) 26周的致
癌性研究中,给予匹伐他汀以30,75和1 50mg/kg/日灌胃,没有发现有临床意义的肿瘤。在有无
代谢激活的鼠伤寒沙]氏菌和大肠杆菌的Ames试验,小鼠单次给药和大鼠多次给药后微核试验,大
鼠非程序DNA合成试验以及小鼠彗星试验中匹伐他汀都没有致突变性。在染色体畸变试验中,仅
在所检测的最高剂量观察到染色体畸变,这个剂量还引起了高水平的细胞毒性。匹伐他汀分别以
10mg和30mg/kg/日对雄性和雌性大鼠口服给药,全身暴露分别为4mg/日临床暴露(基于
AUC)的56倍和354倍,对生殖力无不良影响。在-项生育力研究中,匹伐他汀对家兔给药,给
予1mg/kg/日(基于AUC,临床全身暴露4mg/日的30倍)及更高剂量的雄性和雌性家兔死亡。尽
管尚未确定死因,但是家免具有提示可能贫血的肾毒性(肾脏发白)的肉眼体征。低剂量(15倍于
人体全身暴露)在成年雄性和雌性动物中没有表现出明显的毒性。然而,观察到植入减少,再吸收
增加,胎仔的生存能力降低。
2)中枢神经系统毒性
已在其他同类药对狗的实验中,观察到中枢神经系统血管病变,特征为血管周围出血,水肿,血
管周隙单核细胞浸润。在狗中,在血浆药物浓度水平比在人类最高推荐剂量服用的平均药物水
平高出30倍左右的剂量下,化学性质相似的同类药物产生了剂量依赖的视神经退行性病变(视网
膜膝状体神经纤维的Wallerian瓦勒氏变性)。而匹伐他汀未观察到Wallerian变性。治疗剂量为
1mg/kg/日(基于AUC人类最大剂量4mg/日的临床暴露水平的9倍)对狗给药52周,可观察到白
内障和晶状体混浊。
1.临床疗效
以高胆固醇血症患者(包括家族性高胆固醇血症患者)为研究对象进行的临床试验(包括双盲对
照试验)中,每日1次餐后给药匹伐他汀钙1~4mg,给药8~ 104周,收集到的862例统计结果证
实了其确切的血清脂质改善效果。给药8周时的总胆固醇降低率为28%,LDL-胆固醇的降低率为
40%、给药前甘油三酯在150mg/dL以上的患者,其甘油三酯的降低率为26%。老年患者中总胆
固醇的降低率和非老年患者相比未见差异。以高胆固醇血症患者为研究对象进行的28~52周长
期给药试验(1日1次餐后给药1~4mg)中,证实了该药持续稳定的血清脂质改善效果。以家族性
高胆固醇血症患者为研究对象进行的52~ 104周长期给药试验(首先按1日1次餐后给药2mg持
续8周,后增加给药至4mg)中,也证实了其降低总胆固醇、LDL胆固醇的效果。以高胆固醇血
症的中国患者为研究对象,进行了随机化试验。通过应用匹伐他汀钙2mg或4mg进行8周的治疗,LDL-胆固醇的降低率分别为32%、36%。接受匹伐他汀钙2mg治疗的中国高胆固醇血症患者中有70%以上、接受匹伐他汀钙4mg治疗的中国高胆固醇血症患者中有约85%以上LDL-胆固醇和
总胆固醇分别降低了20%以上。
本品对心血管死亡率和发病率的影响未经证实。
2.对老年患者血中甾体激素的影响
以年龄在70岁以上的高胆固醇血症患者34例为对象,1日1次连续8周餐后口服匹伐他汀钙2mg,
未发现血中甾体激素的异常变动。
1.健康成人的体内动态
单次口服给药的血药浓度
日本健康成年男性各 6 名空腹单次口服匹伐他汀钙 2 mg、4 mg 时,血浆中主要存在原形药物和其主要代谢产物内酯体。2 mg 给药后的原形药物的药代动力参数如下表所示。食物对于原形药物药代动力学的影响为,餐后单次给药和空腹单次给药相比,出现 Tmax延迟和 Cmax的下降,但餐前和餐后给药对 AUC 无明显差异。

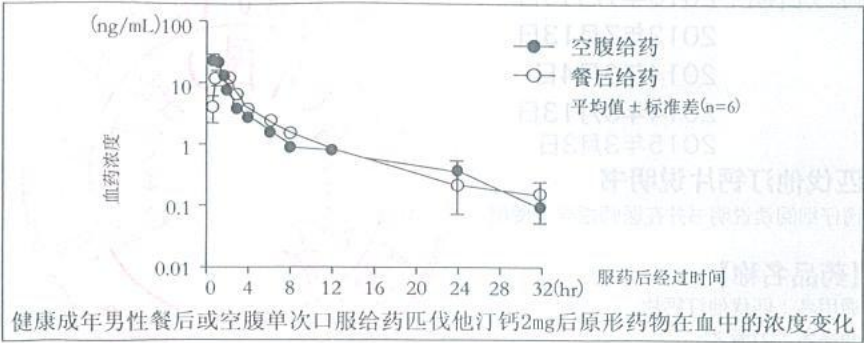
在对健康成年中国男性进行的 1~8 mg 用量范围的匹伐他汀钙口服给药Ⅰ期临床试验中,和日本人比较,虽血药浓度稍低,但匹伐他汀的任一用量均在给药后迅速进入血浆,达到最高血药浓度后,呈 2 相或 3 相性衰减。本试验中,未发现中国人和日本人药代动力学参数的明显差异,也未发现饮食对药代动力学参数的影响。
重复口服给药时的血药浓度
日本 6 名健康成年男性早餐后每日一次口服匹伐他汀钙 4 mg,连续 7 日重复给药,药代动力学参数如下表所示,重复给药引起的变动很小,T1/2约为 11 小时。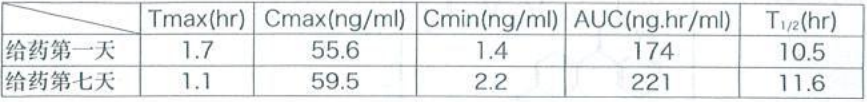
另外,高龄者 6 名与非高龄者 5 名每日一次连续 5 天口服匹伐他汀钙 2 mg 时,两组的药代参数无明显差异。
在外健康成年中国男性进行的 1~4 mg 用量范围的匹伐他汀钙连续 7 日口服重复给药Ⅰ期临床试验中,匹伐他汀在给药的第 2~3 天达到稳态,几乎没有蓄积性。
本试验中,未发现中国人和日本人药代动力学参数的明显差异。
与环孢素合并用药时的血药浓度
日本 6 名健康成年男性 1 日 1 次连续 6 天口服匹伐他汀钙 2 mg,第 6 天匹伐他汀钙给药前 1 小时,单次口服给药环孢素 2 mg/kg,血浆中浓度 AUC 增加到 4.6 倍,Cmax增加到 6.6 倍。
与贝特类药物合并用药时的血药浓度(非日本人数据)
24 名健康成人 1 日 1 次连续 6 天口服匹伐他汀钙 4 mg,从第 8 天开始与非诺贝特和吉非罗齐合用用药 7 天,血浆中浓度(AUC)非诺贝特增加到 1.2 倍,吉非罗齐增加到 1.4 倍。
2.肝功能障碍者的体内动态
肝硬化患者(非日本人数据)
肝硬化患者 12 名和健康成人 6 名单次口服匹伐他汀钙 2 mg 时,血浆中浓度与健康成人系相比 Child-Pugh grade A 的患者其 Cman 为 1.3 倍、AUC 为 1.6 倍、Child-Pugh grade B 的患者其 Cman 为 2.7 倍、AUC 为 3.9 倍。
脂肪肝
日本肝功能障碍者(脂肪肝)6 名与肝功能正常者 6 名 1 日 1 次连续 7 天口服匹伐他汀钙 2 mg,对于药物动态的影响很小。
3.尿中排泄
日本健康成年男性各 6 名分别单次口服匹伐他汀钙 2 mg、4 mg,其尿中的排泄率很低,原形药物不到 0.6%,内酯体不到 1.3%,合计也不到 2%。
日本健康成年男性 6 名连续 7 天每日一次口服匹伐他汀钙 4 mg,其尿中原形药物和内酯体的排泄率从第 1 次给药到第 7 天给药没有增加,随着停止给药而迅速减少。
4.代谢
匹伐他汀钙在体内通过环化为酯体、侧链的 β 氧化、喹啉环的羟基化和葡萄糖醛酸或氨基乙磺酸内聚化等方法进行代谢,主要通过粪便排泄(大鼠、狗)。
在人体内,发现血中有原形药物和其主要代谢产物内酯体,其他代谢产物如丙酸的衍生物,8-羟基化体只发现极少量的存在。同样尿中也只发现极少量的原形药物、内酯体、脱氢内酯体、8-羟基化体和它们的内聚体。
5.药物代谢酶
匹伐他汀钙在采用人肝微粒体的代谢试验中,只有很少被代谢,主要由 CYP2C9 产生 8 位羟基体(体外试验)。
在对于 CYP 分子种类的模型基质的抑制试验中,对 CYP2C9 的基质的甲苯磺丁脲、CYP3A4 的基质的睾酮的代谢没有影响(体外试验)。
6.血浆蛋白结合率
匹伐他汀钙血浆蛋白结合率很高,人血浆及 4% 人血清白蛋白中为 99.5~99.6%、0.06% 人的α1酸性糖蛋白结合率为 94.3%~94.9% (体外试验)。
片剂
1mg;2mg
PTP 包装,7 片/盒、10 片/盒。
遮光,密闭保存
36个月
国药准字HJ20140416,国药准字HJ20140417,国药准字HJ20140937