利血宝说明书
Recombinant Human Erythropoietin Injection (CHO Cell)
重组人促红素
1.主要成份:
重组人促红素,系从人类肝细胞获取的人促红素基因组DNA,经过基因重组而由中国仓鼠卵巢细胞产生的含有165个氨基酸(C809H1301N229O240S5:分子量18,235.96)的糖蛋白质(分子量:约30,000)。
2.每1西林瓶(2ml)中含有下表成份:
本品为无色澄明液体。
施行透析时的肾性贫血。
在给药初期,通常对成人给予本剂每次3000IU,每周三次,尽可能缓慢地静脉注射。贫血情况改善后,通常对成人的剂量改为每次1500IU,每周两至三次,或者每次3000IU,每周两次维持治疗。以血红蛋白浓度(Hb)达到约10g/dl(红细胞压积值30%),作为贫血症状改善的指标。另外,可根据患者的贫血症状及年龄等在剂量上做适当的增减,但是最高维持剂量不可超过每周三次,每次3,000IU。
1.一般不良反应
在4,435例中观察到284例(6.4%)有不良反应。主要的不良反应有血压上升166例(3.74%),头痛43例(0.97%)等,主要的临床检查值异常有ALT(GPT)上升13例(0.29%)、AST(GOT)上升11例(0.25%)、γ-GTP上升11例(0.25%)、血清钾升高10例(0.23%)等。
2.严重不良反应
1)休克、过敏性症状(发生率不详):因有可能发生休克、过敏性症状(荨麻疹、呼吸困难、口唇浮肿、喉头水肿等),因此应密切观察,如发现异常时,采取停药等适当处置。
2)高血压性脑病、脑出血(发生率不详):因急剧的血压上升有引起头痛、意识障碍、痉挛等症状,有高血压性脑病、高血压性脑出血发生的可能,需密切注意血压等的变化给药。
3)心肌梗塞、肺梗塞、脑梗塞(发生率不详):因有引起心肌梗塞、肺梗塞、脑梗塞的可能,应密切注意观察,如发现异常时,采取停药等适当处置。
4)单纯红细胞再生障碍性贫血(发生率不详):有可能因产生抗促红素抗体而引发单纯红细胞再生障碍性贫血。若发生该症状则应采取停药等适当处置。
5)肝功能损害、黄疸:曾有报道使用其他重组人促红素制剂时出现肝功能损害、黄疸并伴随AST(GOT)、ALT(GPT)、γ-GTP升高,所以用药期间应密切注意观察,如发生异常时,采取停药等适当处置。
3.其他不良反应
1.未控制的重度高血压患者。
2.对本剂或对其他促红素制剂过敏者。
3.合并感染者,宜控制感染后再使用本品。
本品可能导致死亡率上升,增加患者严重心血管事件、血栓事件和中风的风险,刺激患者肿瘤生长。
1.对下列患者应慎重给药
(1)有心肌梗塞、肺梗塞、脑梗塞等疾病的患者,或者是有这些病史而可能引起血栓栓塞的患者(有报告指出给予本剂能引起血液粘稠度升高,有可能加重或诱发血栓栓塞,因此需密切观察)。
(2)高血压患者(有些患者在使用本剂后悔出现血压升高,有时会出现高血压性脑病)。
(3)有药物过敏史的患者
(4)有过敏倾向的患者
2.重要注意事项
(1)本剂的用药对象仅限于由于贫血造成日常生活活动障碍的肾性贫血患者。另外,以血红蛋白浓度低于10g/dl(红细胞压积值小于30%)为用药指标。
(2)本剂给药时须确诊为肾性贫血,不可用于其他贫血(失血性贫血、血细胞减少症、铝蓄积症等)。
(3)用药前须充分问诊,以防止休克等反应的发生。初次用本剂或停药后再用本剂时,应先以少量行静脉注射,确定无异常反应发生后再给予全量。
(4)本剂用药期间应定期地(用药初期每周一次,维持给药期每两周一次)检查血红蛋白浓度或者是红细胞压积值,应注意避免过度造血(血红蛋白浓度超过12g/dl或红细胞压积值超过36%),如果发现过度造血,应采取暂时停药等适当的处置。
(5)本剂用药后可能会出现血压升高,另外,也有可能出现高血压性脑病,因此必须密切注意血压、红细胞压积值等的变化而用药。用药期间特别注意应使红细胞压积值缓慢升高。另外,停止用药后红细胞压积值也可能升高,需密切观察,当发现血压升高时应采取停止用药等适当处置。
(6)有可能因产生抗促红素抗体而引发单纯红细胞再生障碍性贫血。在本剂使用中,如出现贫血症状未曾改善甚至恶化的情况,则应考虑发生了该疾病,诊断为单纯红细胞再生障碍性贫血时应停止使用本剂。且勿改用其他促红素制剂,须采取适当处置。
(7)本剂的用药可能会引起高钾血症,应进行适当的饮食调整。
(8)由于本剂的用药可能会造成分流器的闭塞和血液透析装置内留有残血。所以,要充分留意分流器和血液透析装置内的血流量。如有此情况发生,须采取重新设分流器或增加抗凝剂的剂量等适当的处置。
(9)铁的存在对本剂的疗效发挥是非常重要的。铁缺乏时,应给予铁制剂进行治疗。
(10)叶酸或维生素B12不足会降低本品疗效。严重铝过多也会影响疗效。
3.使用注意事项
(1)须遵照医师的处方指示使用。
(2)注射本剂时请勿与其他药物混合使用。
4.运动员慎用。
可能会导致红细胞压积过高,引起各种致命的心血管系统并发症。
对新生儿、婴儿、幼儿和儿童使用本剂的安全性尚未确立(使用经验较少)。一般高龄者的生理功能低下,且多患有高血压和循环系统疾病的并发症,所以给予本剂时,要密切监测血压及血红蛋白浓度或红细胞压积值,并适当调整给药量及给药次数。不宜对孕妇或可能怀孕者注射本剂,必须使用时要判断治疗利益大于危险性才能使用(孕妇使用本剂的安全性尚未建立。此外,在动物实验(大鼠)中报告有胎儿、初生儿的发育延缓现象)。不宜对孕妇或可能怀孕者注射本剂,必须使用时要判断治疗利益大于危险性才能使用(孕妇使用本剂的安全性尚未建立。此外,在动物实验(大鼠)中报告有胎儿、初生儿的发育延缓现象)。
B级:
尚不清楚。
Teva Takeda Pharma Ltd., Takayama Plant
86900617000106,86900617000090,86980022000038,86979458000019,86980022000021,86979458000026
本剂直接作用于红细胞系祖细胞,而发挥造血作用。
造血作用对大白鼠等正常动物进行本剂的皮下或静脉注射时,产生明显的剂量及给药次数依赖性的造血效果。
另外,比较静脉和皮下注射的造型效果,结果发现皮下静脉和皮下注射的造血效果,结果发现皮下注射的效果比静脉注射的效果有稍微优越的倾向。
另外,在使用摘除部分肾脏的大白鼠、庆大霉素诱导肾功能障碍的大白鼠及遗传性囊性肾小白鼠的肾性贫血模型,通过静脉注射本剂,可以观察到贫血得到显著改善。
此外,对因放血操作而造成贫血的大白鼠及狗进行静脉注射时,可以观察到贫血的抑制或减轻以及对贫血的恢复促进效果。
作用机理评估本剂对各种成红细胞祖细胞的集落形成刺激作用,结果证实本剂对后期红细胞祖细胞(CFU-E)有明显的刺激集落形成作用。在高浓度下,本剂亦可刺激早期红细胞祖细胞(BFU-E)的集落形成(in vitro)。另外,对肾性贫血-患者本剂也由促进 CFU-E、BFU-E 集落形成的作用。
急性毒性:
对小鼠大白鼠及狗静脉注射的 LD50 和对生后 4 天的大白鼠幼鼠注射的 LD50,均在 20000U/kg 以上。
亚急性毒性、慢性毒性
(1)大鼠
大白鼠雌、雄大白鼠分别在 4 周、13 周及 52 周间施行静脉注射或腹腔注射本品所做的亚急性、慢性毒性实验结果显示,4 周、13 周及 52 周间分别以本品按体重 80IU/kg/天、20IU/kg/天以上以及 10IU/kg/天以上给药时,主要为本品的药理作用而引起的多血症,且长期给药的结果会出现骨髓的纤维化发生。
(2)犬
狗雌、雄狗分别在 4 周、13 周及 52 周间施行静脉注射所做的亚急性、慢性毒性实验结果显示,4 周、13 周及 52 周间分别以本品按体-重 200IU/kg/天、100IU/kg/天以上以及 20IU/kg 天以上给药时,主要为本品的药理作用而引起的多血症,且长期给药的结果会出现骨髓的纤维化发生,及肾脏的结构变化发生。
(3)大鼠幼鼠
对于生后4天的雌、雄大鼠,进行28天的皮下注射作亚急性毒性试验,给药80IU/kg/天以上时,即与成熟大鼠一样,引起多血症。
另外,400IU/kg/天以上时有骨髓纤维化、骨形成的结构变化发生。
3)对生殖方面的影响
评估大鼠以本剂20IU/kg/天、100IU/kg/天 及500IU/kg/天静脉注射,在妊娠初期,器官形成期、围产期及哺乳期对生殖方面的影响。发现有对胎儿的体重减轻、骨化及新生儿的发育抑制等作用,但是无致胎儿畸形作用。同样对兔以20IU/kg/天、100IU/kg/天及5001U/kg/天在器官形成期施行静脉注射,结果没有致胎儿畸形的作用及发育抑制作用。
4)抗原性
虽然在兔、豚鼠和小鼠显示抗原性发生,但在临床试验中没有显示抗体的产生。
5)局部刺激性试验
在兔眼粘膜一次性刺激性试验中,发现有刺激性变化。在大鼠皮下注射局部刺激性试验中,发
现在注射局部有一过性充血、出血。
6)其他
变异原性试验(微生物、中国仓鼠卵巢细胞和小鼠微核试验)及热原试验(兔,Limulus test)显
示无异常。
1.一般临床试验、双盲对照试验
对于650例施行透析的肾性贫血患者,在每次透析结束时静脉内注射本剂1500~3000IU时,可以在602例中观察到贫血改善效果,其有效率达92.6%。8周给药后,1500IU给药组的红细胞压积平均升高6.4%,3000IU给药组平均升高8.4%。随着肾性贫血的改善,可以观察到症状和体征(心悸、气短、皮肤粘膜苍白等)的改善。
2.对输血量的影响
在长期给药试验中,将本剂给药开始前3个月与试验期间48周的输血量相比,接受输血的病例由40例减少到6例,总输血量也由236单位减少到20单位。
血中浓度
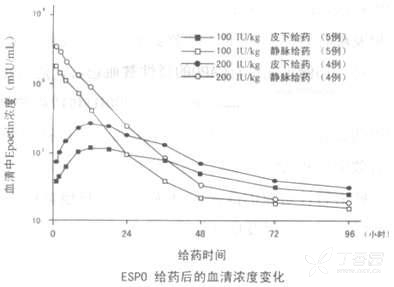
健康成年人一次性注`射本剂 100IU/kg 或 200IU/kg 时,静脉注射以半衰期 4.76 或 5.01 小时衰减,皮下注射在 12 小时后达到最高血药^浓度(以下简称 Cmax)(103.6 或 242.3mIU/ml),之以后半衰期 22.2 或 22.4 小时缓慢地衰减。用药经过 36 小时后,皮下注射显示高浓度变化。
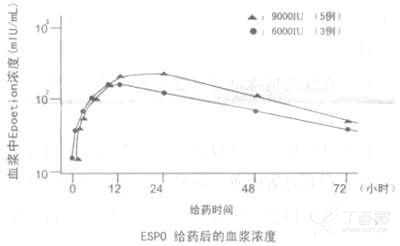
透析前的肾性贫血患者对透析前的肾性贫血患者一次性皮下注射 6,000IU 或 9,000IU 时,血浆浓度在注射后 12~24 小时内达到 Cmax(153 或 219mIU/ml),之后以半衰期 24.6 或 19.1 小时缓慢地衰减。
尿中排泄
健康成年男子一次性注射 100IU/kg 或 200IU/kg 时,静脉注射给药量的 1.80 或 2.13%,皮下注射给药量的 0.15 或 1.41% 均在用药后 48 小时以内被排泄。
注射剂
3000IU/2ml/支(预充式注射器);6000IU/0.5mL/支(预充式注射器)
10支/盒,1支/盒,200支/盒
2-8℃避光保存:常温下运输不超过7天。
24个月
B03XA其它抗贫血药
国药准字J20171085,国药准字J20171084,S20171017,S20171018,S20171016,S20171019
国家基本药物目录;国家基本医疗保险和工伤保险药品;运动员禁用的药物


