泽普平说明书
Gecacitinib Hydrochloride Tablets
盐酸吉卡昔替尼
本品活性成份为盐酸吉卡昔替尼。
化学名称:N-(氰基甲基)-4-(2-{[4-(吗啡啉基-3,3,5,5-d4)苯基]氨基}嘧啶-4-基)苯甲酰胺二盐酸盐一水合物
辅料:微晶纤维素、无水乳糖、羟丙甲纤维素、低取代羟丙纤维素、疏水性胶态二氧化硅、硬脂酸镁、薄膜包衣预混剂(胃溶型)(含二氧化钛、滑石粉、红氧化铁、羟丙甲纤维素、聚乙二醇、聚乙烯醇、黄氧化铁、黑氧化铁)。
粉红色圆形薄膜衣片,除去包衣后显黄色。
本品适用于中危或高危原发性骨髓纤维化(PMF)、真性红细胞增多症继发性骨髓纤维化(PPV-MF)和原发性血小板增多症继发性骨髓纤维化(PET-MF)的成人患者,治疗疾病相关脾肿大或疾病相关症状。
本品应在有经验的医生或药师指导下使用。
在开始本品治疗之前,应进行全血细胞计数,包括白细胞、血小板和红细胞分类计数;开始治疗后,根据临床需要定期监测全血细胞计数(参见[注意事项])。
推荐剂量及服用方法
本品推荐剂量为每次100mg(50mg/片×2片),每日两次,启动治疗时患者基线血小板水平应不低于100×109/L。
本品应空腹口服,以温开水吞服。建议每日同一时段服药。如果漏服药物,无需补服,按常规用药时间进行下一次服药。
剂量调整
在用药过程中,应密切监测患者的血常规,根据患者个体的安全性和耐受性调整用药,包括暂停用药及恢复给药。
治疗中断和重新给药
当血小板计数低于50×109/L或中性粒细胞绝对计数(ANC)低于0.5×109/L时,应中断治疗并给予对症治疗。建议每周至少监测2次血常规,当血小板计数恢复至≥50×109/L且ANC恢复至≥0.5×109/L时,可重新给药,无需减量。
当发生≥3级非血液学不良反应时,应中断治疗并给予对症治疗,进行复查直至不良反应恢复至≤1级或治疗开始前水平,可恢复给药,无需减量。
与强效CYP3A4抑制剂或强效CYP3A4诱导剂合并给药时的剂量调整
当本品与强效CYP3A4抑制剂(如伊曲康唑)长期合并使用时,建议将本品每日总剂量减少,每日给药两次(一次50mg,一次100mg;或两次均为50mg)。当与强效CYP3A4诱导剂(如利福平)合并使用时,本品无需调整剂量。
特殊人群
肝功能损伤
存在轻、中度肝功能损伤患者无需进行剂量调整。本品针对重度肝功能损伤患者的临床数据不足,在这类患者中应谨慎或避免使用。
存在肝功能损伤的患者在接受本品治疗期间,应密切监测安全性和疗效情况,在开始本品治疗后的前6至8周内至少每1至2周监测一次全血细胞分类和计数,如果之后患者的肝功能和血细胞计数达到稳定,则此后的监测可以根据临床情况而定。
肾功能损伤
轻、中度肾功能损伤患者无需调整剂量。本品针对重度肾功能损害患者的临床数据不足,这类患者慎用本品。在本品治疗期间,应从安全性和疗效方面对患者进行密切监测。
本说明书描述了在临床试验中观察到的判断为可能由盐酸吉卡昔替尼(以下简称:吉卡昔替尼)引起的不良反应及其发生率。由于临床研究是在各种不同条件下进行的,在一个药物临床试验中观察到的不良反应的发生率不能与另一个药物临床试验观察到的不良反应发生率直接比较,也可能与临床实践中的实际发生率有所不同。
安全性特征总结
基于既往567例在临床试验中接受吉卡昔替尼片治疗的患者的安全性数据对本品安全性特征进行了总结。这些临床试验包括6项吉卡昔替尼治疗骨髓纤维化和其它适应症的临床研究,4项骨髓纤维化适应症研究分别是ZGJAK016研究(71例+对照组转吉卡昔替尼组19例)、ZGJAK002研究(118例)、ZGJAK006研究(51例)和ZGJAK017研究(34例),共纳入293例骨髓纤维化患者。567例患者中,给药剂量为100mg每日两次的患者291例、200mg每日一次的患者93例、其它剂量183例(包括50mg每日两次、75mg每日两次、100mg每日一次和150mg每日一次)。
567例接受吉卡昔替尼片治疗的患者中,中位暴露时间为25周,平均用药时间46周,11%患者暴露时长<12周,17%患者暴露时长在12-24周,37%患者暴露时长在24-48周,35%患者暴露时长≥48周。其中,293例为MF患者(含100mg Bid剂量235例),中位暴露时间为59周,平均用药时间66周,10%患者暴露时长<12周,8%患者暴露时长在12-24周,24%患者暴露时长在24-48周,58%患者暴露时长≥48周。
567例接受吉卡昔替尼治疗的患者中,147例(25.9%)发生≥3级不良反应,48例(8.5%)发生严重不良反应,6例(1.1%)发生致死性不良反应,26例(4.6%)发生导致终止治疗的不良反应。
不良反应汇总表
表1列出了在所有临床试验中观察到的吉卡昔替尼的不良反应汇总情况,并按照系统器官分类和发生频率列出这些不良反应。发生频率定义如下:十分常见(≥1/10)、常见(≥1/100至<1/10),偶见(≥1/1000至<1/100),罕见(≥1/10,000至<1/1,000)。在每个发生频率分组内,不良反应按发生率从高到低依次排列。
表1 临床试验中吉卡昔替尼的不良反应 * 感染性肺炎患者4例转归为死亡。
* 感染性肺炎患者4例转归为死亡。
a 口腔非感染性疾病:口干、牙龈出血、口腔溃疡、口腔感觉减退、非感染性龈炎、舌痛、牙疼
b 胃肠疾病:肠胃气胀、胃食管反流病、肠炎、功能性胃肠紊乱、排便频率增加、胃肠疾病、胃酸过多、消化不良
c 消化道出血:便血、上消化道出血
d 病毒感染:单纯疱疹、EB病毒感染、口腔疱疹、乙型肝炎再激活、疱疹病毒感染
e 皮肤感染:毛囊炎、皮肤感染、股癣
f 其他上呼吸道感染:鼻炎、扁桃体炎、咽喉炎、咽炎
g 结核:肺结核、结核病、结核性胸膜炎
h 牙齿和口腔软组织感染:冠周炎、口腔感染、牙周炎
i 真菌感染:隐球菌性肺炎、真菌性鼻窦炎
j 电解质失衡:低钙血症、低钾血症、低钠血症、低镁血症、高钙血症、高磷酸血症、高镁血症、低磷血症、高氯血症、高钠血症
k 高脂血症:高胆固醇血症、高脂血症
l 低蛋白血症:低白蛋白血症、低蛋白血症
m 水肿:外周水肿、面部水肿、全身性水肿
n 心律失常:室性期外收缩、窦性心动过缓、房性心动过速、心律失常、房颤
o 心脏传导系统异常:一度房室传导阻滞、右束支阻滞、左束支阻滞
p 膀胱和尿道异常:尿频、高张性膀胱、尿急、排尿困难
q 皮炎:过敏性皮炎、皮炎、脂溢性皮炎
r 皮疹:皮疹、结节性红斑、药疹、荨麻疹
s 骨骼肌肉疼痛:骨痛、肢体疼痛、背痛、肌痛
t 咽喉不适:口咽疼痛、喉部疼痛
u 肝损伤:肝损伤、药物诱导的肝损伤
v 心电图异常:心电图ST-T段变化、心电图高电压、心电图ST段压低、QRS轴异常、心电图P波异常、心电图ST段抬高、心电图T波波幅降低、心电图U波异常、心电图U波突出
w 其他肝脏生化检查异常:总胆汁酸增加、血非结合胆红素升高、肌酶升高、5'核苷酸酶升高、肝酶升高、球蛋白降低、总蛋白降低
x 其他血常规异常:淋巴细胞计数升高、血红蛋白降低、单核细胞计数升高、红细胞计数下降、淋巴细胞百分比升高、嗜酸粒细胞计数增多、单核细胞百分比降低、单核细胞百分比升高、淋巴细胞百分比降低、嗜碱性粒细胞计数升高、嗜酸粒细胞计数异常、嗜酸性粒细胞百分比异常、中性粒细胞百分比降低、中性粒细胞百分比升高
y 其他尿常规异常:尿红细胞阳性、尿胆红素升高、尿酮体存在
z 血脂异常:血甘油三酯升高、血胆固醇升高、游离脂肪酸增加
aa 凝血功能异常:国际标准化比率升高、活化部分凝血活酶时间延长、凝血酶原时间延长、血纤维蛋白原升高、纤维蛋白D-二聚体升高、纤维蛋白降解物升高
bb 血电解质异常:血钾升高、血钙降低、血磷升高、血钠降低、血铁降低、血铜降低
cc 甲状腺激素类升高:甲状腺激素类升高、甲状腺素升高、血促甲状腺激素升高、游离三碘甲状腺原氨酸升高
dd 其他肾脏生化检查异常:肾小球滤过率降低、血尿素降低、血同型半胱氨酸升高
ee 病毒检测阳性:乙型肝炎核心抗体阳性、乙型流感病毒检测阳性中、高危骨髓纤维化患者在一项多中心、随机、双盲、双模拟、阳性药物平行对照的Ⅲ期临床研究(ZGJAK016)中对盐酸吉卡昔替尼片与羟基脲片治疗中、高危骨髓纤维化的不良反应进行了比较。共105例患者按2:1随机分组接受吉卡昔替尼100mg或羟基脲0.5g,每日两次口服。吉卡昔替尼组发生率≥5%的不良反应见表2。吉卡昔替尼组中导致暂停用药或减量和导致永久停药的不良反应发生率均明显低于羟基脲组,分别为18.3% vs. 32.4%和4.2% vs. 11.8%。
表2 ZGJAK016研究中吉卡昔替尼组发生率≥5%的不良反应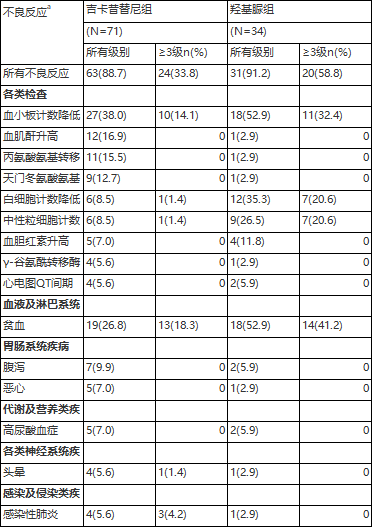
a 根据国立癌症研究所(NCI)-不良事件通用术语标准(CTCAE)5.0版,对严重程度进行分级。
特定不良反应的描述
本品特定不良反应来自于在6项临床研究中接受吉卡昔替尼片治疗的567例患者,其中含来自4项临床研究的293例MF患者,针对以下不良反应的管理参见[注意事项]。
血小板计数降低
本品临床试验的567例患者中,血小板计数降低的发生率为21.7%,其中,≥3级和严重血小板计数降低的发生率分别为9.0%和1.8%,导致治疗暂停或减量的血小板计数降低为12.7%,导致终止治疗的血小板计数降低为1.4%。
本品临床试验的293例MF患者中,血小板计数降低的发生率为41.3%,其中,≥3级和严重血小板计数降低的发生率分别为17.4%和3.4%,导致治疗暂停或减量的血小板计数降低为24.2%,导致终止治疗的血小板计数降低为2.7%。
大多数患者在暂停用药、减量、停用药物或对症治疗后恢复正常或改善。
中性粒细胞计数降低
本品临床试验的567例患者中,中性粒细胞计数降低的发生率为20.8%,其中,≥3级和严重中性粒细胞计数降低的发生率分别为6.7%和0.2%,导致治疗暂停或减量的中性粒细胞计数降低为5.5%,导致终止治疗的中性粒细胞计数降低为0.4%。
本品临床试验的293例MF患者中,中性粒细胞计数降低的发生率为15.4%,其中,≥3级和严重中性粒细胞计数降低的发生率分别为7.2%和0.3%,导致治疗暂停或减量的中性粒细胞计数降低为4.8%,均未导致终止治疗。大多数MF患者在暂停用药、减量、停用药物或对症治疗后恢复正常或改善。
贫血
本品临床试验的567例患者中,贫血的发生率为18.3%,其中,≥3级和严重贫血的发生率分别为10.4%和2.1%,导致治疗暂停或减量的贫血为4.2%,导致终止治疗的贫血为0.2%。大多数患者在暂停用药、减量、停用药物或对症治疗后恢复正常或改善。
本品临床试验的293例MF患者中,贫血的发生率为34.5%,其中,≥3级和严重贫血的发生率分别为20.1%和4.1%,导致治疗暂停或减量的贫血为7.8%,导致终止治疗的贫血为0.3%。大多数患者在暂停用药、减量、停用药物或对症治疗后恢复正常或改善。
感染
在接受本品治疗的患者中有严重感染(包括细菌、病毒或真菌;肺部感染、尿路感染等)和机会感染的报告,包括致死的个例报告。
本品临床试验的567例患者中,发生的所有感染、严重感染和≥3级感染不良反应的比例分别为15.7%、3.7%和4.9%。分别有1.6%和3.2%患者因严重感染不良反应终止本品治疗和减量暂停给药。大多数发生严重感染的患者经治疗后恢复。
本品临床试验的293例MF患者中,发生的所有感染、严重感染和≥3级感染不良反应的比例为17.1%、6.8%和8.9%。分别有3.1%和5.5%患者因严重感染不良反应终止本品治疗和减量暂停给药。大多数发生严重感染的患者经治疗后恢复。
感染性肺炎
本品临床试验的567例患者中,感染性肺炎的发生率为4.2%,其中,≥3级和严重感染性肺炎的发生率分别为3.2%和2.8%,导致治疗暂停或减量的感染性肺炎为1.8%,导致终止治疗的感染性肺炎为0.7%,导致死亡的感染性肺炎为0.7%。
本品临床试验的293例MF患者中,感染性肺炎的发生率为7.8%,其中,≥3级和严重感染性肺炎的发生率分别为5.8%和5.1%,导致治疗暂停或减量的感染性肺炎为3.4%,导致终止治疗的感染性肺炎为1.4%。
尿路感染
本品临床试验的567例患者中,尿路感染的发生率为4.2%,其中3级和严重尿路感染的发生率分别为0.5%和0.2%,导致治疗暂停或减量的尿路感染为0.5%,导致终止治疗的尿路感染为0.2%。
本品临床试验的293例MF患者中,尿路感染的发生率为3.1%,其中3级和严重尿路感染的发生率分别为1.0%和0.3%,导致治疗暂停或减量的尿路感染为0.7%,导致终止治疗的尿路感染为0.3%。
病毒再激活
本品临床试验中有病毒再激活的报告,包括疱疹病毒再激活(如水痘-带状疱疹病毒[VZV]、单纯疱疹病毒[HSV])及乙型肝炎(HBV)再激活。
本品临床试验的567例患者中,有1.8%的患者发生带状疱疹(9例为MF患者,1例为非MF患者),其中3级的发生率为0.4%,未发生带状疱疹严重不良反应,有0.9%的患者发生单纯疱疹(1例为MF患者,4例为非MF患者),其中3级的发生率为0.2%,未发生单纯疱疹严重不良反应。
本品临床试验的293例MF患者中,有3.1%的MF患者发生带状疱疹,其中3级的发生率为0.7%,未发生带状疱疹严重不良反应,有0.3%的患者发生单纯疱疹,其中3级的发生率为0.3%,未发生单纯疱疹严重不良反应。
在本品临床试验中,已排除活动性乙型肝炎患者。567例患者中,有0.2%发生2级乙型肝炎再激活。在293例MF患者中,有0.3%发生2级乙型肝炎再激活。
结核
本品临床试验的567例患者中,有0.5%的患者发生结核不良反应(包括肺结核伴结核性胸膜炎、肺结核和结核病),其中发生3级和严重结核的患者分别为0.4%和0.2%。
本品临床试验的293例MF患者中,有0.7%的患者发生结核不良反应(包括肺结核伴结核性胸膜炎和肺结核),其中发生3级和严重结核的患者分别为0.3%和0.3%。
对本品活性成份或任何辅料过敏者禁用。
对妊娠期及哺乳期患者禁用。
血小板减少、贫血和中性粒细胞减少
骨髓纤维化疾病本身通常伴有不同程度的血小板减少、贫血等血液学异常,本品的治疗可导致血小板减少、贫血、中性粒细胞减少等血液学不良反应;通过暂停用药可以缓解血小板减少,必要时可以给予血小板输注;如使用本品发生贫血,可能需要暂停用药或者给予输血治疗;严重的中性粒细胞减少,通常可通过暂停用药而恢复。开始本品治疗前,患者应进行血常规检查,并且在治疗过程中,每2至4周进行血常规检查(参见[不良反应])。
感染
本品临床试验中有严重的甚至致死性感染(包括肺部感染、尿路感染;细菌性、病毒性、真菌性感染)和机会性感染的报告。骨髓纤维化患者本身是各类感染的易感人群。在开始本品治疗前,患者应接受临床常规筛查,患有活动性感染(包括但不限于活动性/潜伏性结核、带状疱疹、CMV感染和活动性乙肝等)的患者应避免使用本品。只有在活动性严重感染的问题解决后,方可开始本品治疗。在使用本品过程中,一旦发生机会感染,应暂停本品治疗,直到感染得到控制。医生应密切观察使用本品治疗的患者,注意是否存在感染的症状和体征,并尽早给予对症治疗。
感染性肺炎
在安全性汇总的567例患者中有16例发生严重或致死性感染性肺炎,5例患者终止治疗或死亡,其中4例发生死亡。
在接受本品治疗的MF患者中报到过与药物相关的感染性肺炎,主要发生在高危患者如高龄、基础疾病重、合并疾病多的患者中。严重的肺部感染可能导致死亡。故使用本品前,应充分评估受试者的疾病情况,且在本品治疗期间和治疗结束后,密切监测是否发生感染性肺炎的症状和体征,若提示感染性肺炎,积极采取抗感染治疗,予以暂停或永久停药。
活动性结核
在安全性汇总的567例患者中有3例发生结核事件。
应注意可能存在的潜伏性或活动性结核病。在开始本品治疗前,应对患者进行结核病风险因素评估,如有在结核病高发地区居住或旅行史、与活动性结核病患者密切接触史,以及有活动性或潜伏性结核病病史;并对风险较高者进行筛查。在治疗活动性肺结核期间,应评估总体风险和获益后确定是否继续使用本品治疗。
病毒再激活
在免疫功能受损的患者中,疱疹病毒感染可引起严重的并发症甚至死亡。临床试验中观察到患者接受本品治疗期间发生疱疹病毒再激活的风险。对于有疱疹病毒再激活高危因素的患者,在本品治疗期间建议根据诊疗常规采取预防和监测措施。
在安全性汇总的567例患者中有1例发生乙型肝炎再激活。
应在开始本品治疗前,根据指南对患者进行HBV筛查,处于活动性乙肝的患者应避免使用本品。对于HBV血清学阳性的患者,在开始接受本品治疗前应咨询专科医生的意见(HBcAb阳性患者在本品治疗期间需接受预防性抗HBV治疗),并根据当地诊疗常规进行监测管理,以防止乙肝复发。如出现HBV再激活则须给予抗病毒治疗,并及时专科会诊,应评估总体风险和获益后确定是否继续使用本品治疗。
QT/QTc间期延长
在安全性汇总的基线QTcF正常的551例患者中,有52例(9.4%)发生基线后>450ms,其中有6例(1.1%)患者基线后QTcF>500ms;有117例(21.2%)患者发生较基线变化>30ms,其中有25例(4.5%)发生较基线变化>60ms。
应在开始本品治疗前,进行心电图检查,评估患者发生QT/QTc间期延长的风险。使用本品治疗期间应避免合并使用可能导致QT/QTc间期延长的药物。
重要的心血管事件
同类药物在类风湿性关节炎患者中有发生重要心血管事件风险的报道,包括心血管死亡、心肌梗死和中风[与使用肿瘤坏死因子(TNF)阻滞剂治疗的患者相比]。
在开始使用本品治疗之前,应评估患者的心血管风险,特别是已知有心血管疾病史的患者。
栓塞和血栓事件
同类药物有报道增加类风湿性关节炎患者的血栓形成风险,包括深静脉血栓形成、肺栓塞和动脉血栓形成(与使用TNF阻滞剂治疗的患者相比)。
在开始使用本品治疗之前,应评估患者的栓塞、血栓风险,特别是已知有栓塞和血栓史的患者。
肿瘤
同类药物有报道可增加淋巴瘤和其它实体瘤发生的风险。
虽然并不能认为恶性肿瘤的发生与接受本品治疗存在因果关系,但在开始使用本品治疗之前,应评估患者的肿瘤风险,特别是已知有肿瘤史的患者。
对驾驶和操纵机器的影响
目前尚无本品对驾驶或操纵机器的影响的研究。如果患者在治疗期间出现影响其注意力和反应的症状,如头晕、乏力,建议其在症状消除后再驾驶或操纵机器。
尚无本品服用过量的特殊治疗措施。如怀疑药物过量,应立即停用本品,并对患者进行密切观察,必要时采取适当的支持和对症治疗。
目尚未确定本品用于18岁以下患者的安全性和有效性。本品骨髓纤维化临床试验中纳入117例(39.9%)≥65岁的老年患者,主要安全性指标与<65岁的患者中的基本一致,也未观察到临床和实验室检查的特殊不良反应,QTcF延长在老年人群中发生率略高。避孕 具有生育能力的女性及男性患者,在本品治疗期间以及末次用药后1周内,应采取可靠的避孕措施。 孕妇目前尚无妊娠期妇女使用本品的临床数据。根据非临床研究,本品具有胚胎毒性。本品用药前应进行妊娠检测,确定非妊娠状态再接受治疗,并在治疗期间进行妊娠监测。如果在使用本品治疗期间发生妊娠,必须对个体进行风险/获益评估,并充分告知有关药物对胎儿的潜在危害。除非经医生评估获益大于风险,否则妊娠期间不应使用本品。 生育力 目前尚无关于本品影响人类生育力的数据。在大鼠中的试验结果显示,本品会损害雄鼠或雌鼠的生育力。目前尚无哺乳期妇女使用本品的临床数据,尚不明确本品和/或其代谢产物是否会分泌至人乳汁中。非临床研究显示本品及其代谢物可以分泌到乳汁中,故不能排除本品对母乳喂养的婴儿或乳汁生产存在风险。本品治疗期间,必须停止哺乳。末次给药后1周经获益风险评价后可恢复哺乳。
体外研究提示本品主要通过CYP3A4,少量由CYP1A2代谢,极可能是外排转运体P-gp的底物,可能是外排转运体BCRP的底物。本品对主要的CYP450酶基本无抑制作用;在体外对CYP1A2和CYP3A4酶无诱导作用,对CYP2B6酶的诱导显著性不明确。本品对摄取转运体OATP1B1、OATP1B3和外排转运体P-gp和BCRP存在浓度依赖性抑制。
健康志愿者中的药物相互作用研究显示:本品与强效CYP3A4抑制剂(如伊曲康唑)合并使用时,本品原形(吉卡昔替尼)及主要代谢产物ZG0244血浆暴露增加,约为本品单用时的220%和140%,因此,本品与强效CYP3A4抑制剂(包括但不限于波普瑞韦、克拉霉素、印地那韦、伊曲康唑、酮康唑、洛匹那韦/利托那韦、咪拉地尔、奈法唑酮、那非那韦、泊沙康唑、沙喹那韦、替拉瑞韦、泰利霉素、伏立康唑)合并使用时,建议将本品每日总剂量减少,每日给药两次(一次50mg,一次100mg;或两次均为50mg)。本品与强效CYP3A4诱导剂(如利福平)合并使用时,本品原形及主要代谢产物ZG0244血浆暴露量,分别约为本品单用时的72%和108%,本品与强效CYP3A4诱导剂(包括但不限于阿伐麦布、酰胺咪嗪、苯巴比妥、苯妥英、利福布丁、利福平、圣约翰草/贯叶连翘)合并使用时,无需调整本品剂量。
苏州泽璟生物制药股份有限公司
86981829000030
吉卡昔替尼为一种 Janus 激酶(JAK)抑制剂。吉卡昔替尼可通过抑制 JAK1、JAK2、JAK3 和 TYK2 活性,阻断 JAK-STAT 信号转导通路,这个信号通路介导了对造血和免疫功能有重要作用的多个细胞因子和生长因子的信号转导。吉卡昔替尼对骨髓异常增殖具有体外或体内抑制作用。另外,吉卡昔替尼还对激活素受体 1(ACVR1)具有抑制作用。文献数据显示通过抑制 ACVR1 活性,可改善铁代谢失衡和贫血。
大鼠于妊娠第6-17天每天1次经口给予盐酸吉卡昔替尼1.5、4、12mg/kg,给药剂量为12mg/kg[约为临床推荐剂量下原形药物暴露量(AUC)的35倍]时,可见母体毒性及胚胎-胎仔发育毒性。母体毒性表现为体重增重降低;胚胎-胎仔发育毒性主要表现为吸收胎数、丢失率、有吸收胎孕鼠百分率、胎仔内脏及骨骼变异率及畸形率升高,活胎数、胎仔总重及均重降低。盐酸吉卡昔替尼对母体及胚胎-胎仔发育的NOAEL均为4mg/kg(约为临床推荐剂量下原形药物暴露量的8.8倍)。兔于妊娠第6-19天每天1次经口给予盐酸吉卡昔替尼10、30、100mg/kg。给药剂量≤100mg/kg(约为临床推荐剂量下原形药物暴露量的15.7倍)时,未见明显母体毒性或胚胎-胎仔发育毒性。
大鼠于妊娠第6天至产后21天每天1次经口给予盐酸吉卡昔替尼1、3、9mg/kg。给药剂量9mg/kg(约为临床推荐剂量下原形药物暴露量的11.6倍)时,可见个别孕鼠难产死亡。母体毒性的NOAEL为3mg/kg(约为临床推荐剂量下原形药物暴露量的5.05倍),围产期毒性的NOAEL为9mg/kg。
盐酸吉卡昔替尼及其代谢产物可通过大鼠血乳屏障。
致癌性
CB6F1-Tg-rasH2小鼠连续26周每天1次经口给予吉卡昔替尼。雌雄小鼠均未见与给药相关的肿瘤发生,NOAEL分别为200mg/kg、100mg/kg(分别相当于临床推荐剂量下原形药物暴露量的93.6倍和27.2倍)。
在健康受试者中单次空腹口服本品 25 mg-400 mg,Cmax及 AUC0-∞随剂量增加而增加,符合线性动力学特征;多次口服本品 100 mg 每日两次,本品原形和主要代谢产物 ZG0244 基于暴露量计算未见蓄积。 骨髓纤维化患者中,100 mg 每日两次,多次给药,原形药 ZG0163 和主要代谢物 ZG0244 在第 3 天基本达到稳态。与每日一次给药相比,每日两次给药可以降低峰浓度,并增加谷浓度,使得峰浓度和谷浓度之间的波动减小。
吸收
在口服本品 100 mg 剂量下,健康受试者和骨髓纤维化患者中 Tmax为 2.0-3.0 h。 食物影响:健康受试者服用高脂标准餐后单次给予本品,血浆中吉卡昔替尼的 AUC0-∞较空腹服药增加约 160%,Cmax增加约 128%。因此,本品推荐空腹口服。
分布
在口服本品 100 mg 剂量下,健康受试者 Vz/F 为 685L,骨髓纤维化患者 Vz/F 为 335L。吉卡昔替尼与人血浆蛋白结合率为 90% 左右。
消除
在口服本品 100 mg 剂量下,骨髓纤维化患者中吉卡昔替尼的平均清除半衰期约为 3.0 h。
代谢
健康男性受试者单次口服约 100 mg/150 μCi [14C]盐酸吉卡昔替尼,血浆中主要的循环物质为原形药 ZG0163 和代谢物 ZG0244,分别占血浆暴露量的 35.17% 和 35.62%;血浆中另一主要代谢产物 ZG0245 占血浆暴露量的 11.06%。
排泄
健康男性受试者单次口服约 100 mg/150 μCi [14C]盐酸吉卡昔替尼,从尿液和粪便中回收的总放射性占给药量的 99.05%,总放射性主要通过粪便排出体外,占给药量的 73.87%(30.83% 原形药);少量从尿液排出,占给药量的 25.18%(0.22% 原形药)。
特殊人群
肝功能损伤
本品主要通过肝脏清除。在一项肝功能损伤患者的研究中,吉卡昔替尼 100 mg 单次给药后,与肝功能正常患者相比,轻度和中度肝功能损伤患者的吉卡昔替尼 AUC 几何均值分别增加 99.97% 和 81.55%,代谢物 ZG0244 的 AUC 几何均值分别下降 1.6% 和 56%。结合临床试验中肝功能损伤患者中的安全性与疗效数据,建议轻、中度肝功能损伤的患者不进行剂量调整。
肾功能损伤
本品在临床研究中入组了轻至中度肾功能损伤患者,基于群体药代动力学分析,肌酐清除率对于本品的药代动力学没有显著影响。
片剂
50mg(按C₂₃H₁₈D₄N₆O₂计)
密封,阴凉处(不超过20℃)保存。请将本品放在儿童不能接触的地方。
12 个月
国药准字H20250021

