思舒静说明书
Anrikefon Injection
安瑞克芬
本品活性成份为安瑞克芬。
化学名称:7-(D-苯丙氨酰基-D-苯丙氨酰基-D-亮氨酰基-D-赖氨酰基)-2乙酰基-2,7-二氮杂螺[3.5]壬烷
辅 料:冰醋酸、醋酸钠、注射用水。
本品为无色至微黄色的澄明液体。
1. 本品适用于治疗腹部手术后的轻、中度疼痛。
2. 本品用于维持性血液透析的慢性肾脏疾病相关中重度瘙痒成人患者。
用法:
建议按照体重计算单次给药剂量并进行5~20倍稀释后静脉给予本品。
用于腹部手术后的轻、中度疼痛:建议每次给药时间为2min左右。
用于维持性血液透析的慢性肾脏疾病相关中重度瘙痒成人患者:推荐按照干体重计算单次给药剂量,在正常透析结束或患者提前下机后尽快给药(1h内)。
药物可通过透析的静脉回路在冲洗回路期间给予,使用适量的生理盐水(至少10ml) 冲洗给药管路。如遇特殊情况不能通过透析的静脉回路给予药物时,可从不含瘘管的手臂或含瘘管手臂的非内瘘血管进行给药。
使用前,应使用酒精喷洒或酒精棉签清洁安瓿颈部。打开安瓿后,应立即抽入无菌注射器,稀释后迅速开始注射。打开使用后的安瓿必须废弃。稀释后的安瑞克芬注射液仅应在24小时内使用,超时应废弃,不得冷冻。
稀释剂相容性:本品与0.9%氯化钠注射液、5%葡萄糖注射液配伍相容性良好。
用量:
成年人:
用于治疗腹部手术后的轻、中度疼痛:成人单次推荐剂量为1.0 μg/kg,术后视需要一天可给药1~3次,间隔8小时给药1次。按照体重计算单次给药剂量并进行稀释后静脉给药。
用于维持性血液透析的慢性肾脏疾病相关中重度瘙痒成人患者:成人推荐剂量为0.3 μg/kg、1 周 3 次、透析后静脉回路给药。按照干体重计算单次给药剂量。
婴幼儿/青少年:
尚无本品用于18岁以下患者的临床研究资料。
老年人:
无需根据年龄进行剂量调整,参见【老年用药】部分。
肝功能不全患者:
肝功能不全患者无需进行剂量调整。
肾功能不全患者:
用于治疗腹部手术后的轻、中度疼痛:轻度和中度肾功能不全患者无需进行剂量调整,重度肾功能不全患者的使用剂量调整为肾功能正常患者临床治疗剂量的1/2。
以下描述了在临床研究中观察到的判断为可能由安瑞克芬引起的不良反应及发生率。由于临床研究是在各种不同条件下进行的,在一个临床研究中观察到的不良反应的发生率不能与另一个临床研究中观察到的不良反应发生率直接比较,也可能不能反映临床实践中的实际发生率。
安全性特征总结:
全身麻醉下行腹部手术患者术后镇痛的临床研究
本品在腹部手术术后患者中的安全性数据来自于 2 项用于全身麻醉下行腹部手术患者术后镇痛的III期临床研究(HSK21542-301和HSK21542-303)。
在腹部腔镜手术术后镇痛(HSK21542-301)研究中,共 136 例受试者接受例本品1.0μg/kg给药,135例受试者接受安慰剂给药。安瑞克芬常见(≥1%)不良反应包括:恶心(5.1%)、呕吐(2.2%)、血促甲状腺激素降低(3.7%)、游离三碘甲状腺原氨酸降低(1.5%)、血钾降低(2.2%)。
表 1 列出了腹部腔镜手术术后镇痛研究中任意一组发生率≥1%的各系统不
良反应的发生情况。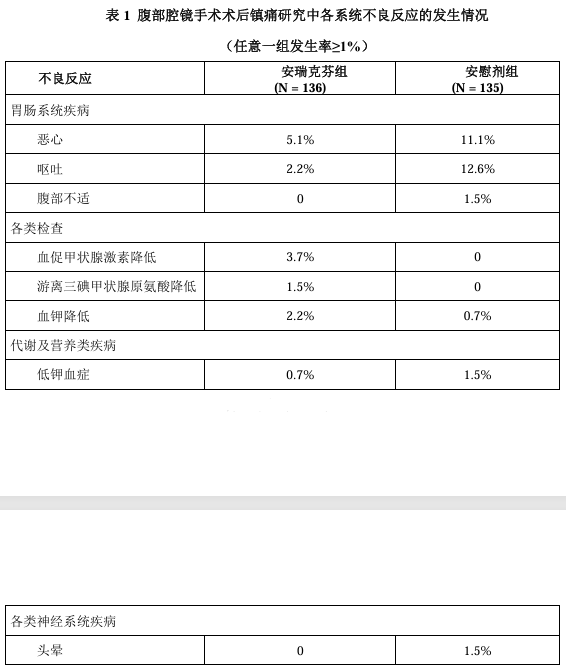
在腹部手术术后镇痛(HSK21542-303)研究中,共 129 例受试者接受本品1.0μg/kg 给药,129 例受试者接受盐酸曲马多注射液,129例受试者接受安慰剂。安瑞克芬常见(≥1%)不良反应包括:恶心(7.8%)、呕吐(8.5%)、血促甲状腺激素降低(8.5%)、游离三碘甲状腺原氨酸降低(3.9%)、游离甲状腺素升高(2.3%)、低钾血症(2.3%)。
表 2 列出了腹部手术术后镇痛研究中任意一组发生率≥1%的各系统不良反
应的发生情况。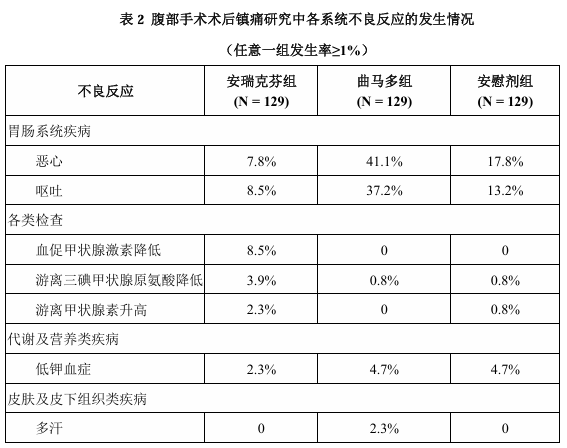 以上2项研究中均未发生≥3级的不良反应,亦未见严重不良反应和因不良反应提前退出研究的情况。
以上2项研究中均未发生≥3级的不良反应,亦未见严重不良反应和因不良反应提前退出研究的情况。
维持性血液透析的慢性肾脏疾病相关中重度瘙痒成人患者的随机对照临床研究
本品的安全性数据来自于 1 项用于治疗维持性血液透析患者的慢性肾脏疾病相关的中重度的多中心、随机、双盲、安慰剂对照的Ⅲ期临床试验,该研究包括双盲治疗期12周和开放治疗期40周,双盲治疗期受试者随机接受HSK21542 注射液/安慰剂的治疗,开放治疗期所有受试者均接受 HSK21542 注射液治疗。共有502例受试者暴露于本品(0.3 μg/kg、1周3次、透析后静脉回路给药),其中392 例受试者服用本品达到至少24周的暴露,176例受试者服用本品达到至少12个月的暴露。
双盲治疗期
在双盲治疗期有 275 例受试者接受了本品,270 例受试者接受了安慰剂。HSK21542 组和安慰剂组分别有 71 例 (25.8%)和 47 例 (17.4%)受试者发生了不良反应,其中严重不良反应的发生率 HSK21542 组和安慰剂组分别为 0.7%和0.4%。表3中列出了双盲治疗期本品发生率≥1%的所有不良反应。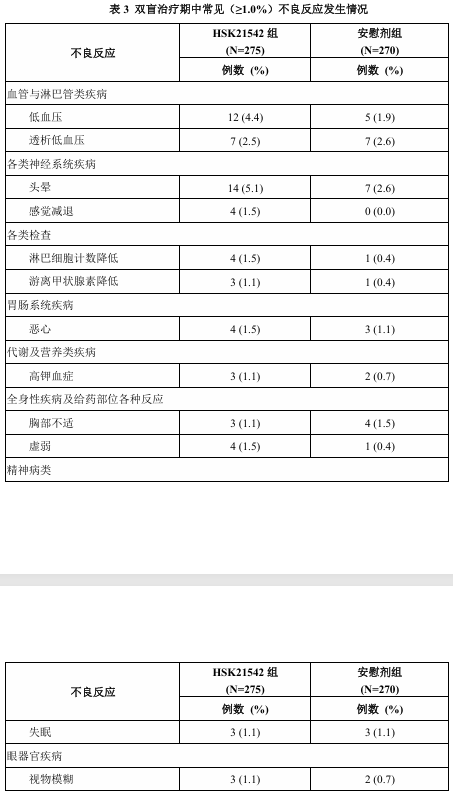
开放治疗期
开放治疗期有442 例受试者接受了本品,有92例 (20.8%)受试者发生了不良反应,其中严重不良反应的发生率为0.9%。
表4中列出了开放治疗期本品发
生率≥1%的所有不良反应。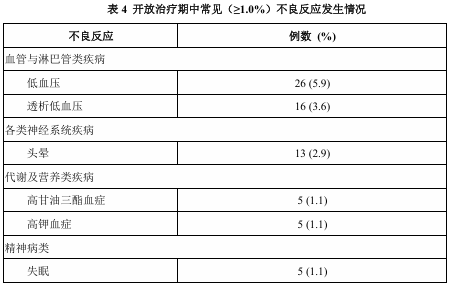
≥65 岁人群的安全性信息
在双盲治疗期有38例≥65岁的受试者接受了本品,51例≥65岁的受试者接受了安慰剂。HSK21542 组和安慰剂组分别有11例 (28.9%)和 6例 (11.8%)≥65岁的受试者发生了不良反应。表5中列出了双盲治疗期≥65岁的受试者发生的所有不良反应。
表5 双盲治疗期≥65岁的受试者不良反应发生情况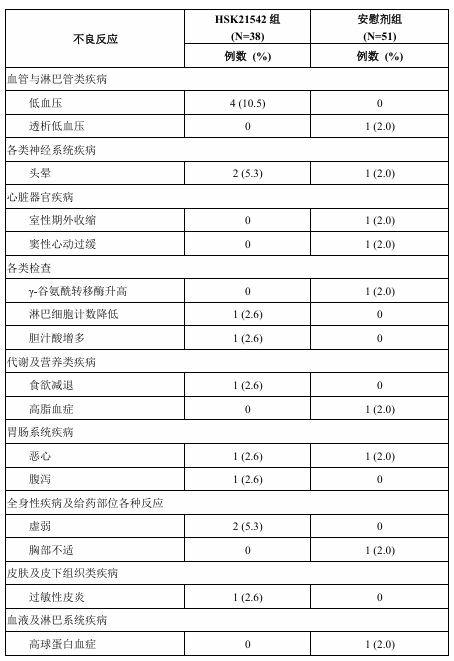
在开放治疗期有65例≥65岁的受试者接受了本品。共16例 (24.6%)≥65岁的受试者发生了不良反应。表6中列出了开放治疗期≥65岁的受试者发生的所
有不良反应。
表6 开放治疗期≥65岁的受试者不良反应发生情况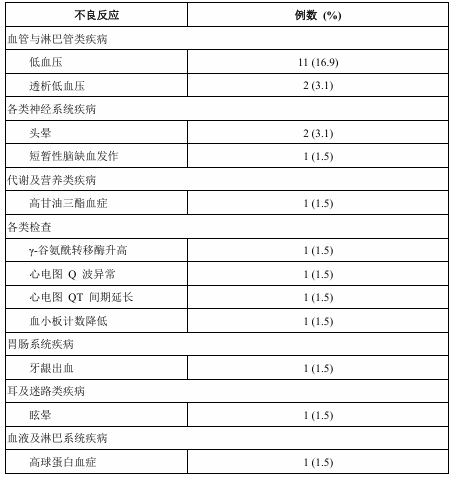
对本品活性成份或辅料过敏者禁用。
1、由于静脉注射(IV)给药以外的其他给药方式(如关节内给药、肌内注射、硬膜内给药)的研究缺乏,因此不推荐使用其他给药方式。
2、使用本品后可能会出现催乳素、甲状腺功能等内分泌指标异常,因此建议用药期间对相关指标进行适当监测。
3、本品可能会引起嗜睡、头晕等症状,因此建议正在使用本品的患者不要从事汽车驾驶及机械操作等需集中精力的活动。
截止目前,本品在腹部手术术后镇痛临床研究中共 1 例受试者发生药物过量,该受试者在第2次给药过程中由于手腕活动,造成输液管堵塞,导致药物过量0.16 mL(含安瑞克芬约1.888μg),未发生不良反应。 基于在维持性血液透析的慢性肾脏疾病相关中重度瘙痒成人患者中开展的临床试验,共有13例受试者发生药物过量,均未发生不良事件。
在I期健康受试者剂量爬坡研究中的最大给药剂量为3.375μg/kg,主要发生的不良反应为异常感觉(66.7%,4/6),其次为血尿酸升高(33.3%,2/6),其余不良反应为头晕、尿白细胞阳性和尿白细胞酯酶阳性,发生率均为(16.7%,1/6)。以上不良反应均为轻度,且未经任何处理自行恢复。
一旦发生药物过量,应根据患者临床表现或检查结果给予对症处理以及适当支持治疗。
本品尚未开展孕妇及哺乳期妇女用药的临床研究。 目前安瑞克芬对孕妇的安全性尚不明确,建议孕妇慎用。仅在对母体及胎儿的潜在获益大于风险时才可以考虑使用本品,应告知患者可能对母体和胎儿产生的危害。目前尚不清楚安瑞克芬是否经人母乳分泌,对新生儿的安全性尚不明确,建议哺乳期妇女在使用本品期间停止母乳喂养。尚无18岁以下患者应用安全性和有效性资料。本品在术后镇痛II期和III期的安慰剂对照研究中,接受安瑞克芬注射液的≥65 岁的老年患者共21例,所有患者剂量均未调整。对于治疗腹部手术后的轻、中度疼痛适应症,本品的对照临床研究未纳入足够数量的65岁及以上的受试者,以确定他们的反应是否与年轻受试者不同。 本品在维持性血液透析的慢性肾脏疾病相关中重度瘙痒成人患者的III期临床研究中,接受过HSK21542注射液的老年患者(≥65岁)共76例,疗效与总体人群一致。 开展的群体药代动力学分析显示,年龄对本品的暴露量影响预期无临床意义。
体外研究表明,安瑞克芬在人肝细胞不发生代谢转化,在治疗剂量下,对CYP1A2、CYP2B6 和 CYP3A4 无诱导作用;对 CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6和CYP3A4/5无抑制作用。
体外研究表明,安瑞克芬不是乳腺癌耐药蛋白(BCRP)、P-糖蛋白(P-gp)、有机阴离子转运多肽(OATP)1B1、OATP1B3、有机阴离子转运体(OAT)1、OAT3、有机阳离子转运体(OCT)2、多药及毒性化合物外排转运体(MATE)1 和MATE2-K的底物,治疗剂量下对上述转运体没有抑制作用。
辽宁海思科制药有限公司
86983791000032
本品为一种选择性κ阿片受体(KOR)激动剂。
遗传毒性
本品Ames 试验、体外染色体畸变试验和大鼠体内微核试验结果均为阴性。
生殖毒性
生育力与早期胚胎发育毒性试验中,雄性大鼠于交配前 4 周至交配结束、雌性大鼠于交配前2周至妊娠第7天静脉注射本品1、3、10 mg/kg/天,≥1 mg/kg/天剂量下可见雌鼠性周期天数延长、交配成功天数延长、性周期紊乱(主要表现为发情期和/或发情间期延长)发生率升高,未见对雄性生育力和早期胚胎发育的不良影响。
胚胎-胎仔发育毒性试验中,妊娠大鼠于器官发生期(妊娠第6~17天)静脉注射本品0.2、1、4 mg/kg/天[以AUC计,约为人最大推荐剂量(MRHD)1μg/kg的19、82、358倍],4 mg/kg/天剂量下可见胸椎锥体骨化不全发生率升高,胚胎-胎仔发育的NOAEL为1mg/kg/天。妊娠兔于器官发生期(妊娠第7~19天)静脉注射本品0.3、1、2 μg/kg/天(以AUC计,约为MRHD的0.1、0.3、0.8倍),2 μg/kg/天剂量下可见子宫重量有降低趋势、总丢失率和有吸收胎孕兔百分率有升高趋势。
大鼠围产期毒性试验中,雌性大鼠于妊娠第6天至哺乳期第21天静脉注射本品0.2、1、4 mg/kg/天(以AUC计,约为MRHD的17、59、250倍),未见母体毒性和子代发育毒性。本品可透过大鼠血乳屏障进入乳汁。
致癌性
大鼠每天1次连续两年皮下注射本品0.1、0.5、2.5 mg/kg/天(以 AUC计,雄鼠暴露量约为MRHD的16、107、1609倍,雌鼠约为10、60、425 倍),RasH2转基因小鼠每天1次连续6个月皮下注射本品0.4、2、10 mg/kg/天(以AUC计,雄鼠暴露量约为MRHD的31、142、669 倍,雌鼠约为23、112、593 倍),均未见致癌性。
在中国健康成年受试者单次静脉给予0.2~3.375 µg/kg 安瑞克芬注射液,药
物暴露与剂量呈线性特征。健康受试者单次2 min或15 min静脉注射1μg/kg 安
瑞克芬注射液后, 峰浓度(Cmax)分别为10.2 ng/mL和8.13 ng/mL,药时曲线下
面积(AUC0-t)分别为10.13 ng*h/mL和9.89 ng*h/mL。本品注射时长为2 min或
15 min,其暴露水平无明显差异。群体药代动力学结果表明,本品在健康受试者
和腹部手术术后镇痛患者中药代动力学特征相似。维持性血液透析慢性肾脏疾病
相关的瘙痒患者每周给予3次0.3 μg/kg 安瑞克芬注射液后,药物在患者体内基
本无蓄积。
分布:健康成年受试者单次静脉给予0.2~3.375 μg/kg 安瑞克芬注射液后, 表
观分布容积为227~274 mL/kg。维持性血液透析慢性肾脏疾病相关的瘙痒患者每
周给予3次0.3 μg/kg 安瑞克芬注射液后,表观分布容积为1.3 L/kg。全血和血
浆中总放射性物质浓度比均值在0.46~0.54之间,表明[14C]安瑞克芬及其相关物
质不倾向于分配到血细胞中。安瑞克芬与人的血浆蛋白结合率为14.3%,且无浓
第 10页 /共 17页
度依赖。
代谢:健康成年受试者单次静脉注射[14C]安瑞克芬后,原形是血浆中的主要
循环物质,单个代谢物的血浆总放射性占比≤1.07%。尿液和粪便中安瑞克芬也主
要以原形形式存在。维持性血液透析患者给予安瑞克芬注射液后,在给药后的血
浆、尿液和粪便中仅检测到安瑞克芬。
排泄:健康成年受试者单次静脉给予0.2~3.375 µg/kg 安瑞克芬注射液,平
均t1/2范围为1.39~2.24 h。经肾的尿排泄是安瑞克芬的主要排泄途径,尿排泄率
和粪便排泄率分别为46.30±12.02%和35.60±5.66%。
血液透析慢性肾脏疾病相关的瘙痒患者每周给予3次0.3μg/kg 安瑞克芬注
射液后,平均t1/2为 26.3 h。原形经粪便排泄是安瑞克芬注射液在血液透析患者
中的主要排泄途径。粪便、尿液和透析液中排泄率分别为74.7±13.2%、0.621±0.871%
和0.119±0.292%。
特殊人群
肾功能不全患者
本品用于腹部手术后疼痛的群体药代动力学结果表明,轻度(N=159)和中
度(N=13)肾功能不全受试者相比于肾功能正常受试者(N=281)的 AUC 分别增
加7.88%和73.8%,Cmax基本无变化,整体暴露水平在肾功能正常受试者整体暴
露范围内。
用于支持腹部手术后疼痛的肾功能不全受试者药代动力学研究表明,健康受
试者和不同程度肾功能不全受试者静脉给予1 μg/kg 安瑞克芬注射液后,与肾功
能正常(90≤GFR<130 mL/min, N=8)的受试者相比,轻度(60≤GFR<90 mL/min,
N=8)、 中度(30≤GFR<60 mL/min,N=8)和重度(15≤GFR<30 mL/min, N=9)
肾功能不全受试者血浆中AUC0-∞分别增加27.02%、62.79%和121.64%,Cmax基
本不受肾功能损伤程度影响。本品用于治疗腹部手术后疼痛时,轻度和中度肾功
能不全患者无需进行剂量调整,重度肾功能不全患者使用时应进行剂量调整。
肝功能不全患者
本品用于腹部手术后疼痛的群体药代动力学分析结果表明,轻度(N=43)、
中度(N=11)、重度(N=15)肝功能不全受试者相比于肝功能正常受试者(N=447)
AUC分别增加13.6%、51.2%和30.5%,轻度、中度、重度肝功能不全受试者的
第 11页 /共 17页
AUC范围均在肝功能正常受试者AUC范围内。肝功能不全患者无需进行剂量调
整。
本品用于维持性血液透析的慢性肾脏疾病相关瘙痒的群体药代动力学分析
结果表明,轻度和中重度肝功能不全的维持性血液透析患者相比于肝功能正常的
维持性血液透析患者AUC分别增加33%和78%,肝功能不全患者无需进行剂量
调整。
性别
群体药代动力学分析结果表明,性别对安瑞克芬的PK特征无明显影响。
老年
本品用于腹部手术后疼痛的群体药代动力学分析结果表明,老年人(≥65岁)
相比于非老年人(<65岁)AUC增加38.5%,无需根据年龄进行剂量调整。
本品用于维持性血液透析患者的慢性肾脏疾病相关瘙痒的群体药代动力学
分析结果表明,老年人(≥65岁)相比于非老年人(<65岁)AUC增加4%,无
需根据年龄进行剂量调整。
注射剂
1ml:0.1mg
中硼硅玻璃安瓿,4支/盒。
密闭,不超过25℃保存。
36 个月
国药准字H20250014

