达卫可说明书
Lemborexant Tablets
莱博雷生
活性成份:莱博雷生
化学名称:(1R,2S)-2-{[(2,4-二甲基嘧啶-5-基)氧基]甲基}-2-(3-氟苯基)-N-(5-氟吡啶-2-基)环丙基甲酰胺
5mg片剂: 淡黄色、圆形、双凸、薄膜包衣片剂; 10mg片剂: 橙色、圆形、双凸、薄膜包衣片剂。
本品适用于治疗以入睡困难和/或睡眠维持困难为特征的成人失眠患者。
口服。本品的推荐剂量为 5 mg,每晚服用不得超过一次,睡前立即服用,并且距计划觉醒时间剩余至少 7 小时。根据临床疗效和耐受性,最大推荐剂量可增至 10 mg。如果与食物同服或餐后立即服用,则入睡时间可能延迟。
与 CYP3A 抑制剂或 CYP3A 诱导剂合并用药的剂量建议
与 CYP3A 强或中度抑制剂合并用药避免本品与 CYP3A 强或中度抑制剂合并用药。与 CYP3A 弱抑制剂合并用药如果与 CYP3A 弱抑制剂同时使用,本品的最大推荐剂量为 5 mg,每晚不超过一次。与 CYP3A 强或中度诱导剂合并用药避免本品与 CYP3A 强或中度诱导剂合并用药。
特殊人群
肾功能不全患者
轻度、中度或重度肾功能不全患者无需调整剂量。
肝功能不全患者
轻度肝功能不全患者无需调整剂量。
中度肝功能不全患者服用本品的最大推荐剂量为 5 mg。
重度肝功能不全患者不推荐使用本品。
临床试验经验
由于临床试验是在各种不同的条件下进行的,在某一药物的临床试验中观察到的不良反应发生率,不能直接与在另一种药物的临床试验中观察到的发生率相比较,也不能反映在医疗实践中观察到的发生率。对两项设有对照组的疗效试验(研究 E2006-G000-303(研究 303)和研究 E2006-G000-304(研究 304))中 1418 名成人失眠患者(18 岁至 88 岁)接受本品治疗的安全性进行了评价。研究 303 是一项 6 个月安慰剂对照试验,评估本品 5 mg 或 10 mg(每晚一次)治疗,随后是 6 个月平行组扩展期,其中初始接受本品治疗的患者继续使用相同剂量治疗,安慰剂组的患者重新随机分组接受本品 5 mg 或 10 mg(每晚一次)治疗。研究 303 中 434 名患者接受本品治疗一年。研究 304 是一项为期 30 天的安慰剂和活性药物对照试验,评估本品 5 mg 或 10 mg(每晚一次)治疗。
导致治疗中止的不良反应
研究 303(前 30 日)和研究 304 中接受本品 10 mg 和 5 mg 治疗的患者因不良反应停药的发生率分别为 2.6% 和 1.4%,安慰剂组为 1.5%。导致停用本品的最常见不良反应为嗜睡(10 mg 组发生率为 1.0%,5 mg 组 0.7%,安慰剂组 0.4%)和梦魇(10 mg 组发生率为 0.3%,5 mg 组 0.3%,安慰剂组 0%)。在研究 303 中采用安慰剂对照的 6 个月中,接受本品 10 mg 和 5 mg 治疗的患者因不良反应停药的发生率分别为 8.3% 和 4.1%,安慰剂组为 3.8%。一个治疗组内超过 1 名患者出现停用本品的最常见原因包括:嗜睡(10 mg 组 2.9%,5 mg 组 1.0%,安慰剂组 0.6%)、梦魇(10 mg 组 1.3%,5 mg 组 0.3%,安慰剂组 0%)和心悸(10 mg 组 0.6%,5 mg 组 0%,安慰剂组 0%)。
最常见不良反应
研究 303(前 30 日)和研究 304 中最常见的不良反应(本品治疗患者中发生率 ≥ 5% 的不良反应,且发生率至少是安慰剂组的两倍)为嗜睡(10 mg 组 10%,5 mg 组 7%,安慰剂组 1%)。
表 1 列出了研究 303(6 个月设有对照的疗效试验)前 30 日和研究 304(1 个月设有对照的疗效试验)的合并数据中的不良反应,这些不良反应在本品治疗患者中的发生率 ≥ 2%,且发生率大于安慰剂组。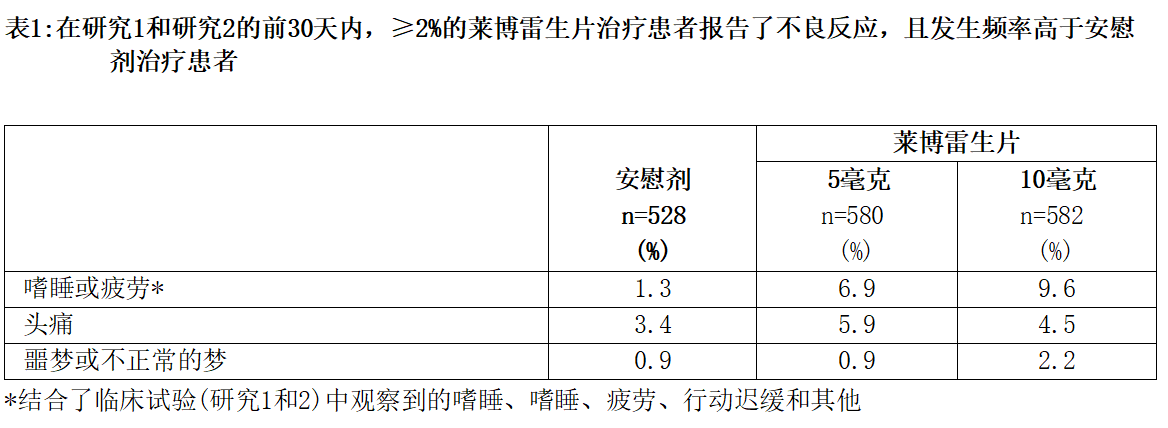
临床试验期间观察到的其他不良反应(研究 303 和研究 304)
发生率 < 2% 但大于安慰剂组的其他不良反应参见下文。下列事件未纳入不良反应:
1)药物引起不良事件的可能性低;
2)信息不足或;
3)没有临床显著意义。·本品 10 mg 和 5 mg 治疗患者中分别有 1.6% 和 1.3% 报告了睡眠性瘫痪,而安慰剂组未报告。本品 10 mg 和 5 mg 治疗患者中分别有 0.7% 和 0.1% 报告了入睡前幻觉,而安慰剂组未报告。·报告了 2 例复杂睡眠行为事件,均来自本品 10 mg 治疗患者。
本品禁用于发作性睡病患者。
中枢神经系统抑制作用和日间功能损害
本品是一种中枢神经系统(CNS)抑制剂,即使按处方用药,也可能会损害日间清醒状态。部分患者在停用本品后的 CNS 抑制作用可能会持续数日。处方医生应告知患者次日嗜睡的可能性。服用本品 10 mg 的部分受试者会损害驾驶能力。如果服用本品时剩余的睡眠时间少于整晚时间,或者服用剂量高于推荐剂量,则日间功能损害的风险升高。如果在这些情况下服用本品,应警告患者不得在次日驾驶和进行需要完全精神警觉的其他活动。本品与其他 CNS 抑制剂(例如苯二氮䓬类、阿片类、三环类抗抑郁药、酒精)同时使用时会增加 CNS 抑制的风险,CNS 抑制会引起日间功能损害。由于潜在累加作用,如果本品与 CNS 抑制剂合并用药,可能需要调整本品和 CNS 抑制剂的剂量。不建议本品与其他药物一同用于治疗失眠。应告知患者不得在服用本品时饮酒,因为二者具有累加作用。由于本品会引起困倦,患者有跌倒的风险,特别是老年人的跌倒风险较高。
睡眠性瘫痪、入睡前幻觉/醒前幻觉和猝倒样症状
使用本品可能会发生睡眠性瘫痪,在睡眠-觉醒转换过程中无法移动或长达数分钟无法说话,以及入睡前幻觉/醒前幻觉,包括逼真且令人不适的感觉。处方医生在处方本品时应向患者解释这些事件。本品治疗可能会发生类似于轻度猝倒的症状。此类症状包括腿部无力持续数秒至数分钟,这可能发生在夜间或白天,可能不伴随已知的触发事件(例如大笑或受惊)。
复杂睡眠行为
在使用催眠药物时报告了复杂睡眠行为,包括睡行症、梦游驾驶症和在未完全清醒的情况下从事其他活动(例如准备食物和进食,打电话,性交)。这些事件既可发生在既往未使用过催眠药物的人群中,也可发生在已使用过催眠药物的人群中。患者通常不记得这些事件。首次或后续使用本品后可能会出现复杂睡眠行为,无论是否合并使用酒精和其他 CNS 抑制剂。如果患者出现复杂睡眠行为,应立即停用本品。
呼吸功能受损患者
已在短期临床试验中对轻度至重度阻塞性睡眠呼吸暂停(OSA)患者和中度至重度慢性阻塞性肺病(COPD)患者中对本品进行了研究。如果给呼吸功能受损的患者处方本品,应考虑本品对呼吸功能的影响。阻塞性睡眠呼吸暂停(OSA):在一项针对轻度阻塞性睡眠呼吸暂停患者(呼吸暂停-低通气指数 < 15 次/每小时睡眠)的研究中,莱博雷生不会增加呼吸暂停事件的发生频率或降低平均外周毛细血管血氧饱和度。在一项针对中度或重度阻塞性睡眠呼吸暂停患者(呼吸暂停-低通气指数 ≥ 15 次/每小时睡眠)的研究中,总体而言,莱博雷生不会增加呼吸暂停事件的发生频率或降低平均外周毛细血管血氧饱和度。慢性阻塞性肺病(COPD):在一项针对中度或重度慢性阻塞性肺病患者的研究中,总体而言,莱博雷生不会增加呼吸暂停事件的发生频率,也不会降低平均外周毛细血管血氧饱和度。
抑郁加重/自杀想法
在失眠患者中进行的临床研究显示,接受本品治疗的患者的自杀想法或任何自杀行为的发生率(根据问卷评估)高于安慰剂组(10 mg 组为 0.3%,5 mg 组 0.4%,安慰剂组 0.2%)。接受催眠类药物治疗的原发性抑郁症患者报告了抑郁加重以及自杀想法和行为(包括自杀既遂)。此类患者可能有自杀倾向,需要采取保护措施。这类患者中有意过量用药更常见;因此,每次都应处方最低数量的片剂。当出现任何新的令人担忧的行为迹象或症状时,都需要立即仔细评估。
需要评估共病诊断
由于睡眠障碍可能是某种医学和/或精神疾病的表现,应在仔细评估患者之后再开始治疗失眠。治疗 7 至 10 日后失眠症状仍未缓解,可能提示存在原发性精神和/或医学疾病,应进一步评估。接受本品等催眠类药物治疗期间,可能出现失眠加重或新的认知或行为异常,这可能是由尚未发现的精神或医学基础疾病导致的。
【药物滥用和药物依赖】
药物滥用
滥用是指为了达到预期的心理或生理效果,故意、非治疗性使用药物,即使只有一次。在消遣性使用镇静剂的药物滥用者中(n = 29)开展了一项评估药物滥用潜在可能性的研究,以药物滥用者主观评估的指标呈阳性(例如“喜欢药物”、“总体喜欢药物”、“再次用药”和“良好的药物作用”)来进行比较,经莱博雷生 10 mg、20 mg(最大推荐剂量的两倍)和 30 mg(最大推荐剂量的三倍)治疗后产生的阳性反应,与镇静剂唑吡坦(30 mg)和苏沃雷生(40 mg)产生的阳性反应具有统计学相似性,并显著高于安慰剂所产生的阳性反应。有酒精或其他药物滥用或成瘾史的个体,本品滥用和成瘾风险可能升高,因此应仔细随访这类患者。
药物依赖
身体依赖是反复用药后形成的生理适应的状态,表现为突然停药或显著减少药物剂量后出现的戒断体征和症状。评价身体依赖的动物研究和临床试验显示,长期给予莱博雷生在停药后没有产生戒断体征或症状。这说明莱博雷生不会产生身体依赖。
用药过量的临床经验有限。在临床药理学研究中,健康患者服用多剂量高达75 mg(最大推荐剂量的7.5倍)的莱博雷生片后,嗜睡频率呈剂量依赖性增加。
对于过量的莱博雷生片没有特效解毒剂。在用药过量的情况下,应使用任何用药过量管理的标准医疗实践。在管理用药过量时,提供支持性护理,包括密切的医疗监督和监测,并考虑多种药物参与的可能性。
尚未使用莱博雷生确定透析在药物过量治疗中的价值。由于莱博雷生与蛋白质高度结合,血液透析预计不会有助于清除莱博雷生。
尚无关于孕妇使用本品评估重大出生缺陷、流产或不良母胎结局的药物相关风险的可用数据。对8名妇女进行的哺乳研究的可用数据表明,莱博雷生被转移到哺乳母亲的母乳中,结果确定婴儿平均每日剂量为0.0029mg/kg/天,婴儿相对剂量小于母亲剂量的2%。这些数据支持莱博雷生向母乳中的转移率较低(见数据)。没有关于莱博雷生对母乳喂养婴儿的影响或对产奶量的影响的数据。应监测通过母乳暴露于本品的婴儿是否过度镇静。母乳喂养对发育和健康的益处应与母亲对本品的临床需求一起考虑,以及本品或潜在母体疾病对母乳喂养婴儿的任何潜在不利影响。在儿科患者中的安全性和有效性尚未确定。在受控的3期临床试验中,接受本品治疗的患者总数为1418例(n=1418),其中491例年龄在65岁及以上,87例年龄在75岁及以上。总体而言,年龄小于65岁患者的疗效结果与年龄≥65岁患者的疗效结果相似。 在对研究1(前30天)和研究2的汇总分析中,年龄≥65岁且服用10 mg本品的患者出现嗜睡症状的发生率(9.8%)高于年龄小于65岁的患者(7.7%)。服用5 mg 本品的患者中,年龄≥65岁(4.9%)和年龄小于65岁(5.1%)的患者出现嗜睡症状的发生率相似。无论年龄大小,服用安慰剂的患者出现嗜睡症状的发生率均为2%或更低。由于本品可能增加嗜睡和困倦感,患者,尤其是老年患者,跌倒风险更高。对于年龄≥65岁的患者,使用高于5 mg的剂量时需谨慎。
与本品具有临床重要相互作用的药物
强、中和弱CYP3A抑制剂
与强、中或弱CYP3A抑制剂同时使用会增加莱博雷生的AUC和Cmax,从而可能增加莱博雷生不良反应的风险。避免将莱博雷生与强或中度CYP3A抑制剂同时使用。含弱CYP3A抑制剂的莱博雷生的最大推荐剂量为5mg。
强和中等CYP3A诱导剂
与强中度CYP3A诱导剂同时使用可减少莱博雷生的暴露量,这可能会降低本品的疗效。
酒精
合并使用酒精会增加莱博雷生的Cmax和AUC。当在莱博雷生的tmax附近(给药后2小时)进行评估时,与单独使用酒精相比,联合使用莱博雷生和酒精对姿势稳定性和记忆力产生了更大的负面影响。
本品拼对其他药物的影响
CYP2B6底物
合并使用莱博雷生会降低CYP2B6底物药物的AUC,这可能会导致这些合并用药的疗效降低。应监测同时接受莱博雷生和CYP2B6底物的患者是否有足够的临床反应。可以根据需要增加CYP2B6底物的剂量。
EISAI MANUFACTURING LIMITED
86979086000764;86979086000771
莱博雷生治疗失眠的作用机制被认为是对食欲素受体的拮抗作用。食欲素神经肽信号系统在觉醒中发挥作用,阻断促醒神经肽食欲素 A 和食欲素 B 与其受体 OX1R 和 OX2R 的结合被认为可以抑制觉醒。
莱博雷生可与食欲素受体 OX1R 和 OX2R 结合(IC50 值分别为 6.1nM 和 2.6nM)且为竞争性拮抗剂。莱博雷生的主要代谢产物 M10 以原形药相当的亲和力与 OX1R 和 OX2R 结合(IC50值分别为 4.2nM 和 2.9nM)。
遗传毒性
莱博雷生 Ames 试验、体外小鼠淋巴瘤细胞 Tk 基因突变试验、大鼠体内微核试验结果均为阴性。
生殖毒性
雌性大鼠于交配前 2 周至妊娠期第 6 天经口给予莱博雷生 30、100、1000 mg/kg/天[以 AUC 计,约为人最大推荐剂量(MRHD)10 mg/天的 12、60、>500 倍],100、1000 mg/kg 剂量下动情周期不规律和妊娠率降低,1000 mg/kg 剂量下黄体数、胚胎着床数和活胎数降低。雄性大鼠于交配前 4 周和交配期间经口给予莱博雷生 30、100、1000 mg/kg/天(以 AUC 计,高剂量约为 MRHD 的 138 倍),未见对雄性大鼠生育力的影响。
在两项大鼠胚胎-胎仔发育毒性试验中,妊娠大鼠于器官发生期经口给予莱博雷生 60、200、600 mg/kg/天或 20、60、200 mg/kg/天(以 AUC 计,约为 MRHD 的 6->300 倍),600 mg/kg/天剂量下可引起母体毒性(体重和摄食量降低)、胎仔平均体重降低、死胎数增加、骨骼、外观和内脏畸形(脐膨出、颚裂、膜性室间隔缺损),NOAEL(200 mg/kg/天)约为 MRHD 的 143 倍(以 AUC 计)。妊娠兔于器官发生期经口给予莱博雷生 10、30、100 mg/kg/天(以 AUC 计,约为 MRHD 的 7-139 倍),100 mg/kg/天剂量下可见母体毒性(体重和摄食量降低)、胎仔骨骼变异率升高(存在颈肋和多余肺叶),NOAEL(30 mg/kg/天)约为 MRHD 的 23 倍(以 AUC 计)。
妊娠大鼠于妊娠第 6 天至哺乳期第 20 天经口给予莱博雷生 30、100、300 mg/kg/天(以 AUC 计,约为 MRHD 的 15-206 倍),300 mg/kg/天剂量下可见母体毒性(包括体重和摄食量降低)和子代毒性(包括仔鼠体重降低、股骨长度降低和听觉惊跳反应减少),NOAEL(100 mg/kg/天)约为 MRHD 的 93 倍(以 AUC 计)。
致癌性
大鼠 2 年致癌性试验中,经口给予莱博雷生 30、100、300 mg/kg/天(雄性)和 10、30 和 100 mg/kg/天(雌性),高剂量高于 MRHD 的 80 倍(以 AUC 计),未见肿瘤发生率升高。TgrasH2 小鼠 26 周致癌性试验中,经口给予莱博雷生 50、150、500 mg/kg/天,未见肿瘤发生率升高。
其他
小鼠经口给予莱博雷生 10、30 mg/kg 时,当给予巧克力时可诱发小鼠猝倒行为。巧克力作为一种刺激物已被证明可升高嗜睡小鼠的猝倒发生率。
莱博雷生 2.5 至 75 mg 单次给药后,Cmax几何平均值和 AUC0-24 h增加略小于剂量比。在这一剂量范围内,稳态时莱博雷生的累积程度是 1.5 至 3 倍。
吸收
莱博雷生的浓度达峰时间(tmax)约为 1 至 3 小时。
食物的影响
给予高脂肪和高卡路里饮食(蛋白质、碳水化合物和脂肪分别含有约 150、250 和 500-600 卡路里)后,莱博雷生 Cmax下降 23%,AUC0-inf增加 18%,tmax延迟 2 小时。
分布
莱博雷生的分布容积为 1970L。莱博雷生的体外血浆蛋白结合率约为 88%,在临床样品中约为 94%。莱博雷生的血液/血浆浓度比为 0.65。
清除
代谢
莱博雷生主要由 CYP3A4 代谢,少量由 CYP3A5 代谢。主要循环代谢产物为 M10。
排泄
口服给药后,粪便中可回收剂量的 57.4%,尿液中可回收剂量的 29.1%(<1% 为原型药物)。莱博雷生 5 mg 和 10 mg 的有效半衰期分别为 17 小时和 19 小时。
心脏电生理学
对两项在健康受试者中进行的随机、双盲、安慰剂对照、多剂量递增研究中的数据进行了浓度-QTcF 分析,分析显示 5 倍最大推荐剂量的莱博雷生不会使 QTcF 间期产生任何有临床意义的延长。
特殊人群
根据年龄、性别、人种/种族或体质指数,未观察到莱博雷生药代动力学的临床显著差异。尚未在儿科患者中进行莱博雷生的药代动力学研究。
肾功能不全
重度肾功能不全患者的本品暴露(AUC)增加。重度肾功能不全患者的嗜睡风险可能升高。
肝功能不全
中度肝功能不全(Child-Pugh B 类)患者的本品暴露(AUC 和 Cmax)和终末半衰期均增加。建议中度肝功能不全(Child-Pugh B 类)患者调整剂量。轻度肝功能不全(Child-Pugh A 类)患者的本品暴露(AUC)增加,但终末半衰期无变化。轻度肝功能不全患者的嗜睡风险可能升高。
片剂
5 mg;10 mg
14片/板,2板/盒
储存在20°C~25°C室温下;放在儿童接触不到的地方。
国药准字HJ20250057;国药准字HJ20250058

