信玖凝说明书
Dalnacogene ponparvovec Injection
波哌达可基
活性成份:波哌达可基(携带优化人凝血因子IX基因表达盒的重组腺相关病毒)。
辅料:山梨醇、磷酸氢二钠、磷酸二氢钾、氯化钾、氯化钠、泊洛沙姆188、人血白蛋白和注射用水。
本品为冻存于西林瓶中的液体 , 输注前需要解冻 , 融化后为无色澄明液体 , 几乎澄清 。
用于治疗中重度血友病 B (先天性凝血因子IX缺乏症) 成年患者。
单次静脉输注。
1.用药剂量
根据患者体重计算用药体积
本品的用量为 5x 10Λ12 vg/kg体重 。
按照以下公式计算并向上取整 , 得到所需用药体积:
用药体积 (ml) =体重×1.25
*体重: 实测体重数值 , 保留 1 位小数 , 单位 : kg
*系数1.25=(5×10^12) vg/kg+(4.0×10^12)vg/ml,给药剂量:5×10^12vg/kg;产品基因组滴度:4.0×10^12 vg/ml
按照以下公式计算并向上取整 , 得到所需药品瓶数 :
瓶数 (瓶) =用药体积÷2
*系数 2 : 2 ml每瓶
举例 : 患者A体重70 . 5kg , 用药体积为 88 . 125 ml , 向上取整数为 89 ml (给药体积为 89 ml) 。 所需药品 44 . 5 瓶 , 向上取整数为45 瓶 。

2.1 输注前准备
输注前需检测患者抗腺相关病毒(AAV)843 的中和抗体和结合抗体,符合中和抗体滴度 ≤ 1:4、结合抗体 ≤ 1:200 的患者方可输注本品。输注前进行凝血因子 IX 抑制物检测,如果该患者凝血因子以抑制物阳性,则该患者无法使用本品。输注前进行肝脏健康评估,包括:肝功能检测[丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、-谷氨酰转移酶(GGT)、碱性磷酸酶(ALP)和总胆红素等、肝脏超声和甲胎蛋白(AFP)、肝炎病毒(例如乙肝、丙肝)检测。在肝脏影像学异常和/或持续转氨酶升高的情况下,建议进一步评估是否可以使用本品。例如,由肝病/消化科专家会诊,必要时进一步检测腹部 CT,核磁共振成像(MRI),无创肝脏弹性硬度及脂肪变检测等。如果出现【禁忌】中的情况,则不适合使用本品。评估患者对糖皮质激素和/或其他免疫抑制治疗的接受能力,确保患者可接受免疫抑制的相关风险。在输注本品前,可能需要根据伴随的免疫抑制治疗方案调整疫苗接种计划。
2.2 输注前用药
输注本品前 1 天,建议使用 1 次外源性凝血因子 IX 产品作为止血支持。预防性应用口服糖皮质激素(泼尼松或者泼尼松龙)。
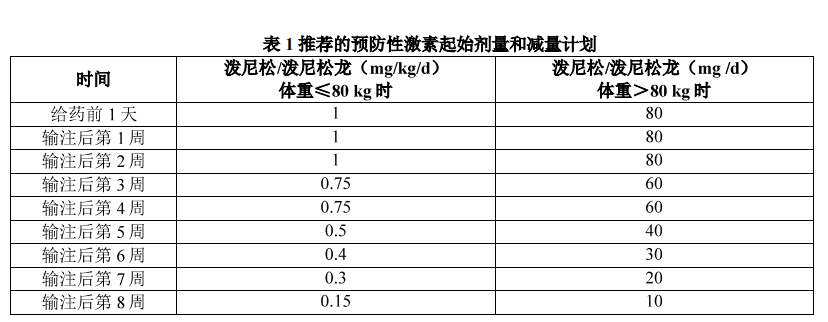 临床医生可根据患者病史及检验、检查指标调整应用激素起始剂量和减量方案。
临床医生可根据患者病史及检验、检查指标调整应用激素起始剂量和减量方案。2.3 输注时准备
2.3.1 药品融化
取出冷冻保存的药品,于室温条件下(10-30 ℃ )静置融化,融化过程中,不可剧烈震荡或翻转,避免产生气泡。完全融化后,检查瓶身应无破损或裂缝,瓶内药品应为无色澄明液体。解冻后不允许再次冻存。自本品从冷冻条件取出,应在室温条件下 8 小时内使用完毕。
2.3.2 药品配制
配制前,确保药品完全融化,无可见冰晶;本品应在配备生物安全柜的医院使用,在生物安全柜内采用无菌操作技术(即洁净、无菌)进行配制。按照计算所得的药品瓶数,用合适大小(例如,50 mL)和数量的一次性无菌聚丙烯注射器,依次抽取完全融化后的药品,仅抽取所需注射体积的药物。配制过程中,避免快速抽取和推出药物,不可剧烈震荡或翻转,避免产生气泡配制好的产品,应在恢复至室温后使用。
2.4 输注给药
输注本品前应确保有完善的急救药物和设备。输注本品时建议全程使用心电及血压、血氧监护设备,并在医务人员的指导和监督下进行。建立静脉通路,建议使用留置针,给药前使用适量 0.9% 化钠溶液冲洗管路,确保静脉通路通畅。使用注射泵给药,设置给药速度为 2.5 mL/min,注射器完成给药后及时更换,确保装有本品的注射器均完成给药。更换注射器时无需冲管。输注后,使用适量 0.9% 氯化钠溶液冲洗管路,确保残留在管路中的本品全部输注至患者体内。本品应单独输注,不得与其他药物混合。自本品从冷冻条件取出,至全部给药完毕,应避免阳光直射,在 8 小时以内完成。如有药品泄露,应使用已证实对非包膜病毒有活性的消毒剂(如次酸钠溶液)进行处理。本品为重组腺相关病毒产品,请遵循医疗卫生机构医疗废物管理办法进行处理,处置可能与药品接触过的一次性材料和打开后未使用的本品,以避免潜在的传播。
2.5 用药后监测 输注后至少 3 小时内应密切监测患者生命体征,后依据下述建议进行相关指标的监测。
2.5.1 肝转氨酶监测
定期进行肝转氨酶检查,以监测可能提示免疫介导的肝毒性的肝转氨酶升高。在给药后,如果肝转氨酶(ALT 和/或 AST)>1.5 倍基线或 ALT 和/或 AST 高于正常值上限(ULN),应增加监测频率,并应考虑实施糖皮质激素干预。对于药物相关的肝转氨酶升高且需要糖皮质激素治疗的患者,推荐首选口服泼尼松作为治疗用药,根据肝转氨酶恢复的情况逐渐减量停药,泼尼松给药剂量可参考预防性激素使用,见表 1。如果有糖皮质激素使用禁忌、无效或有糖皮质激素的不良反应需要停药,可以考虑其他免疫抑制疗法(如他克莫司、西罗莫司等,具体使用可参考相关药物说明书,但本品临床试验中使用数据有限)。
2.5.2 凝血因子 IX 活性监测
定期监测凝血因子 IX 活性,具体监测频率可由临床医生根据患者实际情况而定。
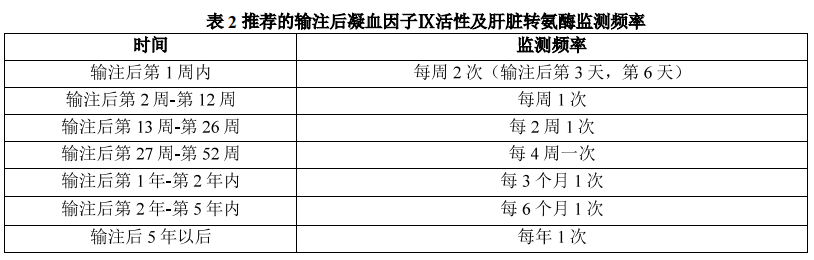
在没有凝血因子 IX 抑制物产生的证据下,当凝血因子 IX 活性有持续下降趋势时,应增加凝血因子 IX 活性监测频率,并考虑实施糖皮质激素干预。推荐口服泼尼松作为首选用药,根据凝血因子区活性恢复的情况逐渐减量停药,泼尼松给药剂量可参考预防性激素使用,见表 1。当凝血因子 IX 活性 ≥ 150% 时,应增加凝血因子 IX 活性监测频率及增加凝血功能监测,评估可能形成血栓的风险。在手术或侵入性操作之前,应检测凝血因子 IX 活性,评估出血风险。使用不同的检测方法可能会影响凝血因子 IX 检测结果,因此,应尽可能使用相同的检测方法和试剂对患者进行长期监测。在使用本品后,如使用外源性凝血因子 IX 产品可能会干扰内源性本品表达的凝血因子活性的评估。 2.5.3 凝血因子 IX 抑制物监测
使用本品之后,如果出血未得到控制,或血浆凝血因子 IX 活性水平下降,则应进行给药后凝血因子 IX 抑制物检测。
2.5.4 其他监测
使用本品之后,建议定期进行甲胎蛋白(AFP)水平检测和腹部超声检查(例如,每年一次)。
1.临床试验经验
I /II期临床试验中的不良反应为天门冬氨酸氨基转移酶升高 (33 . 3%) 、丙氨酸氨基转 移酶升高 (16 . 7%) 、 Y -谷氨酰转移酶升高 (16 . 7%) 、 发热 (16 . 7%) 、 心悸 (16 . 7%) 。
III期临床试验中的不 良反应为丙氨酸氨基转移酶升高 (26 . 9%) 、 血纤维蛋白原降低 (11 . 5%) 、 天门冬氨酸氨基转移酶升高 (7.7%) 、 淋巴细胞计数升高 (7 . 7%) 、 中性粒细胞 计数升高 (7 . 7%) 、 Y -谷氨酰转移酶升高 (3 . 8%) 、 白细胞计数升高 (3 . 8%) 、胆汁酸增多 (3 . 8%) 、 尿蛋白检出 (3 . 8%) 、 纤维蛋白 D-二聚体升高 (3 . 8%) 、 血肌酐升高 (3 . 8%) 、 血尿素升高 (3 . 8%) 、 发热 (3 . 8%) 、 头痛 (3 . 8%) 、视物模糊 (3 . 8%) 等。
严重程度为 1 ~2级 。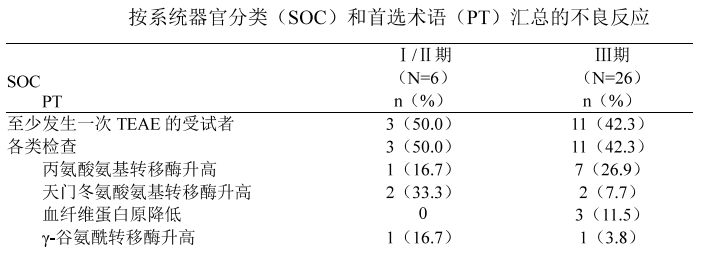
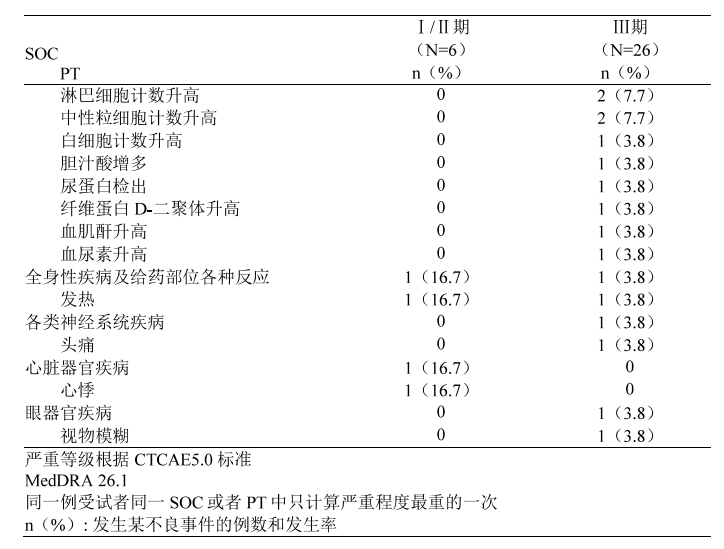
2.重要的不良反应
2.1肝脏毒性
在III期临床试验中 , 使用本品后 , 与研究药物相关的肝脏毒性事件的发生率为 26 . 9% , 具体包括丙氨酸氨基转移酶升高 (26 . 9%) 、 天门冬氨酸氨基转移酶升高 (7. 7%) 、y-谷氨酰 转移酶升高 (3 . 8%) 、胆汁酸增多 (3 . 8%) 。肝脏毒性事件发生的中位时间为 35 天 (范围 : 4 至364天) , 中位持续时间为 10天 (范围 : 4至 71 天) 。 除了 1 例受试者给药后4天出现2级 丙氨酸氨基转移酶升高外 , 其余肝脏毒性事件均为 1 级 。其中 28 . 6% (2/7) 受试者接受了合 并用药治疗 (1 例受试者使用保肝药多烯磷脂酰胆碱胶囊干预 , 严重程度为2级; 1 例受试者 使用保肝药双环醇片干预 , 严重程度为 1 级) , 其余受试者均未采取相关干预措施。
2.2输液相关反应
使用本品后 , 输液相关反应具体包括发热 。
I /II期临床试验中 1 名受试者输液过程中发生 1 例次 1 级心悸 , 随后进行输注全程的心 电 、血压 、血氧监测 , 给药顺利完成 , 该不良反应在本品给药后 1 天痊愈 , 未导致停药 , 未 导致输液中断 。输注后 24 小时内该例患者脉搏保持在 79 至 94 次/分 , 血压 、呼吸 、体温均 正常。 III期临床试验中 1 名受试者在输注结束后 2 小时出现最高严重程度为 2 级的发热 , 间 断给予退烧药复方对乙酰氨基酚片对症处理 , 本品给药后 4天痊愈 。
1 . 已知对本品活性成份或任何辅料发生超敏反应的患者禁用 。
2 .活动性肝炎患者禁用 。
3 . 有潜在的肝脏疾病患者禁用 , 如以往诊断为门静脉高压 、脾大 、肝性脑病或肝纤维化 ≥3 期; 或经 B 超发现有肝脏结节 、囊肿 , 或实验室检查提示甲胎蛋白升高等 , 经医生判断 这些异常情况具有临床意义 。
4 . 存在未清除的凝血因子IX抑制物的患者禁用 。
5 . 对任何凝血因子IX过敏的患者禁用 。
1.输液相关反应
本品输注时可能发生输液相关反应 。症状包括寒战 、发热 、皮疹 、头晕 、头痛 、胸闷 、 腹痛 、 呼吸困难 、喘息 、晕厥 、血压异常 (低血压或高血压) 等 。
由于输注前已开始使用糖皮质激素 , 在整个输注期间以及输注结束后至少 3 小时内密切 监测患者输液相关反应的体征或症状 。
在本品给药过程中如发生输液相关反应时 , 可减缓输注 , 或暂停输注直至症状缓解 。重 新开始输注时 , 应以较慢的速度重新开始 。可使用糖皮质激素或抗组胺药等对症处理 。
2.肝毒性
静脉注射肝靶向 AAV 载体可导致肝转氨酶升高 , 尤其是 ALT 升高 。给药后肝转氨酶升 高被认为可能是免疫介导的肝细胞损伤而导致的 , 并可能降低基于 AAV 载体基因治疗的治 疗效果 。
使用本品后应定期监测转氨酶水平 , 以降低潜在肝毒性的风险 。所有出现肝转氨酶升高 的患者应增加监测频率 , 直到肝转氨酶恢复到基线水平。
使用本品后如果肝转氨酶升高 , 可考虑实施糖皮质激素治疗 , 同时监测凝血因子X活性。
在使用本品后建议患者限制饮酒 , 尤其是输注后第一年 , 因酒精可能会导致肝细胞损伤 , 并可能随着时间的推移降低凝血因子X活性 。
3.预先存在的抗AAV843抗体
在基于 AAV载体的基因治疗中 , 预先存在的抗 AAV 中和抗体和结合抗体可能会阻碍转 基因表达至理想的治疗水平 。在本品治疗前 , 需检测患者抗 AAV843 的中和抗体和结合抗体 , 符合中和抗体滴度≤1 :4 、 结合抗体≤1:200 的患者才可输注本品 。本品临床试验中未纳入抗 AAV843 结合抗体和中和抗体超出范围 (结合抗体>1 :200 、 中和抗体>1 :4) 的受试者 , 在
此类患者中疗效和安全性尚不确定 。
4.血栓栓塞性事件
治疗血友病 B 的 AAV 基因治疗产品 , 当表达的凝血因子X活性提高至≥正常值上限 (ULN) 时 , 可能存在血栓形成风险 。
本品的临床试验入组的受试者中 , 无静脉或动脉血栓栓塞史的受试者入组 , 无此部分患 者临床疗效及安全性的研究数据 。
本品输注前后应评估患者的血栓风险 , 包括一 般心血管危险因素 。建议告知患者用药后 当凝血因子X活性超出正常范围时有形成血栓的风险 。 出现血栓事件的症状或体征时 , 应建 议患者立即就医 。
5.致癌性风险
从理论上讲 , 靶向肝脏的 AAV载体药物有 DNA整合到肝细胞基因组中 , 并诱发肝细胞 癌的风险 。AAV载体药物也存在整合到其他组织基因组中的可能性。
本品由非复制的重组AAV843载体组成 , 其DNA主要以游离形式存在 。非临床研究中 , 对给予本品的非人灵长类动物的肝脏样本进行分析 , 在选定的癌症相关的 979 个基因附近均 未发现本品的整合分布 。 临床试验中受试者给药后随访 52周没有观察到恶性肿瘤发生 。
输注本品后 , 一旦有恶性肿瘤发生 , 应及时联系上市许可持有人。
6.对男性及女性生育的影响
因随访时间有限 , 临床试验期间 , 没有观察到本品对女性或男性生育能力影响 。
在非临床研究中 , 并未发现本品对大鼠的生育力存在影响 。
在男性精液中 , 完成载体脱落 (定义为连续三次检测结果低于检测限) 的 28 例 (87 . 5%) 受试者中 , 最长观察到的载体脱落时间为 113 天 。 尚有 4例 (12 . 5%) 受试者在 52 周时至少 1 次载体脱落检测低于检测限 , 但未完成连续 3 次检测结果低于检测限 , 未能确定最终完成 载体脱落。
男性患者在输注本品后 , 建议有效避孕至少 1 年 , 1 年后如有生育计划 , 建议联系上市 持有人检测精液中载体脱落情况 , 并咨询医生是否可备孕 。
7.特殊人群
7.1 肾功能不全
本品的临床试验未纳入肌酐>176 . 8 μmol/L 的患者 , 本品在这些患者中的安全性和有效 性尚未确定。
7.2肝功能不全
本品的临床试验未纳入 ALT 、AST 、 总胆红素水平高于正常上限 1 . 5 倍的患者; 未纳入 乙型肝炎表面抗原 (HBSAg) 或乙型肝炎病毒脱氧核糖核酸 (HBV-DNA) 阳性 、丙型肝炎 病毒核糖核酸 (HCV-RNA) 阳性 、 或正在接受乙肝和丙肝抗病毒治疗的患者; 未纳入有潜 在的肝脏疾病 , 如以往诊断为门静脉高压 、脾大 、肝性脑病或肝纤维化≥3 期等的患者 。本 品在这些患者中的安全性和有效性尚未确定 。
8.其他注意事项
载体脱落的防护: 静脉注射本品后, 在血液、 精液、 尿液、 粪便和唾液中可能发生载体 脱落 。为降低向他人传播的风险 , 在直接接触患者分泌物或排泄物时采取适当的防护措施 , 接触后注意接触部位的清洁。
抗AAV抗体产生:本品治疗后,会产生抗AAV843抗体,因可能存在交叉反应,接受本品治疗后可能无法使用其他AAV治疗产品。
血液及组织、器官的捐赠:不建议本品治疗的患者捐献血液、器官、组织和细胞用于移植,以尽量减少接触非目标个体的风险。
凝血因子K抑制物产生:目前,血友病B患者的AAV基因治疗中,没有公开报道有抑制物产生的情况。本品临床研究入组的受试者中,未纳入抑制物阳性的受试者,没有此部分患者疗效及安全性的数据。入组受试者接受本品治疗后,未发生凝血因子IX抑制物阳性。患者使用本品之后,如果出血未得到有效控制,或血浆凝血因子X活性水平下降等情况,则应进行给药后凝血因子IX抑制物检测。
围手术期管理: 根据血友病管理的现行治疗指南, 并根据患者当前的凝血因子IX活性水 平 , 在手术 、侵入性操作之前 , 应检测凝血因子IX活性 , 如果评估认为本品表达的凝血因子 X活性不足以充分止血时 , 可能需要外源性凝血因子IX产品或其他止血产品 。
无药物过量使用的数据 。若出现药物过量 , 应立即停药 , 并密切监测患者是否出现不良 反应的症状或体征 , 立即给予适当的对症治疗 。
无孕妇及哺乳期妇女使用本品的临床研究数据 。无孕妇及哺乳期妇女使用本品的临床研究数据 。无 18 岁以下儿童使用本品的临床研究数据 。无老年患者使用本品的临床研究数据 。
无药物相互作用的数据 。
在本品输注后 , 应监测已有的用药 , 并且需要根据患者的肝脏状况和风险评估已有的用药 。 当开始使用新药物时 , 建议密切关注对肝功能和凝血因子IX活性水平的潜在影响 , 避免 使用有明确肝毒性的药物 。
输注本品之后接受免疫抑制治疗的患者不应接种活疫苗 。
上海勉亦生物科技有限公司
86985418000012
本品是腺相关病毒载体基因治疗产品,旨在将能编码高活性人 FIXPadua 突变体(hFIXPadua)基因的功能性拷贝导入细胞,本品以 AAV843 为载体,其可转导肝细胞,而肝细胞是 FIX 天然合成的场所。血友病 B 患者单次静脉输注本品,本品可进行细胞转导并使血液循环中的 FIX 活性升高。
遗传毒性
本品未开展遗传毒性试验。对食蟹猴单次给药观察期 13 周的一般毒理学试验中的 3 例肝脏样本进行了载体基因组整合分析,载体 DNA 大多以未整合至宿主基因组中的游离 DNA 形式存在,整合频率较低,且未发现整合位点偏好性(包括癌症相关基因附近)。
生殖毒性
在一项生殖毒性试验中,雄性大鼠于交配前 9 周单次静脉输注本品 1.71 × 1013vg/kg、6.84 × 1013vg/kg(约为人推荐剂量 5 × 1012vg/kg 的 3.4 倍和 13.7 倍),与未给药雌性大鼠进行交配,未见对雄性大鼠生育力、胚胎-胎仔发育和 F1 子代发育的影响,在亲代雄鼠精子和 F1 代仔鼠全血、肝脏、雄鼠附睾和睾丸、雌鼠子宫和卵巢中均未检测到载体 DNA。
致癌性
本品未开展致癌性试验。
在 BBM001-CLN1001 临床研究中,以 5 × 1012vg/kg(N = 32)的剂量输注本品后,评估了受试者外周血单个核细胞(PBMC)、血浆、精液、唾液和尿液中本品载体 DNA 的脱落情况。载体脱落采用定量聚合酶链反应(qPCR)方法检测,连续三次检测结果为阴性(即低于检测限,LOD)则确定为载体脱落完全。接受本品输注的 32 例受试者中,在全部受试者的血浆(32 例[100.0%])和尿液(32 例[100.0%])中,在 31 例(96.9%)受试者的唾液中、28 例(87.5%)受试者的精液中、21 例(65.6%)受试者的 PBMC 中 AAV 载体脱落已完成。已完成 AAV 载体脱落的受试者中,AAV 载体脱落平均值(标准差)、中位(最小值,最大值)时间分别为:血浆 125.6(37.99)、139.5(43,184)天;尿液 10.0(5.84)、7.0(7,24)天;唾液 79.3(43.71)、69.0(30,157)天;精液 32.4(25.84)、29.5(7,113)天:PBMC 181.5(43.45)、224.0(59,228)天。
注射剂
8.0×10^12 vg(2 ml)/瓶
本品为注射剂 , 采用中硼硅玻璃管制注射剂瓶 (2 ml) 、注射液用覆聚四氟乙烯/六氟丙烯共聚物膜氯化丁基橡胶塞 (13 mm) 和抗生素瓶用铝塑组合盖 (13 mm) 包装 。 2 ml/瓶 。 1 瓶/盒 。
本品应于- 80℃+10℃冷冻避光保存和运输 。本品自冷冻保存条件取出后 , 可在室温条件 下 (10℃ ~30℃) 储存不超过 8 小时 , 包括配制和输注时间 。避免阳光直射。
24 个月
国药准字S20250016

