伊喜宁说明书
Ebronucimab Injection
伊努西单抗
活性成份:伊努西单抗(全人源抗前蛋白转化酶枯草杆菌蛋白酶9[PCSK9]单克隆抗体)。
辅料:海藻糖、蔗糖、聚山梨酯80(II)、组氨酸、盐酸和注射用水。
本品为无色至淡黄色澄明液体,可略带乳光。
在控制饮食的基础上,与他汀类药物、或者与他汀类药物及其他降脂疗法联合用药,用于在接受中等剂量或中等以上剂量他汀类药物治疗后,仍无法达到低密度脂蛋白胆固醇(LDL-C)目标的原发性高胆固醇血症(包括杂合子型家族性和非家族性高胆固醇血症)和混合型血脂异常的成人患者,以降低低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、载脂蛋白B(ApoB)水平。
用量:
本品的推荐剂量为150mg,每2周一次(Q2W);450mg,每4周一次(Q4W),基于患者在给药频率和每次注射剂量方面的喜好选择。
当开始伊努西单抗治疗后,如果患者没有按计划按时给药,指导患者按照如下原则用药:对于接受 Q2W/O4W注射的患者,均可允许给药时间最长延迟至本次计划给药日后的第7天,并继续按照原有给药计划进行下一次给药。若相对于计划给药日延迟超过7天,指导患者尽快用药并根据此日期重新制定新的给药计划。
当对接受伊努西单抗的患者的LDL-C水平进行监测时,必要时可结合患者在给药间隔期间LDL-C水平进行给药频率和剂量的调整。当改变剂量方案时,在原有给药方案的下一次计划给药日期进行新方案的首次给药。
用法:
腹部皮下注射。
使用一次性预充式自动注射笔(简称“自动注射笔”)或一次性预灌封注射器,在非柔嫩、淤青、红肿或变硬的部位通过皮下注射给予伊努西单抗。
如果使用450mg剂量,建议选择不同的注射部位,不得在同一注射部位同时多次注射本品,或在同一部位同时注射本品与其他注射用药物。
未进行相容性研究,因此勿将本品与其他药品混合。
给药前,应目检是否存在颗粒物或变色情况。如果溶液变色或出现可见颗粒物,不得使用。
本品储存于2-8℃冰箱中。从冰箱取出后,应将本品放置于室温环境30分钟以上恢复至室温,并在 24小时内完成给药注射。请勿使用其他方法升温。取下自动注射笔笔帽/预灌封注射器护针帽后需在2分钟内开始注射。
在接受医护专业人员适当的皮下注射技术指导后,患者或陪护人员方可自行使用自动注射笔完成本品注射。
患者和陪护人员应接受皮下注射技术指导,包括无菌操作技术以及如何正确使用自动注射笔。
应提醒患者和陪护人员在使用本品前仔细阅读患者须知和使用说明书。
应告知患者和陪护人员不得重复使用自动注射笔,并就使用后的安全处理方式提供指导。预灌封注射器仅限于医护专业人员使用,非专业人员(患者和陪护人员)不可自行使用。
特殊人群:
肝功能损伤
轻度或中度肝功能损伤患者无需调整剂量,尚无重度肝功能损伤患者的研究数据。
肾功能损伤
轻度或中度肾功能损伤患者无需调整剂量,尚无重度肾功能损伤患者的研究数据。
老年人群
未观察到不同年龄亚组患者之间存在安全性和有效性的明显差异,老年人群无需调整剂量。
儿童人群
尚无18岁以下儿童及青少年中的安全性和有效性数据。
本品说明书的安全性信息来自5项随机、双盲、安慰剂对照研究(1项Ⅱ期研究和4项关键注册研究)及1项长期开放安全性随访II期研究,所有患者均接受稳定的中高强度他汀联合或不联合依折麦布治疗。共纳入1596例接受本品治疗的患者(693.5患者-年暴露),其中80%为心血管超高危或极高危患者。所有接受本品治疗的患者中,573例接受了150mg Q2W的本品治疗,688例接受了450mg Q4W的本品治疗,124例接受了600mgQ6W的本品治疗;558例(35.0%)的患者接受本品治疗≥24周,261例(16.4%)的患者接受本品治疗≥52周。
在上述6项涉及原发性高胆固醇血症和混合性高脂血症患者(包括HeFH)的研究中,最常见的(接受本品治疗发生率≥2%)不良反应为注射部位反应、上呼吸道感染以及高尿酸血症。
在接受本品治疗的患者中,最常见的导致治疗停止的不良反应为注射部位反应。
在上述6项研究中,524例(32.8%)接受本品治疗的患者年龄≥65岁,其中51例(3.2%)≥75岁。不同年龄亚组间在安全性方面未观察到显著差异。
不良反应汇总表
表1列出了本品在临床研究中观察到的不良反应。以下不良反应按系统器官分类和发生频率列出。基于合并所有6项临床研究中的不良事件发生率,计算所有事件的发生频率。频率定义为:十分常见(≥1/10),常见(>1/100至<1/10),偶见(≥1/1,000至<1/100),罕见(≥1/10,000至<1/1000),十分罕见(<1/10,000)。在各个频率组中,不良反应按首选术语的频率降序排列。
表1 使用本品治疗患者的不良反应汇总表*
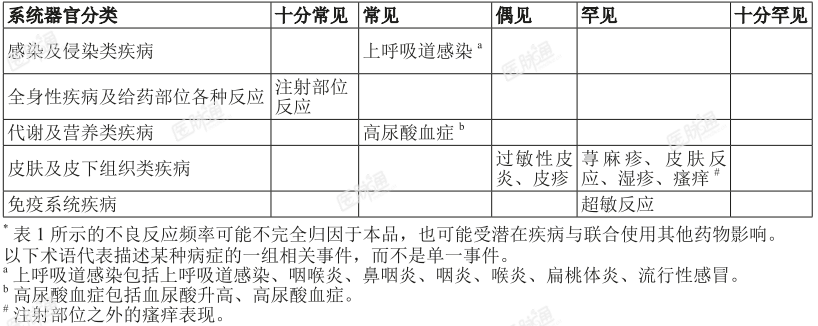
特定不良反应描述
注射部位反应
安慰剂对照阶段,本品治疗组和安慰剂组分别有10.7%和0.9%的患者报告了注射部位反应,整体治疗阶段本品治疗组有12.5%的患者报告了注射部位反应。包括注射部位的红肿/红斑、皮疹、瘙痒或硬结等。注射部位反应均为CTCAE1~2级,多数为一过性。本品由注射部位反应所致的停药率为0.7%。
过敏反应
临床研究中本品治疗组中共发生了13 例注射部位以外的过敏反应,其中5例为过敏性皮炎(均为1~2级),3例为皮疹和1例为瘙痒,均为1级;皮肤反应、湿疹和超敏反应各1例,均为2级;罕见报告了1例3级严重过敏反应(荨麻疹)。所有过敏反应均已痊愈。
免疫原性
所有治疗用蛋白质均有发生免疫原性的可能。抗体形成的检出高度依赖于检测方法的灵敏度和特异性。此外,一种检测方法中观察到抗药抗体(ADA)和中和抗体(NAb)阳性率可能受到多种因素的影响,包括检测方法、样本处理、样本采集时间、合并用药、基础疾病以及人群差异。因此比较不同产品的 ADA发生率时应慎重。
基于1345例接受了至少一次伊努西单抗治疗的原发性高胆固醇血症(包括HeFH)和混合型高脂血症患者的数据,基线后伊努西单抗治疗产生的ADA 阳性率为9.4%(126/1345),其中,基线后治疗产生的ADA阳性且NAb阳性率为7.1%(95/1345)。
基于 121 例接受了至少一次伊努西单抗治疗的HeFH 患者的数据,基线后伊努西单抗治疗产生的ADA 阳性率为8.3%(10/121),其中,基线后治疗产生的 ADA阳性且NAb 阳性率为6.6%(8/121)。
HeFH 患者治疗产生的 ADA 阳性率/NAb 阳性率和总体人群(原发性高胆固醇血症[包括 HeFH]混合型高脂血症患者)相似。
免疫原性的发生对伊努西单抗的药代动力学特征、安全性和有效性没有临床显著影响。
对伊努西单抗活性成份或其中的任何辅料成份过敏者禁用。
在临床研究中报告了一般过敏反应(例如,过敏性皮炎、皮疹、湿疹、皮肤反应、超敏反应和瘙痒),以及罕见且有时严重的过敏反应(例如,荨麻疹)。如果出现严重过敏反应的体征或症状,则必须停止本品使用,根据标准治疗方案进行过敏反应的治疗,并进行监测直至体征和症状缓解。
对驾驶和操作机器能力的影响
本品对驾驶车辆和操作机器能力无影响或影响可忽略。
临床研究中尚未报告过药物过量病例。若出现药物过量,必须密切监测患者不良反应的症状和体征,并进行适当的对症治疗。
尚未确立本品在儿童患者中的安全性和疗效。群体药代分析显示,年龄对伊努西单抗的PK特征没有显著影响,不同年龄亚组患者之间的安全性和有效性无明显差异。老年患者应用本品治疗时无需进行剂量调整。尚无妊娠女性使用本品的数据。本品是一种重组免疫球蛋白G1(IgG1)抗体,因此预期可透过胎盘屏障。动物研究显示本品对维持妊娠或胚胎-胎仔发育有间接影响。不建议在妊娠期间使用本品,除非妇女的临床状况需要使用本品进行治疗。 与他汀类药物联合治疗 他汀类药物禁用于妊娠妇女。请参见各自的现行说明书信息。尚不清楚本品是否经人乳分泌。人免疫球蛋白G(IgG)经人乳分泌,特别是初乳,不建议哺乳期妇女在此期间使用本品。在哺乳的其余期间,预计暴露量较低。由于本品对母乳喂养婴儿的影响未知,因此在此期间,应决定停止哺乳或停用本品。 与他汀类药物联合治疗 他汀类药物禁用于哺乳期妇女。请参见各自的现行说明书信息。
尚未开展伊努西单抗的药物相互作用临床研究。
伊努西单抗对其他药品的影响:
由于伊努西单抗是一种生物药品,预期对其他药品无药代动力学影响,对细胞色素P450酶也无影响。
其他药品对伊努西单抗的影响:
已知他汀类药物和依折麦布可增加PCSK9蛋白(即伊努西单抗的靶点)的产生,这可能导致靶点介导的清除率增加以及伊努西单抗的暴露量降低。
基于群体药代分析,伊努西单抗联合中强度和联合高强度他汀受试者的PK特征没有显著差异;伊努西单抗未联合依折麦布和联合依折麦布受试者的PK特征没有显著差异。基于暴露-效应关系分析,他汀类药物强度和是否联合依折麦布对疗效没有临床显著影响。
伊努西单抗与不同强度他汀类药物合并使用时无需进行剂量调整,伊努西单抗与依折麦布合并使用时也无需进行剂量调整。
康融东方(广东)医药有限公司
86985159000012;86985159000029
伊努西单抗是一种针对人前蛋白转化酶枯草溶菌素9(PCSK9)的全人源单克隆IgG1亚型抗体。伊努西单抗与PCSK9结合,抑制循环中的PCSK9与LDLR的结合,从而阻止PCSK9介导的LDLR降解,使得LDLR可重新循环至肝细胞表面。伊努西单抗通过抑制PCSK9与LDLR结合,导致能够清除血液中低密度脂蛋白的LDLR 的数量增加,从而降低LDL-C水平。
生殖毒性
大鼠生育力与早期胚胎发育毒性试验中,雄鼠于交配前 4周和交配期间、雌鼠于交配前2周至妊娠第6天每周1次皮下注射伊努西单抗30、100、300mg/kgL以AUC计,高剂量约为人最大推荐剂量(600mgQ6W)的10倍],未见对雌雄大鼠生育力和早期胚胎发育的不良影响。
大鼠胚胎-胎仔发育毒性试验中,妊娠大鼠于器官发生期每周1次(妊娠第6和13天)皮下注射伊努西单抗30、100、300 mg/kg,各剂量组可见母体毒性,包括体重、摄食量降低、明显肝毒性甚至引起死亡,100、300mg/kg组伴流产;100、300mg/kg组可见胚胎-胎仔毒性,包括子宫连胎重降低、晚期吸收胎增加、胎盘异常率升高,胎仔骨骼数目减少、骨骼骨化率降低、未骨化率升高,300mg/kg组可见活胎数减少、着床丢失率增加、胎仔肋骨短小和骨骼变异发生率升高,100mg/kg组还可见胎仔尿管扩张发生率升高;30 mg/kg(以AUC计,约为人最大推荐剂量的4倍)剂量时,未见对胚胎-胎仔发育的不良影响。
大鼠围产期毒性试验中,大鼠于妊娠第6天至哺乳期第21天每周1次(共给药6次)皮下注射伊努西单抗3、10、30mg/kg(以AUC计,高剂量约为人最大推荐剂量的4倍),未见对母体分娩、子代生长发育的影响。
伊努西单抗皮下注射给药后可经大鼠胎盘或乳汁转运至胎仔或仔鼠。
致癌性
伊努西单抗尚未进行致癌性试验。
原发性高胆固醇血症和混合型高脂血症
在5项随机、双盲、安慰剂对照研究评价了伊努西单抗的有效性和安全性。包括4项关键注册性研究(AK102-301、AK102-302、AK102-303、AK102-201)和1项支持性研究(AK102-203)。共纳入1197例原发性高胆固醇血症(包括HeFH)和混合型高脂血症患者,877例接受伊努西单抗,320例接受安慰剂。所有患者均在稳定的他汀联合或不联合依折麦布基础上接受伊努西单抗或者安慰剂治疗。
AK102-301、AK102-302和AK102-303为原发性高胆固醇血症(均包括HeFH患者)和混合型高脂血症关键Ⅲ期临床研究,入组人群相似,包括心血管危险分层超高危、极高危、高危和中低危的患者,随访时间分别为12周、24周和52周。
AK102-201为HeFH关键注册性研究,入组人群为心血管极高危和高危HeFH患者,共107例患者,在稳定的最大耐受剂量或高强度他汀联合或不联合依折麦布基础上接受伊努西单抗或安慰剂治疗,随访时间为12周。
AK102-203为双盲对照支持性研究,入组人群为心血管极高危和高危高胆固醇血症患者,随访时间为12周。
1197例患者中,877例伊努西单抗组34.3%的患者患有2型糖尿病,78.2%存在冠状动脉粥样硬化性心血管病(ASCVD)病史,33.4%和49.3%为心血管超高危人群和极高危人群。伊努西单抗和安慰剂之间基线人口统计学特征基本匹配。
伊努西单抗针对两项适应症的12周短期降脂疗效和52周长期降脂疗效相当。在他汀背景治疗基础上,伊努西单抗150mg Q2W、450mg Q4W和600mg Q6W给药方案均能实现有效降低LDL-C的作用。150mg Q2W和450mg Q4W给药方案可使LDL-C较基线水平降低65%左右。伊努西单抗52周长期治疗可维持平稳的降脂疗效超过60%。
伊努西单抗同时能明显降低血清TC、非HDL-C、ApoB和Lp(a)水平,还可升高HDL-C和ApoA-I水平。
在不同年龄、性别、体重指数(BMI)、基线LDL-C水平、心血管危险分层、有ASCVD病史、糖尿病、高血压、慢性肾病患者中均观察到LDL-C一致降低,各亚组间结果差异不具有临床意义。无论他汀剂量水平如何以及是否联用依折麦布,LDL-C降低幅度一致。HeFH人群和总体人群降脂疗效一致。
表2 总结了基于以上5项研究汇总分析,伊努西单抗组治疗12周时 LDL-C及其他主要血脂参数较基线的平均百分比变化。
表2 伊努西单抗治疗12周血脂指标较基线的平均百分比变化汇总分析(原发性高胆固醇血症和混合型高脂血症患者)

图1 安慰剂对照研究汇总分析中伊努西单抗组各时间点LDL-C较基线的平均百分比变化(他汀类联合或者不联合依折麦布背景治疗基础上)
12周双盲安慰剂对照研究
研究1(AK102-301)是一项多中心、随机、双盲、安慰剂对照的12周研究。共纳入464例患者,所有患者均接受稳定的中高强度他汀联合或不联合依折麦布治疗。309例患者随机分配到伊努西单抗组,其中154例接受伊努西单抗150mg Q2W治疗,155例接受伊努西单抗450mg Q4W治疗,155例患者随机分配到安慰剂组。患者基线平均年龄为59.8岁(范围:29岁~70岁),男性占60.5%,心血管超高危类型占57.3%,心血管极高危类型占29.9%,伴ASCVD病史者占75.5%,有高血压病史者占75.3%,有糖尿病病史者占38.6%,有慢性肾脏疾病病史者占6.1%。对疑似家族性高胆固醇血症的患者进行了基因检测,HeFH 患者占2.6%。主要终点为治疗12周时 LDL-C水平较基线的百分比变化。
治疗12周时,伊努西单抗和安慰剂比较的LDL-C平均百分比变化的差异,伊努西单抗150mg Q2W和450mg Q4W分别为-60.43%(95%CI:-65.45%,-55.42%;P<0.0001)和-59.13%(95%CI:-64.10%,-54.15%;P<0.0001)(表3)。其他血脂指标结果见表3。
表3 伊努西单抗治疗12周血脂指标较基线的平均百分比变化(AK102-301)

52周双盲安慰剂对照研究
研究2(AK102-303)是一项多中心、随机、双盲、安慰剂对照的52周研究。共纳入122例患者,所有患者均接受稳定的中高强度他汀联合或不联合依折麦布治疗。92例患者随机分配到伊努西单抗450mg Q4W组,30例患者随机分配到安慰剂组。患者基线平均年龄为58.9岁(范围:26岁~77岁),男性占58.2%,心血管极高危类型占90.2%,伴ASCVD病史者占90.2%,有高血压病史者占86.1%,有糖尿病病史者占35.2%,有慢性肾脏疾病病史者占7.4%。对疑似家族性高胆固醇血症的患者进行了基因检测,HeFH患者占3.3%。主要终点为治疗52周时 LDL-C 较基线的百分比变化。
治疗52周时,伊努西单抗450 mg Q4W和安慰剂的LDL-C平均百分比变化的差异为-52.70%(95%CI:-62.42%,-42.98%;P<0.0001)(表4和图2)。其他血脂指标结果表4。
表4 伊努西单抗治疗52周血脂指标较基线的平均百分比变化(AK102-303)

图2 安慰剂对照长期研究中伊努西单抗组各时间点LDL-C较基线的平均百分比变化(他汀类联合或者不联合依折麦布背景治疗基础上)
HeFH
4项随机、双盲、安慰剂对照研究共纳入136例HeFH患者(接受伊努西单抗106例,安慰剂30例),评价在该人群中伊努西单抗的有效性和安全性。所有患者均在稳定的他汀联合或不联合依折麦布基础上接受安慰剂或者伊努西单抗治疗。
4项研究包括1项关键注册性研究(AK102-201)和3项支持性研究(AK102-301、AK102-302和AK102-303)。
136例患者中,106例伊努西单抗组16.0%的患者患有2型糖尿病,64.2%的患者存在ASCVD病史,9.4%和55.7%为心血管超高危人群和极高危人群,51.9%的患者使用了高强度他汀。伊努西单抗和安慰剂之间基线人口统计学特征基本匹配。
HeFH人群与原发性高胆固醇血症和混合型高脂血症人群降脂疗效一致。
表5 总结了基于以上4项研究汇总分析伊努西单抗组治疗12周时LDL-C较基线的平均百分比变化。
表5 伊努西单抗治疗12周血脂指标较基线的平均百分比变化汇总分析(HeFH 患者)


研究3(AK102-201)是一项多中心、随机、双盲、安慰剂对照的12周研究。共纳入109 例患者,所有患者均接受稳定的高强度他汀或最大耐受剂量的他汀联合或不联合依折麦布治疗。83例患者随机分配到伊努西单抗组,其中29例接受伊努西单抗150mgQ2W治疗,28例接受伊努西单抗450mg Q4W治疗,26例接受伊努西单抗300mg Q4W治疗,26例患者随机分配到安慰剂组。患者基线平均年龄为49.3岁(范围:20岁~69岁),男性占53.3%,伴ASCVD病史者占36.4%,67.3%的患者接受高强度他汀类药物治疗,所有患者均经过临床或基因检测诊断为HeFH。研究主要终点为治疗12周LDL-C 较基线的百分比变化。
治疗12周时,伊努西单抗和安慰剂的LDL-C平均百分比变化的差异,伊努西单抗150mg Q2W和450mgQ4W分别为-60.73%(95%CI:-76.62%,-44.84%;P<0.0001)和-57.43%(95%CI:-73.38%,-41.47%;P<0.0001)(表6)。其他血脂指标结果见表6。
表6 伊努西单抗治疗12周血脂指标较基线的平均百分比变化(AK102-201)

在健康人中开展的AK102-101研究显示,在75mg~500mg剂量范围内伊努西单抗存在靶点介导的消除,呈非线性动力学特征。
基于7项临床研究共878例受试者的群体药代分析:
吸收
单次皮下(SC)注射150 mg、450 mg和600 mg 伊努西单抗后,血清浓度达峰时间(Tmax)中位值为5天。
分布
单次皮下(SC)注射150mg、450mg和600mg伊努西单抗后,表观分布容积(Vz/F)均值(标准差)分别为19.4(7.57)L、10.9(4.37)和9.65(4.16)L。
代谢
尚未进行特异性的代谢研究。
消除
观察到伊努西单抗的两个消除相。在低浓度时,以PCSK9靶点介导的药物清除为主,药物清除速率较快;在高浓度时,以非特异性酶降解清除为主,药物清除速率较慢。
基于群体药代分析,在150mg Q2W、450mg Q4W和600mg Q6W给药方式下,伊努西单抗消除的有效半衰期为11.8~14.2天;稳态下平均血药浓度(Cavg)分别为10.8μg/mL、20.3μg/mL和17.6μg/mL;稳态下暴露量(AUC)的蓄积比分别为2.03、1.31和1.1。伊努西单抗非特异清除率(CL/F)约为0.617L/Day。
特殊人群
本品尚未开展特殊人群的临床研究。
基于群体药代分析,随着体重的增加(40~121 kg)伊努西单抗的暴露水平有所降低,这些差异不具有临床意义。
肝功能损伤
基于群体药代分析,与肝功能正常受试者相比,轻度及中度肝功能损伤未对PK产生显著影响;尚无重度肝功能损伤受试者的研究数据。
肾功能损伤
由于已知单克隆抗体不会通过肾脏途径清除,肾功能预计不会影响伊努西单抗的药代动力学。群体药代动力学分析显示,与肾功能正常受试者相比,轻度及中度肾功能损伤未对PK产生显著影响,无需进行剂量调整;尚无重度肾功能损伤受试者的研究数据。
遗传药理学
本品尚未开展直接评价基因变异对药代动力学影响的临床研究。
基于群体药代分析,HeFH 受试者与非 HeFH 受试者相比,伊努西单抗暴露量(AUC 和Cmax)无临床显著差异。
注射剂
预充式自动注射笔:150 mg(1.5 mL)/支;预灌封注射器:150 mg(1.5 mL)/支
本品直接接触药品的包材为:预灌封注射器组合件(带注射针)、预灌封注射器用溴化丁基橡胶活塞。 1支/盒:一次性预充式自动注射笔、一次性预灌封注射器。
于2-8°C避光保存和运输,避免剧烈晃动,请勿冷冻。
18个月
国药准字S20240042;国药准字S20240041

