奥瑞舒说明书
阿可拉定软(淫羊藿素软)
淫羊藿素。
本品适用于不适合或患者拒绝接受标准治疗、且既往未接受过全身系统性治疗的、不可切除的肝细胞癌,患者外周血复合标志物满足以下检测指标的至少两项:AFP≥400 ng/mL;TNF-α<2.5 pg/mL;IFN-γ≥7.0 pg/mL。本品基于随机对照Ⅲ期临床试验富集人群的期中分析数据获得附条件批准上市,本适应症的完全批准将取决于计划开展的确证性试验证实本品的临床获益。
本品必须在有肿瘤治疗经验的医疗机构中的专业技术人员指导下使用,服用本品前,必须获得经充分验证的检测方法证实的 AFP、TNF-α、IFN-γ检测结果。本品的推荐剂量为一次6粒,口服,一日2次,于早、晚餐后30分钟温水吞服。如果患者漏服一次药物且无法在餐后2小时内服用,则应按计划进行下一次服药,无需补服。
临床试验期间,常见不良反应(≥1%):胃肠系统疾病:腹泻、恶心、腹胀、呕吐、腹痛、便秘、口干、胃肠出血。代谢及营养类疾病:食欲减退、低磷酸血症。肾脏及泌尿系统疾病:蛋白尿、血尿症。全身性疾病及给药部位各种反应:乏力、发热、体重降低、盗汗、多汗。心脏器官疾病:室上性期外收缩、室性期外收缩。血液及淋巴系统疾病:贫血。皮肤及皮下组织类疾病:瘙痒症、皮疹、湿疹。呼吸系统、胸及纵隔疾病:鼻衄。各类神经系统疾病:味觉障碍。各类检查:天门冬氨酸氨基转移酶升高、丙氨酸氨基转移酶升高、血胆红素升高、血碱性磷酸酶升高、γ-谷氨酰转移酶升高、血乳酸脱氢酶升高、血尿酸升高、血小板计数降低、淋巴细胞计数降低、白细胞计数降低、中性粒细胞计数降低、尿中尿胆原增加、心电图T波异常。≥3级不良反应:天门冬氨酸氨基转移酶升高、血胆红素升高、γ-谷氨酰转移酶升高、低磷酸血症、低钾血症、血小板计数降低、淋巴细胞计数降低、贫血、食欲减退、尿蛋白检出、尿中尿胆原增加、血压升高、高血压、上呼吸道感染。
对本品及所含成份(淫羊藿素、玉米油、蜂蜡、明胶、甘油、二氧化钛和黄氧化铁)过敏者禁用。
本品为附条件批准上市,请仔细阅读说明书并在医师指导下使用
肝功能异常:本品临床试验未纳入Child-Pugh肝功能评分>7分的肝细胞癌患者。对于肝功能不全的患者定期监测肝功能。若用药后发生肝功能异常,必要时调整剂量、暂停给药或永久停药。肾功能异常:本品临床试验未纳入中、重度肾功能不全(肌酐清除率<50mL/min)的患者。蛋白尿是本品常见的不良反应,但程度均较轻(1-2级),一般情况下无需调整剂量或停药。对于中、重度肾功能不全的患者定期监测肌酐清除率以及尿蛋白,必要时调整剂量、暂停给药或永久停药。胃肠系统疾病:腹泻、恶心、腹胀、呕吐等胃肠系统疾病是本品临床试验中常见的不良反应,通常发生在治疗早期,且程度均较轻(1-2 级),一般情况下无需调整剂量或停药。对于本身有严重胃肠系统疾病的患者,应密切监测胃肠道不良反应,并在必要时给予对症治疗,或调整剂量、暂停给药或永久停药。血小板计数偏低/凝血功能异常/贫血/低磷酸血症:本品临床试验中常见不良反应包括血小板计数降低、贫血和低磷酸血症。因此,对于血小板计数偏低或凝血功能异常的患者、贫血、低磷酸血症的患者,应在医师指导下,定期监测相应指标的变化,并在必要时给予对症治疗,或调整剂量、暂停给药或永久停药。心肌缺血或心肌梗塞:临床试验中未纳入心肌缺血或心肌梗塞的患者,因此,对于这些患者应密切监测心电图的变化,必要时需调整剂量、暂停给药或永久停药。乳腺增生或子宫内膜增生:建议对患有乳腺增生或子宫内膜增生的患者进行密切观察,必要时需调整剂量、暂停给药或永久停药。乙肝病毒载量≥104copies/mL(2000IU/mL):本品Ⅲ期临床试验纳入患者的乙肝病毒载量(HBV DNA)<104copies/mL(2000IU/mL),建议对于HBV-DNA≥104copies/mL(2000IU/mL)的患者,服用本品前,先接受抗病毒治疗直至HBV-DNA<104 copies/mL(2000IU/mL)。服用本品期间,按照中国临床肿瘤学会发布的《原发性肝癌诊疗指南》对于具有HBV背景的肝细胞癌患者的常规临床建议:监测HBV-DNA以及肝炎活动。
尚无本品用于妊娠期、哺乳期妇女的临床数据,不建议妊娠期、哺乳期妇女使用本品。避孕:具有生育能力的妇女和男性,建议采取有效的避孕措施。
北京康而福药业有限责任公司
86900074000152
非临床药效学试验结果显示, 淫羊藿素对肝癌原位肿瘤模型小鼠有一定的抑瘤作用, 可抑制人肝癌细胞的体外增殖。
遗传毒性:淫羊藿素 Ames 试验、 CHL 细胞染色体畸变试验和小鼠微核试验结果均为阴性。生殖毒性:大鼠生育力与早期胚胎发育毒性试验、 大鼠与兔胚胎-胎仔发育毒性试验、大鼠围产期生殖毒性试验结果均未见与淫羊藿素相关的生殖毒性。致癌性:淫羊藿素尚未进行致癌性试验。其他:Beagle 犬经口给予淫羊藿素 20、 60、 180 mg/kg, 连续给药 9 个月 , 中、 高剂量组可见个别雌性动物乳头及乳腺增大, 组织病理学检查可见腺体、 组织增生,且有一定剂量相关性; 高剂量组动物 9 个月 心电图检查发现 4/8 只动物出现 T 波倒置, ST 段降低。
本品于2009年和2013年由国家药品监督管理局批准临床试验,于2010年11月至2021年11月开展I期临床试验、ⅠB(ⅡA)期临床试验、ⅡB期临床试验和Ⅲ期临床试验。ⅡA和ⅡB期临床试验为单臂临床试验,Ⅲ期临床试验采用多中心、随机、双盲双模拟、华蟾素片平行对照设计,试验设计样本量312例(富集人群130例)。Ⅲ期临床试验纳入人群为:年龄≥18周岁;符合《原发性肝癌诊疗规范》(2017 年版),临床诊断标准和/或经过病理组织/细胞学检查确诊的晚期或已经发生转移的肝细胞癌(HCC)患者,不能够采用肝脏手术和/或其他局部治疗(消融或肝动脉介入),或者手术和/或其他局部治疗后复发进展;先前未接受过针对晚期或已经发生转移的HCC的一线系统治疗;不适合采用《原发性肝癌诊疗规范》(2017 年版)推荐的晚期肝癌一线标准治疗;按照实体瘤反应评估标准(RECIST 1.1),至少具有一个可测量靶病灶;Child-Pugh 肝功能评分A级或较好的B级(≤7 分);体力状况ECOG评分为 0-1;预期生存时间≥12周;主要器官功能符合以下要求:①造血功能:血小板≥60×109/L,血红蛋白≥85g/L,白细胞≥3.0×109/L;以上三项可由主要研究者全面衡量患者的状况,适当放宽为:血小板 50-60×109/L,血红蛋白 80-85g/L,白细胞 2.5-3.0×109/L(含临界值);②肝脏功能:总胆红素≤1.5倍正常值上限(ULN),天门冬氨酸氨基转移酶和丙氨酸氨基转移酶≤5×ULN,白蛋白≥28g/L;③肾脏功能:血清肌酐≤1.5×ULN,或肌酐清除率≥50mL/min;若 HBV-DNA≥104copies/mL(2000IU/mL),必须先行抗病毒保肝治疗,待HBV-DNA<104copies/mL(2000IU/mL)方可入组;并且继续服用抗病毒药物、监测肝功能和乙肝病毒载量。富集人群的定义:外周血复合标志物评分≥2分的患者(即满足以下检测项要求中的两项或三项)①AFP≥400ng/mL(1分)②TNF-α<2.5 pg/mL(1分)③IFN-γ≥7.0pg/mL (1分)。Ⅲ期临床试验给药方法:试验组服用淫羊藿素软胶囊及华蟾素片模拟剂,华蟾素组服用华蟾素片和淫羊藿素软胶囊模拟剂。淫羊藿素软胶囊/模拟剂用法为口服,一次6粒(每粒装0.4g,含淫羊藿素100mg),一日2次,连续服用,直至达到终止治疗标准。华蟾素片/模拟剂用法为口服,一次4片(0.3g/片),一日3次。共纳入全人群282例,其中淫羊藿素组141例,华蟾素组141例;富集人群71例,其中淫羊藿素组33例,华蟾素组38例。Ⅲ期临床试验期中分析富集人群的基线:表 1 富集人群的基线情况
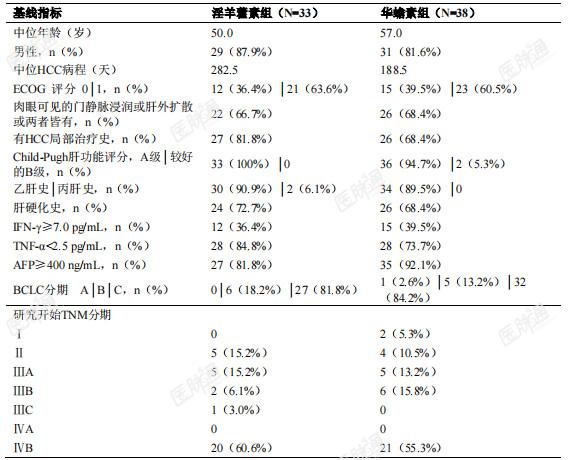
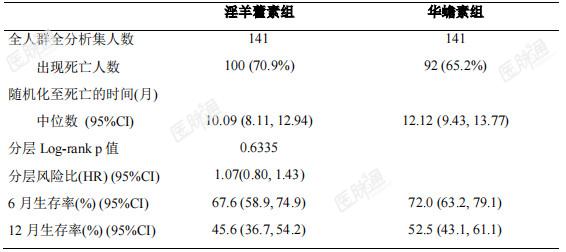
Ⅲ期临床试验期中分析有效性结果:主要疗效指标总生存期(OS)富集人群全分析集:淫羊藿素组和华蟾素组的中位OS及95%CI分别为13.54(7.36,20.07)个月和 6.87(4.93,11.43)个月,分层风险比(HR)及 95%CI 为0.43(0.23,0.82),p=0.0092,小于预设的优效性检验水准 0.0328。全人群全分析集:两组中位OS及95%CI分别为10.09(8.11,12.94)个月和12.12(9.43,13.77)个月,分层HR及95%CI为 1.07(0.80,1.43),p=0.6335,大于预设的优效性检验水准0.05。符合方案分析集与全分析集结论一致。表 2 富集人群主要疗效分析:从随机化至任何死亡时间(OS)-富集人群全分析集
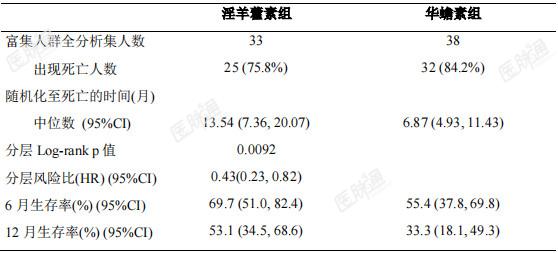
表 3 全人群主要疗效分析:从随机化至任何死亡时间(OS)-全人群全分析集
次要疗效指标:疾病进展时间(TTP)富集人群全分析集:独立影像评估结果,淫羊藿素组和华蟾素组的中位疾病进展时间(mTTP)及95%CI分别为1.87(1.84,3.71)个月和1.84(1.81,1.87)个月,分层HR及95%CI为 0.63(0.34,1.18),p=0.1031。全人群全分析集:独立影像评估结果,淫羊藿素组和华蟾素组的mTTP及95%CI分别为 1.87(1.84,3.61)个月和 1.87(1.84,3.65)个月,分层HR及95%CI 为 1.06(0.78,1.43),p=0.6955。无进展生存期(PFS)富集人群全分析集:独立影像评估结果,淫羊藿素组和华蟾素组的中位无进展生存期(mPFS)及 95%CI分别为 1.9(1.8,3.7)个月和 1.8(1.8,1.9)个月,分层 HR 及 95%CI 为 0.72(0.40,1.29),p=0.2038。全人群全分析集:独立影像评估结果,淫羊藿素组和华蟾素组的mPFS及95%CI分别为 1.9(1.8,2.0)个月和 1.9(1.9,3.7)个月,分层HR及95%CI为1.12(0.84,1.47),p=0.4380。客观缓解率(ORR)富集人群全分析集:独立影像评估结果,淫羊藿素组和华蟾素组的ORR及95%CI分别为 0.0(0.0%,10.6%)和 2.6%(0.1%,13.8%),p=0.3311。全人群全分析集:独立影像评估结果,淫羊藿素组和华蟾素组的ORR及95%CI分别为1.4%(0.2%,5.0%)和 2.8%(0.8%,7.1%),p=0.3834。疾病控制率(DCR)富集人群全分析集:独立影像评估结果,淫羊藿素组和华蟾素组的DCR及95%CI 分别为36.4%(20.4%,54.9%)和23.7%(11.4%,40.2%),p=0.3853。全人群全分析集:独立影像评估结果,淫羊藿素组和华蟾素组的DCR及95%CI分别为34.8%(26.9%,43.2%)和 36.9%(28.9%,45.4%),p=0.6870。安全性结果:本品Ⅰ、Ⅱ、Ⅲ期临床试验,淫羊藿素组共有269例受试者进入安全性数据集。≥3级不良事件:胃肠系统疾病:腹痛、上消化道出血、上腹痛、腹水、胃肠出血、腹胀、恶心、肠梗阻、胃底静脉曲张破裂出血、腹内积液。代谢及营养类疾病:低钠血症、低钾血症、食欲减退、低磷酸血症、高血糖症、高钙血症、高钾血症。全身性疾病及给药部位各种反应:死亡、疼痛、多器官功能不全综合征、乏力、疾病进展、心源性猝死。血液及淋巴系统疾病:贫血、弥散性血管内凝血。血管与淋巴管类疾病:出血性休克、高血压。呼吸系统、胸及纵膈疾病:口咽疼痛、肺栓塞、呼吸困难。感染及侵染类疾病:上呼吸道感染、胆道感染、慢性乙型肝炎、胃肠炎。各类神经系统疾病:大脑出血、肝性脑病、昏迷、脊髓压迫、癫痫。皮肤及皮下组织类疾病:黄色皮肤。肝胆系统疾病:眼黄疸、胆囊炎、肝肾综合征、肝衰竭、肝细胞性黄疸、高胆红素血症、肝脓肿。良性、恶性及性质不明的肿瘤(包括囊状和息肉状):肿瘤出血、癌症疼痛、肿瘤破裂、脊柱转移、进展性肿瘤。各类损伤、中毒及手术并发症:道路交通事故、多发性骨折、股骨颈骨折。眼器官疾病:溃疡性角膜炎。各种肌肉骨骼及结缔组织疾病:背痛、肌痛。各类检查:血胆红素升高、天门冬氨酸氨基转移酶升高、γ-谷氨酰转移酶升高、血碱性磷酸酶升高、淋巴细胞计数降低、血小板计数降低、丙氨酸氨基转移酶升高、体重降低、白细胞计数降低、血压升高、蛋白尿、尿中尿胆原增加、尿酮体存在、血肌酐升高、血尿酸升高、脂肪酶升高、国际标准化比率升高、活化部分凝血活酶时间延长、纤维蛋白降解物升高、血甘油三酯升高、血白蛋白降低、血钙升高。严重不良事件:代谢及营养类疾病:低钠血症、高钙血症、高钾血症、高血糖症。各类损伤、中毒及手术并发症:道路交通事故、多发性骨折、股骨颈骨折。胃肠系统疾病:上消化道出血、肠梗阻、胃肠出血、胃炎、腹内积液。感染及侵染类疾病:胆道感染、感染性肺炎、胃肠炎、脓毒症、肺部感染。各类神经系统疾病:大脑出血、昏迷、颅内出血、肝性脑病、脊髓压迫、癫痫。良性、恶性及性质不明的肿瘤(包括囊状和息肉状):肿瘤出血、脊柱转移、进展性肿瘤。肝胆系统疾病:肝细胞性黄疸、肝肾综合征、肝衰竭、高胆红素血症、肝脓肿、肝功能异常。全身性疾病及给药部位各种反应:死亡、多器官功能不全综合征、发热、疾病进展、心源性猝死。眼器官疾病:溃疡性角膜炎。各种肌肉骨骼及结缔组织疾病:肌痛。呼吸系统、胸及纵膈疾病:肺栓塞、呼吸困难。血管与淋巴管类疾病:出血性休克。各类检查:血小板计数降低。
临床药理学:吸收:晚期乳腺癌患者口服淫羊藿素软胶囊后, 血浆中药物主要以葡萄糖醛酸结合
代谢产物形式存在, 原型药物浓度低; 血浆中加 β-glucuronidase, 把主要代谢产物水解成原型药物后检测原型药物浓度。晚期乳腺癌患者餐后单次口服 8 粒淫羊藿素软胶囊, 血浆中药物达峰时间(T max ) 为 3.0-6.0 h, 峰浓度(C max ) 为 17.9-363.1 ng/mL, 餐后单次服用 16 粒淫羊藿素软胶囊后 T max 为 2.0-4.0 h, C max 为 112.2-395.6 ng/mL。晚期乳腺癌患者餐后口服 2 粒淫羊藿素软胶囊, 每日一次连续口服 28 天,平均稳态峰浓度 C ss ( max ) 为 57.5 ng/mL, 平均稳态谷浓度 Css ( min ) 为 5.3 ng/mL,蓄积比(AUC 0-t 比值) 为 0.9-5.4。晚期乳腺癌患者餐后单次口服 8-16 粒淫羊藿素软胶囊, 与空腹给药相比AUC 0-t 提高 2.1-6.9 倍。分布:晚期乳腺癌患者餐后单次口服 8-16 粒淫羊藿素软胶囊, 分布容积 V z /F 为
1935-65152 L。 在 0.2-200 μg/mL 浓度范围内, 体外淫羊藿素与人血浆蛋白结合率为 82.7-61.3%。代谢:健康受试者单次口服[ 14 C]淫羊藿素后, 血浆中主要检测到 3、 7-双葡萄糖醛
酸结合和 7-葡萄糖醛酸结合代谢产物。消除:晚期乳腺癌患者餐后单次服用 8-16 粒淫羊藿素软胶囊后, 表观清除率 CL/F为 262-6107 L/h, 消除半衰期为 2.0-7.4 h。健康受试者餐后单次口服[ 14 C]淫羊藿素后, 0-96 h 从尿液和粪便中平均总放射性回收率占给药量的 100.62%, 其中大部分通过粪便排泄( 占给药量的100.32%), 粪便中原型药物占 91.8%, 极少量通过尿液排泄(占给药量的 0.30%)。
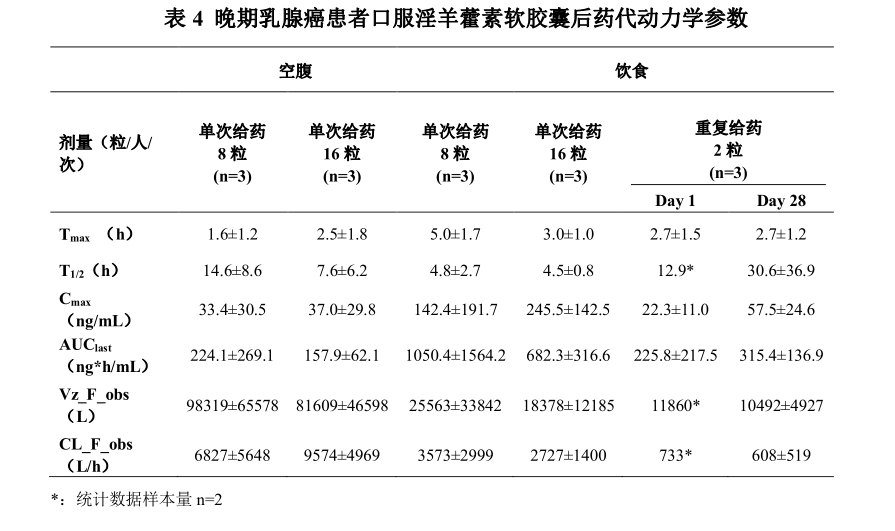
在 I 期临床研究中选择了晚期乳腺癌患者进行药代动力学研究, 在目标适应症患者中尚未进行药代动力学研究, 后续研究正在计划中; 后续研究中继续优化定量检测方法, 进行药代动力学研究。特殊人群药代动力学:本品尚无儿童、 老年人、 肝功能不全患者、 肾功能不全患者的药代动力学试验数据。
胶囊剂
每粒装0.4g(含淫羊藿素100mg)
口服固体药用高密度聚乙烯瓶、药用聚酯/铝/聚乙烯封口垫片。每瓶装60粒,每盒装1瓶。
密封
7000.00
24 个月 。
国药准字Z20220002