迪分说明书
Perflutren Lipid Microsphere Injection
八氟丙烷脂质微球
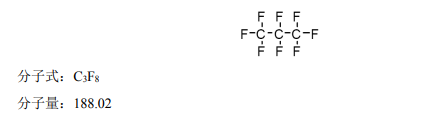
本品活性成份为八氟丙烷。 化学名称:1, 1, 1, 2, 2, 3, 3, 3-八氟丙烷 化学结构式:
辅料:氯化钠、丙二醇、甘油、脂质混合物(1,2-二棕榈酰基-sn-甘油-3-磷脂酸钠、1,2-二
棕榈酰基-sn-甘油-3-磷脂酰胆碱、聚乙二醇, N-(甲氧基聚乙二醇胺 5000 氨基甲酰基)-1,2-二
棕榈酰基-sn-甘油-3-磷脂酰乙醇胺单钠盐)、磷酸二氢钠一水合物、磷酸氢二钠七水合物、注
射用水。
活化前,每瓶上层顶空气体含八氟丙烷为 6.52mg/ml,下层澄明液体含脂质混合物为
0.75mg/ml。
活化后,每瓶最多包含 1.2×1010个八氟丙烷脂质微球以及每瓶 1.5ml 乳液含八氟丙烷的
体积为 225μl。
活化前:上层为无色气体;下层为无色澄明或带乳光的液体,液体表面可能有气泡。 活化后:为乳白色液体,液体表面有泡沫或气泡。
用于常规超声心动图显影不够清晰者,增强左室腔内膜边界的识别。
本品不含防腐剂。在穿刺胶塞后可能会出现细菌污染并带来给药后菌血症的风险。必须 认真遵照本品的制备说明,并在制备过程中严格执行无菌操作。 在使用前必须使用机械振摇装置(VIALMIX®)对本品进行活化。活化后,本品呈乳白 色液体。活化后的产品中八氟丙烷的初始浓度为 150±100μl/ml。 静脉推注给药 本品的建议剂量为单次 10μl/kg 的活化产品,经静脉推注在 30~60 秒内给药,随后给予 10ml 生理盐水进行冲洗。必要时,可以在首次注射 5 分钟后给予第 2 次 10μl/kg 剂量以延长 对比增强超声造影时间。 本品的制备说明: 1)将小瓶放至室温。 2)通过使用 VIALMIX®振摇活化本品(振摇设备内置固化参数为:4530±100 次振荡/分 钟,振荡时间 45 秒)。振摇后本品立刻呈乳白色液体。小瓶内的内容物不得在未经过机械活 化操作的情况下对患者给药。 注:请注意阅读 VIALMIX®使用说明。除非已经在 VIALMIX®中完成了完整的 45 秒钟 的活化周期,否则请勿使用本品。请勿重复活化未完成活化或已经成功活化的本品,请勿使 用功能不佳的 VIALMIX®。 3)使用 18G 至 20G 规格的注射器针头将本品从小瓶内抽出。针头的位置应可以从倒转 的小瓶内的液体中部抽取药液。请勿将空气注入小瓶。 4)如果产品在 VIALMIX®振摇后需要静置超过 5 分钟,那么应当在注射器抽液之前通 过翻转小瓶的方法,手工振摇 10 秒钟,使微球再次混悬。 从安瓿瓶中取出产品后,请立即使用;请勿将产品留在注射器内。 经过活化(上述第 1~2 步)后,本品可以在室温下贮存,但应在制备后 12 小时内使用。 小瓶内的内容物仅用于制备本品,未首先经过制备操作(上述第 1~4 步)不得直接用于患者。小瓶内的内容物仅供 1 名患者使用。 与所有注射用药品一样,给药前,只要溶液和容器允许的情况下,应通过肉眼检查静 脉注射液的澄清度、可见异物、沉淀物、变色及渗漏情况。不得使用出现浑浊、可见异 物、沉淀物、变色或渗漏的溶液。 活化后的小瓶仅供一次性使用,未使用的部分应弃去。
静息状态下的临床试验经验 共有1716例患者在针对活化后本品的临床试验中接受了评价。在该组中,1063例(61.9%) 为男性,653 例(38.1%)为女性;1328 例(77.4%)为白人,258 例(15.0%)为黑人,74 例(4.3%)为西班牙裔,56 例(3.3%)被归类为其他种族或民族组。平均年龄为 56.1 岁(范 围:18 至 93 岁)。其中,144 例(8.4%)患者至少发生过 1 起给药相关的不良反应(表 1)。 死亡和严重不良事件:在所评价的 1716 例使用本品的患者中,有 30 例患者报告了严重 不良事件,其中包括 8 例死亡。所有严重不良事件均被认为与本品给药无关。8 例死亡均发 生于本品给药数天后,且均与基础疾病有关。所报告的其他严重不良事件均与基础疾病的进 展或治疗相关。 终止研究给药:共报告 15 例终止给药,患者平均年龄为 41.5 岁。这些患者中有 9 例是 在首次注射后终止给药。1 例患者出现了过敏反应(荨麻疹和瘙痒),所有其他患者发生了 头晕、胸痛、呼吸困难或背痛。不良事件发生在给药后数分钟(1~15 分钟)内,且均为中 度,通常未经处理在发生后数分钟或数小时内消失。 按年龄、性别和种族进行了亚组分析。<65 岁组与≥65 岁组、男性与女性以及所有种族 或民族之间的不良事件总体发生率均相近。 最常见的不良事件分别来自中枢和外周神经系统(3.1%)、全身(2.4%)和胃肠道系统 (1.8%)。 最常见的给药相关不良事件(AEs)包括头痛(2.3%)、背/肾区疼痛(1.2%)、潮红(1.1%) 和恶心(1.0%)。 表 1 总结了所有给药相关的、新发且在本品研究的所有患者中的发生率≥0.5%的不良事 件。 表 1 给药相关的、新发且在临床试验所有受试者中的发生率≥0.5%的不良事件
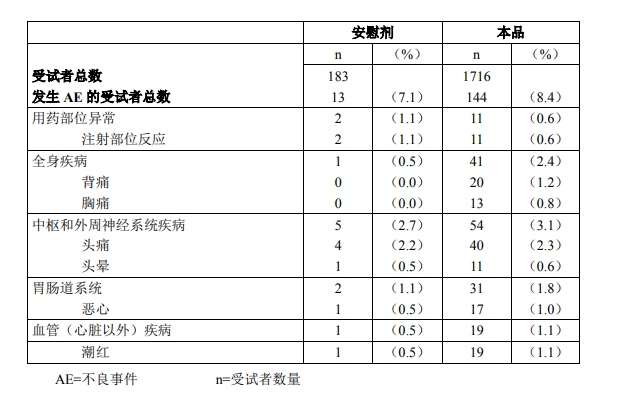
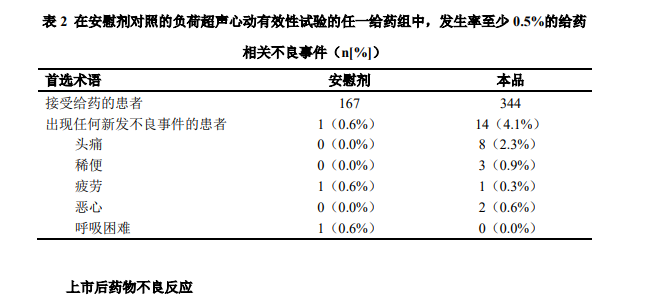
尽管头痛是最常见的不良事件,但其发生率与安慰剂组相近。 安全性表格所列临床试验数据已经表明,本品以建议剂量经静脉推注或输注给药是安全 的,且耐受性良好。 在接受本品的患者中的发生率<0.5%的其他给药相关的不良反应包括: 全身: 疲劳、发热、热潮红、疼痛、寒战和晕厥 心血管: 异常心电图(ECGs)、心动过缓、心动过速、心悸、高血 压和低血压 消化: 消化不良、口干、舌疾病、牙痛、腹痛、腹泻和呕吐 血液学: 粒细胞增多、白细胞增多、白细胞减少、单核细胞增多和 嗜酸性粒细胞增多 肌肉骨骼: 关节痛 神经系统: 下肢痛性痉挛、肌张力亢进、眩晕和感觉异常 血小板,出血和凝血: 血肿 呼吸: 咳嗽、缺氧、咽炎、鼻炎和呼吸困难 特殊感觉: 听力下降、结膜炎、视觉异常和味觉反常 皮肤: 瘙痒、皮疹、红斑疹、荨麻疹、出汗增多和皮肤干燥。泌尿: 蛋白尿和尿液异常 实验室结果异常: 胆红素、AST/SGOT、SGPT/ALT、肌酸激酶、LDH、肌 酐、葡萄糖和非蛋白氮升高 其它: 淋巴结病 负荷状态下的临床试验经验 共有 2455 例患者在针对活化后本品用于负荷超声心动检查的临床试验中接受了评价。 在该组中,1236 例(50.6%)为男性,1208 例(49.4%)为女性,1888 例(77.2%)为白 人,377 例(15.4%)为黑人/非洲裔美国人,176 例(7.2%)被归类为其他种族或民族组。 平均年龄为 58.7 岁(范围:21 至 90 岁)。共发生了 11 例严重不良事件,2445 例患者中 有 9 例(0.4%)由于不良事件而终止给药。 在 1866 例具有非严重不良事件数据的患者中,460 例(24.7%)至少发生了 1 例与给 药相关的不良反应(表 2)。对于所有不良事件而言,<65 岁组不良事件的总体发生率为 21.8%,而≥65 岁组为 30.8%。男性中不良事件的发生率(31.0%)高于女性(18.9%)。最 常见的不良事件为头痛(0.9%)和背痛(0.5%)。 死亡和严重不良事件:在 2445 例接受本品的患者中,未发生死亡,而 10 例(0.4%)患 者共发生 11 例严重不良事件。所有这些严重不良事件均发生在从给药至给药后 7 天内这段 时间,且由患者的基础心脏和非心脏疾病的进展所致。 终止研究给药:共报告了 9 例终止给药。3 例患者发生了高血压,2 例患者发生了心动 过缓,而所有其他与终止给药相关的事件包括:心跳骤停、胸痛、疲劳、背部疾病、背痛、 肌肉痉挛、头痛、晕厥、瘙痒或潮红。不良事件均发生在本品给药后数分钟(3~36min)内。
在本品批准上市后应用期间已发现了下列不良反应。由于这些反应是从一个样本规模不
确定的人群中自愿报告的,因此可靠估计这些反应的发生率或者确定其与药物暴露之间的因
果关系是不太可能的。
在上市后应用中,本品给药期间或之后不久观察到的罕见但严重的不良反应包括:致死
性的心脏或呼吸骤停、低血压、高血压、胸痛、心肌梗死、心肌缺血、晕厥、伴相关症状的
心律失常(心动过缓、房颤、室上性心动过速、室性心动过速或室颤)、缺氧、呼吸窘迫或
氧合作用降低以及意识丧失或癫痫发作(见不良反应和注意事项)。
在本品给药前应备有心肺复苏设备且在有需要时有经验的人员可迅速到场,同时在本品
给药后至少进行 30 分钟的观察以发现急性的反应(见注意事项)。
此外,作为进行中的上市后药物警戒的一部分,已经观察到非常罕见的急性过敏反应(例
如过敏样/类过敏反应和血管性水肿)(见注意事项-过敏反应)。另外已经报告了非常罕见的
中枢神经系统反应,包括意识改变、癫痫和/或癫痫样反应,同时,这些事件可能伴有或不伴
有速发型过敏反应。肌肉骨骼反应包括肌肉痉挛、肌肉骨骼不适、肌痛和颈痛。
请勿将本品给予已知存在下列情况的患者:1.对本品或其成分过敏。2.右向左、双向或短暂右向左心脏分流。 3.本品不得进行直接的动脉内注射给药。4.用于诊断性超声检查的气体造影剂不得在体外冲击波碎石术前24小时内使用。
严重心肺反应:在本品给药期间或之后已有严重心肺反应(包括死亡)的报告。在心、肺状况不稳定的患者(急性心肌梗死、急性冠脉综合症、充血性心衰加重或不稳定、严重的室性心律失常或呼吸衰竭,包括接受机械通气的患者)中发生这些反应的风险可能会增加。在这些患者中,本品给药后应至少密切观察30分钟。本品只有在经过仔细的风险/获益评价之后方可用于此类患者。对所有患者进行评价以发现有无任何妨碍本品用药的情况。当不存在这些基础疾病时,应在本品给药期间及之后对患者进行至少30分钟的密切观察以发现可能出现的严重反应。在上市后应用中,本品给药期间或之后不久观察到的罕见但严重的不良反应包括:致死性的心脏或呼吸骤停、低血压、高血压、胸痛、心肌梗死、心肌缺血、晕厥、伴相关症状的心律失常(心动过缓、房颤、室上性心动过速、室性心动过速或室颤)、缺氧、呼吸窘迫和氧合降低以及意识丧失或癫痫发作在本品给药前应备有心肺复苏设备且在有需要时有经验的人员可迅速到场,同时在本品给药后应对患者进行观察以发现急性的反应。使用本品的诊断性检查应当在1名接受了适当培训且对操作步骤十分熟悉的医生的指导下进行。尚未对本品在肺血管床受损或具有较小血管
一般注意事项 涉及使用静脉注射含气体微泡的超声造影剂的诊断性操作应当在接受了必要的培训且 对在诊断性成像检查的适当设施中进行的操作十分熟悉的医生指导下进行(见注意事项-严 重的心肺和过敏反应)。 应当严格遵照建议的剂量和给药方式以及用于活化本品的操作。 本品应慎用于有药物过敏、哮喘或枯草热以及对多种物质过敏的患者。 尚未进行本品临床试验中所用的机械指数(MI,0.3 至 1.9)与所观察到的心脏异常之间 关联性的特殊分析。尚未明确本品在机械指数>0.8 时的安全性。诊断性超声检查设备的使用 者在任何相关的成像模式中均应使用可合理达到的尽可能低的暴露程度。 心电图(ECG)变化:较高的机械指数(MI)可造成微泡空洞形成或破裂,连同收缩期 末触发一起可能会导致室性期前收缩(PVC)。此外,已报告具有较高 MI 的收缩期末触发可 在给予微球制品后导致室性心律失常。在本品临床试验中,大部分患者均是在≤0.8 的机械指 数下进行成像的。尚未明确本品在 MI>0.8 或使用高机械指数的收缩期末触发时的安全性。 共有 1716 例患者在临床试验中接受了本品。给药相关心血管事件的发生率<0.5%,这 些事件包括:异常心电图(ECGs)、心动过缓、心动过速、心悸、高血压和低血压。2 例患 者发生了处理相关给药相关的心脏不良事件及相关的 QTc 相对于基线的变化(1 例延长,1 例降低)≥30ms。 QTc 间期延长:在 610 例接受静息超声心动检查的受试者(568 例接受本品,42 例接受 安慰剂)中,记录了首次静脉推注高至 40μl/kg 的剂量后最长 72 小时内的 ECG 参数。70 例 (12.3%)接受本品的受试者和 12 例(28.6%)安慰剂组受试者发生了 QTc 延长=30ms。20 例(3.5%)接受本品的受试者和 2 例(4.8%)安慰剂组受试者发生了 QTc 延长>60ms。 在 5 项使用负荷超声心动(运动踏车和药物负荷[多巴酚丁胺和双嘧达莫])的安慰剂对照有效性试验的 509 例患者中,观察了剂量高至 10μl/kg 时的心电图(ECG)参数。在基线、 给药后 0 至 60 分钟以及 24 小时评价了 ECG 参数。在所有 ECG 参数中,除了接受踏车或 药物负荷检查时所预期发生的变化之外,安慰剂组与接受本品的患者的比较仅发现了较小的 组间差异。在 PR、QRS 和 QTc 间期方面未出现显著的本品相关的 ECG 变化。给药后 60 分 钟内的 RR 出现了有统计学意义的增加(7.3[12.55]bpm),该变化在负荷检查过程中是可以 预期的。在安慰剂组,48.5%的患者未出现基线后 QTc 变化≥30ms,而本品为 50.3%。 尽管在临床试验中未发现与本品给药时发生的 QTc 延长相关的严重心脏症状或死亡, 但是某些基础疾病可能会增加室性心律失常的风险。 尚未研究本品对先天性 QT 间期延长或同时接受了已知能够造成 QT 间期延长药物的患 者的影响。 由于临床经验有限,本品在用于下列患者时应非常谨慎,只有在经过仔细的风险/获益 评价之后方可使用:存在致心律失常情况、既往有出现症状的心律失常病史、先天性长 QT 综合征家族史以及同时使用已知能够造成 QTc 延长的药物。在使用本品前进行 ECG 检查有 助于排除上述情况。 为了确保安全且有效地使用本品,建议患者在必要时遵守下列信息和指导: 1)如果其患有先天性心脏缺陷、新近出现了心脏或肺部状况的恶化、既往有对本品或 其他超声心动造影剂的过敏史,应告知医生。 2)本品可能会导致心电图的变化(QTc 间期延长)。 3)本品可能会增加其他药物(例如:西沙必利、红霉素、一些抗精神病药和三环类抗 抑郁药)的 QTc 延长作用。 4)如果正在接受 IA 类(例如:奎尼丁,普鲁卡因胺)或 III 类(例如:胺碘酮,索他 洛尔)抗心律失常药,应告知其医生。 5)当存在任何 QTc 延长的家族史或发生下列致心律失常情况时应告知其医生:近期出 现的低钾血症、显著的心动过缓、急性心肌缺血、有临床意义的伴有左室射血分数降低的心 衰或既往有伴相关症状的心律失常病史。 6)如果已经或可能妊娠或哺乳时应告知其医生。 7)将任何其所接受的药物告知其医生。 8)如果在注射了本品后出现了心悸或昏厥,应与其医生联系。
在临床试验期间,未发生本品药物过量。如果怀疑发生了药物过量,应对症采取支持性 处理措施。
在大鼠和家兔中进行的生殖毒性研究结果表明,本品在剂量高至 1.0ml/kg(在大鼠和家兔中的剂量分别为24倍和15倍最大人体剂量,基于体表面积折算)时不会对胎仔生长、存活或形态发育造成不良影响。目前尚未在妊娠妇女中进行充分且良好对照的研究。由于动物生殖研究并非总是可以预测人体反应,因此本品只有在对母亲的潜在获益大于对胎儿的潜在风险时才可以用于妊娠妇女。尚不知道本品是否可以分泌至人乳中;因此,本品应慎用于哺乳期妇女。
尚未研究本品的药物-药物相互作用。 1)本品可能会增加其他药物(例如:西沙必利、红霉素、一些抗精神病药和三环类抗 抑郁药)的 QTc 延长作用 2)如果正在接受 IA 类(例如:奎尼丁,普鲁卡因胺)或 III 类(例如:胺碘酮,索他 洛尔)抗心律失常药,应告知其医生。 3)将任何其所接受的药物告知其医生。
JUBILANT HOLLISTERSTIER LLC
86984494000015
八氟丙烷脂质微球的声阻抗低于血液,可增强血液回声。在超声心动图检查过程中,活 化的八氟丙烷脂质微球的物理声学性质可增强左心室腔的对比度,并有助于界定左心室心内 膜的边界。 在动物模型中,活化的八氟丙烷脂质微球的声学性质确定为不超过机械指数的0.7倍(1.8 MHz频率)。在临床试验中,大部分患者在不超过机械指数的0.8倍下显影。
遗传毒性: 活化的八氟丙烷脂质微球 Ames 试验、体外哺乳动物细胞基因突变试验、体外人淋巴 细胞染色体畸变试验和大鼠体内微核试验结果为阴性。 生殖毒性: 大鼠和兔给予活化的八氟丙烷脂质微球,按照体表面积换算,分别相当于人体剂量的24 倍和15倍,未见对雄性或雌性动物生育力的明显影响。大鼠从妊娠第6天至第17天静脉注射给予八氟丙烷脂质微球0.1、0.3和1.0 mL/kg/天(按 体表面积换算,约为人体最大推荐剂量的0.8、2.4和8倍),兔从妊娠第7天至第19天静脉注 射给予八氟丙烷脂质微球0.1、0.3和1.0 mL/kg/天(按体表面积换算,约为人体最大推荐剂量 的1.6、4.8和16倍),未见对胚胎-胎仔生长发育的明显影响。 致癌性: 未对活化的八氟丙烷脂质微球进行长期致癌性试验。
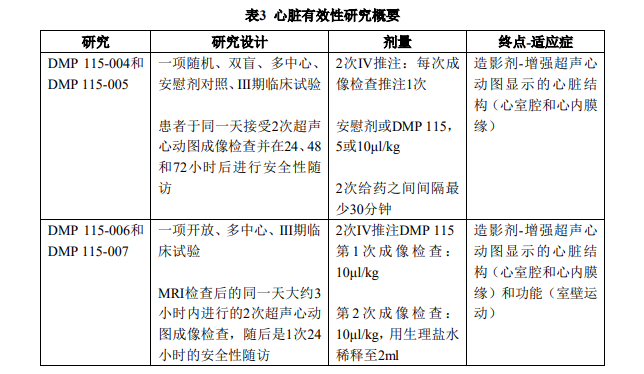
剂量选择试验:DMP 115-901是一项在健康成年男性受试者中进行的I期试验,旨在明确多次静脉推注 本品的安全性和耐受性(主要目的)。该试验比较了逐渐递增的4种本品剂量(5,10,15 和30μl/kg),并将每种剂量与安慰剂进行了比较。一共给予5次(本品或安慰剂)注射; 首次静脉推注之后的另外4次注射,分别于首次注射后大约5、10、60和120分钟给予。本品 在上述剂量下给药是安全的且可以被较好地耐受。由于对在更高剂量(>15μl/kg)下的腔 室造影评估发现了过度的衰减,推荐用于超声心动图成像的量效反应研究使用剂量范围为 5μl/kg ~15μl/kg。 DMP 115-902在接受诊断性超声心动图检查的患者中进行。本品以5,10或15μl/kg的剂 量单次静脉推注给药。在5μl/kg剂量下,增强显影的持续时间均值介于54~102秒。10μl/kg 剂量组最佳显影期均值约为1.5~2分钟,而15μl/kg剂量组约为2.5分钟。但因为造影剂衰减 过度,15μl/kg的剂量在获取临床上有用的造影图像前有明显的时间延迟(85至100秒)。 基于这些发现,在早期的III期心脏病学试验中选择了5和10μl/kg的剂量。 静息超声心动图 在心尖二腔、四腔切面上有≥2个不可评估节段的患者中一共进行了5项关键的III期多中 心临床试验:总计401例患者入组,其中42例患者计划接受安慰剂,359例患者计划接受本 品。接受本品的患者中,计划接受2次5μl/kg剂量85例,计划接受2次10μl/kg剂量274例。患 者平均年龄为55.0(±16.3)岁。表3总结了这些研究。 在接受10μl/kg剂量本品的患者中,174例(63.5%)为男性,100例(36.5%)为女性。
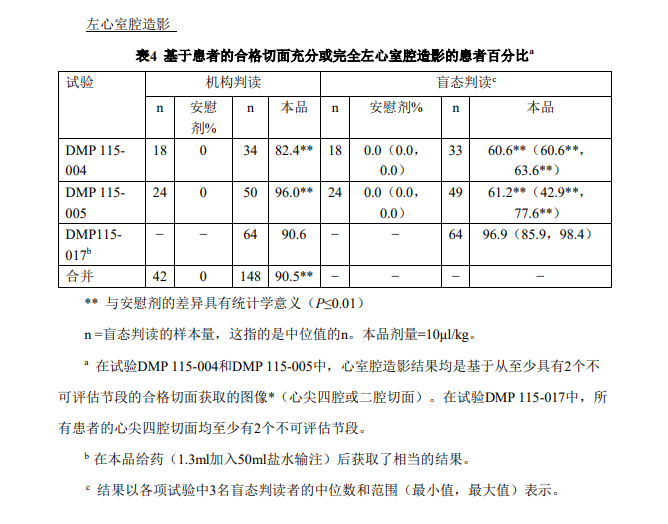
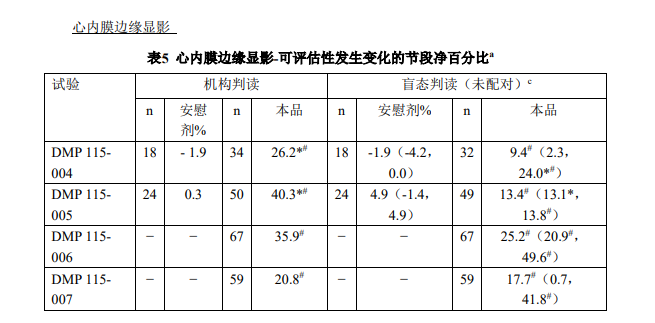
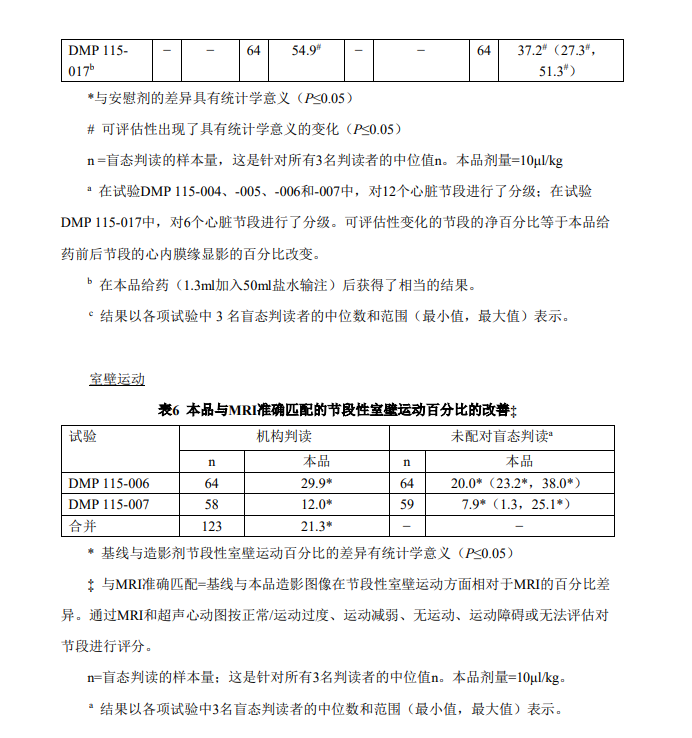
充分或完全心室腔造影的质量评估由多个机构和盲态判读人判定(表4)。机构判读由 临床研究者进行,而盲态判读由独立的没有任何临床或诊断信息的医生/判读者进行。汇总 后的机构判读数据显示:90.5%的患者获得了充分或完全的左心室腔造影,在盲态判读期 间该比例为42.9%至96.9%,而在接受安慰剂-盐水注射的患者中为0%。视频密度定量测定 证实了该质量评估。 通过多个指标明确了本品对心内膜缘显影的改善:(1)可评估心肌节段数目的百分比 改变;(2)在可评估心内膜缘方面改善至少1个节段的患者百分比;(3)在可评估心内膜 缘方面改善至少2个节段的患者百分比;(4)证实超声心动图检查再利用(自≥4个不可评 估心脏节段降低至≤1个不可评估节段)的患者百分比;(5)可测量的连续心内膜缘长度的 绝对变化。这些试验中本品与基线检查相比在所有心内膜缘显影指标均显示有改善。 结合意向性治疗分析,机构和盲态判读数据结果显示:无法评估节段的数目出现了显 著、积极的改善,即给予本品后被原无法评估的变为可以评估(表5)。机构判读数据证实 可评估性出现积极变化(在临床上相当于在显影上平均改善2~3个节段)的节段的净百分比 改善了20.8%~54.9%。对于非配对盲态判读而言,5项试验中节段改善的净百分比中位数约 为9.4%~37.2%(或净改善~1~2个节段)。 对于功能评估而言,机构和盲态判读者均认为:与对照检查(MRI)相一致的节段性 室壁运动评分出现了具有统计学意义的百分比改善(表 6)。当按照室壁运动类型(与 MRI 准确匹配)对节段进行分类时,在汇总的机构判读数据方面相对于基线的本品造影的节段 性室壁运动与 MRI 的一致百分比改善了 21.3%。在 2 项试验中,盲态判读数据方面节段性室壁运动与 MRI 对照检查一致性的差异的中位值分别为 7.9%和 29.0%(或在给予本品之 后对另外 1 至 2 个节段进行校正的室壁运动评估)。
负荷超声心动图
在一项对来自5项使用类似患者人群、研究设计和成像程序的多中心、随机临床研究的
汇总数据中,针对心内膜缘显影(即节段可评估性)和左心室显影的非造影和本品造影图
像进行的前瞻性独立盲态判读评估中评价了在负荷超声心动图期间给予本品的效能。在465
例具有成像数据的患者(本品组312例,安慰剂/非造影组153例)中,247例患者(本品组
167例,安慰剂/非造影组80例)具有全部3个心尖切面(即心尖二腔、三腔和四腔切面),
218例患者(本品组145例,安慰剂组73例)至少缺失了1个用于评估的心尖切面。针对汇总的和单个的研究数据对改善的心内膜缘显影进行了评估,改善的定义是在使
用 16 节段心脏模型的情况下患者自基线非造影至负荷超声心动图时至少在 2 个节段上出现
了显影的改善。在具有所有 3 个心尖切面数据的患者中汇总结果和单个研究结果均证实:
本品组中通过盲态判读者判定心内膜缘显影改善的患者百分比显著高于安慰剂组(分别为
70.5%和 25%;P<0.001)。在至少缺失 1 个心尖切面的患者中评估负荷超声心动图,与安
慰剂组相比,无论是汇总数据还是单个的临床研究数据时均证实了本品改善心内膜缘显影
的类似结果(平均显影 12.4 个节段与显影 7.4 个节段;P<0.001)。
由所有判读者的平均值判定的具有足够质量的图像百分比,本品组数据(86.8%)显
著高于安慰剂组(46.3%)(P<0.001)。
作为盲态判读评估的一部分,还评估了心尖二腔和四腔切面的心内膜缘长度。心内膜
缘长度为自二尖瓣环通过心尖至瓣环另一侧的连续长度。进行了差异比较以估计各治疗组
在舒张与收缩时心尖二腔和四腔切面的心内膜缘长度读数上的变异度。在峰值负荷过程中
使用心尖二腔和四腔切面在收缩或舒张期间获得的心内膜缘长度测量值的平均差异,所有
判读者均认为安慰剂组比较要显著高于本品组。这与在基线时进行本品与安慰剂组差异比
较时没有发现统计学意义的情况是相反的。
人体药代动力学 在12例正常人和12例慢性阻塞性肺病(COPD)患者接受50μl/kg剂量后研究了已活化 DEFINITY®中八氟丙烷(PFP)的药代动力学。PFP从体循环中迅速清除(通过肺)。给药 10分钟后大部分受试者无论是在血液中还是呼气中均检测不到PFP。在所有受试者中,PFP 的最大浓度均是在注射开始后大约1.0至2.0分钟时达到。 使用本品联合PFP药代动力学评估进行了多普勒超声测量。多普勒信号强度与测定的 和推断的血液中的PFP浓度有着较好的相关度。达到最大多普勒信号强度的时间Tmax被证实 与PFP的血Tmax相近(1.13与1.77分钟)。观察到多普勒信号强度在10分钟内降低99%(t½大 约为2分钟),与测定的血液PFP浓度降低一致。 代谢 PFP是一种不会被代谢的稳定气体。本品的3种脂质成分(DPPA,DPPC和DPPE)均 是人体中天然存在的血脂成分。一次本品给药中所包含的这些脂肪的数量分别占血浆中天 然浓度的~1%(DPPE)、~0.02%(DPPC)和~0.002%(DPPA),而且预期其代谢途径会 与内源性磷脂所报告的途径相似。 本品中的MPEG5000 DPPE在大鼠中的药代动力学 在清醒的Sprague-Dawley大鼠(3只大鼠/性别/剂量组)中,研究本品的药代动力学、 分布、代谢和排泄。因为仅MPEG5000 DPPE为新型磷脂,以14C-MPEG5000 DPPE制备本 品,并在注射后5、15、30分钟和1、2、4、6、24、48和72小时测定14C水平。结果发现放 射标记本品的血液清除方式可以双室模型最佳拟合(R=0.98)。其研究结果的总结参见表 9。

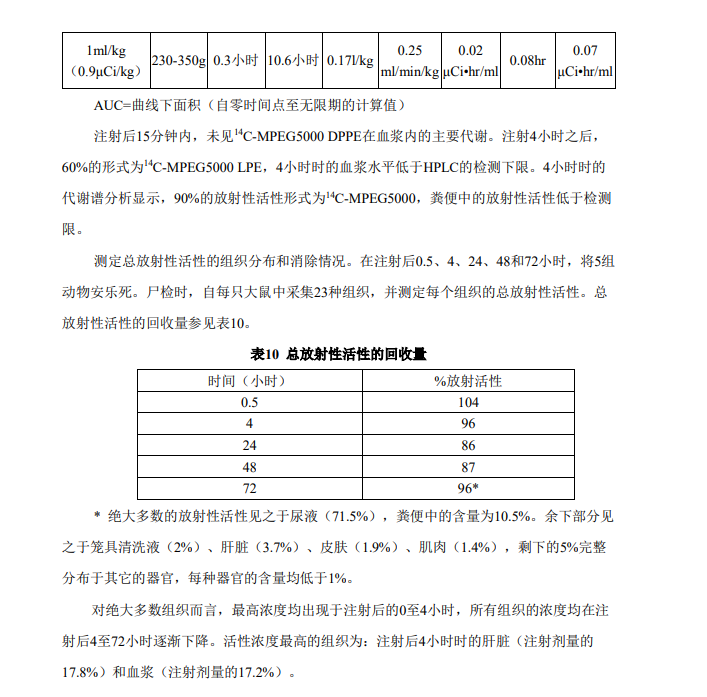 犬中的药代动力学
对于本品的八氟丙烷(PFP)成分,在3个剂量水平下对犬进行单次静脉注射,以便研
究体内注射后的动力学。在每个剂量组中,对四只未曾使用的雄性比格犬给予供试品。在
长达给药后30分钟的总共12个时间点,采集血液和呼出气中的PFP浓度。
采用单室模型分析数据。经估算,曲线下面积(AUC)的平均值为3.237 nl•sec/ml,平
均消除半衰期为61秒,血液的平均清除率为19ml/(kg•sec)。经估计,分布体积为
1720ml/kg。分布体积较大可能归因于PFP的快速经血液清除,血液中从未达到PFP的稳态
平衡。10μl/kg剂量下给药后,呼出气中的PFP水平也极低,并接近定量限。在100和1000μl/kg
的剂量下,可观察到PFP初始的、快速排泄;并分别在给药后2分钟或4分钟达到平台水
平。对这些组别而言,整个研究期内的经呼出气总PFP清除率,大约占总的理论给药量的
117%。经估计,1000μl/kg 剂量下的肺脏清除率平均值为24.2ml/(kg•sec)。
犬中的药代动力学
对于本品的八氟丙烷(PFP)成分,在3个剂量水平下对犬进行单次静脉注射,以便研
究体内注射后的动力学。在每个剂量组中,对四只未曾使用的雄性比格犬给予供试品。在
长达给药后30分钟的总共12个时间点,采集血液和呼出气中的PFP浓度。
采用单室模型分析数据。经估算,曲线下面积(AUC)的平均值为3.237 nl•sec/ml,平
均消除半衰期为61秒,血液的平均清除率为19ml/(kg•sec)。经估计,分布体积为
1720ml/kg。分布体积较大可能归因于PFP的快速经血液清除,血液中从未达到PFP的稳态
平衡。10μl/kg剂量下给药后,呼出气中的PFP水平也极低,并接近定量限。在100和1000μl/kg
的剂量下,可观察到PFP初始的、快速排泄;并分别在给药后2分钟或4分钟达到平台水
平。对这些组别而言,整个研究期内的经呼出气总PFP清除率,大约占总的理论给药量的
117%。经估计,1000μl/kg 剂量下的肺脏清除率平均值为24.2ml/(kg•sec)。
注射剂
活化前每1ml上层气体中含八氟丙烷6.52mg,活化后每瓶1.5ml乳液中含八氟丙烷225μl
高硼硅玻璃管制注射剂瓶和注射用冻干粉末用ETFE层压氯化丁基橡胶塞装。 4支/盒,16支/盒。 振摇装置(VIALMIX®)将随首个药品包装一起提供。
2~8℃保存。 活化后,本品可以在室温下贮存,但应在制备后12小时内使用。
22.00
24个月
国药准字HJ20220082

