长春生物 四价流感病毒裂解疫苗说明书
Influenza Vaccine(Split Virion) , Inactivated, Quadrivalent
四价流感病毒裂解疫苗
本品系用世界卫生组织(WHO) 推荐的甲型和乙型流行性感冒(简称流感)病毒株, 分别接种鸡胚, 经培养、 收获病毒液、 病毒纯化、 裂解、 再纯化、 灭活后制成。 为微乳白色液体。有效成分: 当年使用的各型流感病毒株血凝素。 本品每 0.5ml 含:
A/Michigan/45/2015 (H1N1)pdm09-like virus…………………………… 15μɡ 血凝素
A/Hongkong/4801/2014(H3N2)-like virus……………………………… 15μɡ 血凝素
B/Brisbane/60/2008-like virus (B/Victoria/2/87 lineage)………………… 15μɡ 血凝素
B/Phuket/3073/2013-like virus (B/Yamagata/16/88 lineage) …………… 15μɡ 血凝素
辅料: 氯化钠、 磷酸氢二钠、 磷酸二氢钠。
接种本品后, 可刺激机体产生抗流感病毒的免疫力; 用于预防疫苗相关型别
的流感病毒引起的流行性感冒。
(1) 于上臂外侧三角肌肌内注射。
(2) 于流感流行季节前或期间进行预防接种。 成人及 3 岁以上儿童接种 1
剂次, 每次接种剂量为 0.5ml。
按照国际医学科学组织委员会(CIOMS)推荐的不良反应发生率分类: 十分常见(≥10%) , 常见(1%-10%, 含 1%) , 偶见(0.1%-1%, 含 0.1%) , 罕见(0.01%-0.1%, 含 0.01%) , 十分罕见(<0.01%) , 进行如下描述:(1) 本品临床试验:在中国境内共 2440 名 3 岁及以上受试者参与临床试验, 其中 840 名受试者接种了 1 剂次本品。 系统的安全性观察自疫苗接种开始至全程接种后 28 天, 长期安全性观察自全程接种后 29 天至 6 个月 。全身不良反应:十分常见: 发热;常见: 头痛;偶见: 肌肉痛、 关节痛、 乏力、 烦躁、 恶心、 呕吐、 变态反应。局部不良反应:常见: 疼痛;偶见: 发红、 肿胀、 瘙痒。(2) 同类产品境内外临床试验:除上述不良反应外, 在同类产品境内外临床试验中还观察到如下不良反应:全身不良反应:十分常见: 不适、 胃肠道症状、 嗜睡、 易激惹、 食欲下降;常见: 寒战;偶见: 咳嗽。局部不良反应:偶见: 皮疹、 硬结、 瘀斑。严重不良反应: 罕见: 过敏性紫癜、 全身性过敏反应。(3) 同类产品境外上市后监测:境外同类产品上市后监测获得的额外安全性数据(由规模不详人群自发报告产生, 难以准确估计症状的发生率或有效评估症状发生与疫苗使用的相关性) 汇总如下:消化系统: 腹部疼痛或不适、 口腔、 喉部和/或舌头肿胀;血液及淋巴系统: 淋巴结肿大;感染和侵袭性疾病: 注射部位蜂窝织炎、 咽炎、 鼻炎、 扁桃体炎;神经系统: 惊厥、 脑脊髓炎、 面神经麻痹、 格林-巴利综合征、 脊髓炎、 神经炎、 感觉异常、 晕厥;呼吸系统: 哮喘、 支气管痉挛、 呼吸困难;心血管系统: 心动过速、 血管炎;内耳前庭系统: 眩晕;皮肤系统: 血管性水肿、 红斑、 肿胀、 瘙痒、 Stevens-Johnson 综合征、 出汗、荨麻疹;眼部: 结膜炎、 眼睛疼痛/发红/肿胀;免疫系统: 过敏性休克、 过敏性紫癜、 超敏反应、 血清病。
(1) 已知对本品所含任何成分, 包括辅料、 甲醛、 裂解剂(Triton X-100) 、硫酸庆大霉素过敏者。(2) 患急性疾病、 严重慢性疾病、 慢性疾病的急性发作期、 感冒和发热者。(3) 未控制的癫痫和患其他进行性神经系统疾病患者, 有格林-巴利综合征病史者。如有以上任一情况, 禁用本品, 并及时告知医生。
(1) 以下情况者慎用本品: 家族和个人有惊厥史者、 患慢性疾病者、 有癫痫史者、 过敏体质者。
(2) 疫苗瓶有裂纹、 标签不清或失效者, 疫苗出现浑浊、 有摇不散的块状絮状物等外观异常者均不得使用。
(3) 疫苗瓶开启后应立即使用。 严禁冻结和分次使用。
(4)本品不得与其它医疗产品混合后在注射器中一起注射。严禁静脉注射。
(5) 应备有肾上腺素等药物, 以备偶有发生严重过敏反应时急救用, 接受注射者在注射后应在现场观察至少 30 分钟。
(6) 注射后出现任何神经系统反应者, 禁止再次使用本品。
(7) 注射免疫球蛋白者应至少间隔 1 个月 以上接种本品, 以免影响免疫效果。
(8) 免疫功能低下者使用本品前应咨询医生。
(9) 本品必须在有效期内使用。
目前尚未获得孕妇及哺乳期妇女使用本品的临床试验数据。 若该人群需使用 本品, 建议与医生共同获益/风险评估后决定。
1. 与其它疫苗同时接种: 本品尚未进行同期(先、 后或同时) 接种其它疫苗对本品免疫原性影响的临床研究。 目前尚无数据可以评价本品与其它疫苗同时接种的影响。2. 与其它药物伴随使用: 具有免疫抑制作用药物包括免疫抑制剂、 化疗药物、 抗代谢药物、 烷化剂、 细胞毒素类药物、 皮质类固醇类药物, 以及免疫球蛋白等, 可能会降低机体对本品的免疫应答。如正在或近期曾使用过任何其它疫苗或药物, 为避免可能的药物间相互作用,接种本品前建议咨询专业医师。
长春生物制品研究所有限责任公司
86903320001538
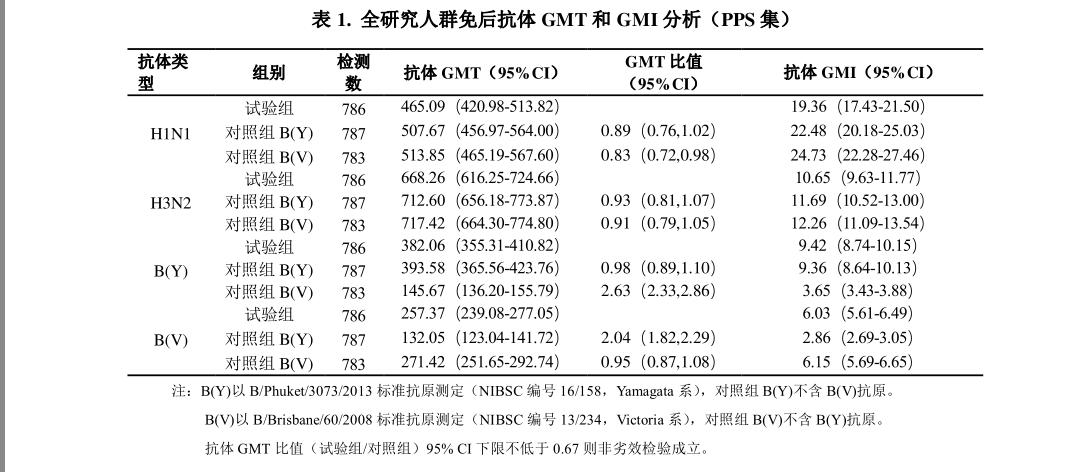
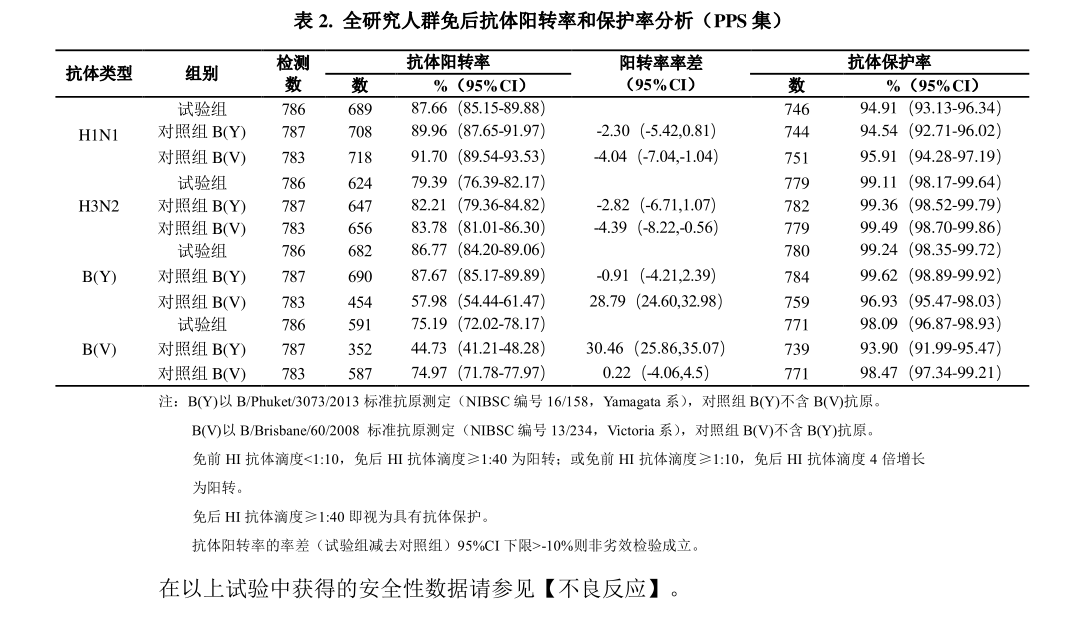
在中国境内随机、 双盲、 对照的Ⅲ期关键性注册临床试验中, 共入组 2400 名3 岁及以上受试者, 按照 1:1:1 比例随机接种 1 剂次本品或两种三价季节性流感对照疫苗。采集受试者免前和免后 28 天的血样, 采用微量血凝抑制实验方法测定受试者血清的流感病毒 HI 抗体滴度。 试验组全研究人群免后 H1N1、 H3N2、 B(Y)和B(V)型抗体 GMT 分别为 465.09、 668.26、 382.06、 257.37, 抗体 GMT 增长倍数(GMI) 分别为 19.36、 10.65、 9.42、 6.03(详见表 1) ; 试验组全研究人群免后H1N1、H3N2、B(Y)和 B(V)型抗体阳转率分别为 87.66%、79.39%、86.77%、75.19%,抗体保护率分别为 94.91%、 99.11%、 99.24%、 98.09%(详见表 2) 。 FAS 集与PPS 集结果一致。
注射剂
每瓶(支)0.5ml。每1次人用剂量为0.5ml(成人及3岁以上儿童),含各型流感病毒株血凝素应为15μg。
西林瓶, 1 瓶/盒。 预灌封注射器, 1 支/盒。
于 2~8℃避光保存和运输。
108.00
12 个月 。
国药准字S20200003

