Tiglutik说明书
Riluzole Oral Suspension
利鲁唑
本品主要成份为利鲁唑。
化学名称: 2-氨基-6-三氟甲氧基苯并噻唑
化学结构式:
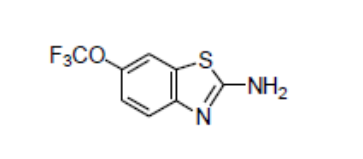
分子式: C8H5F3N2OS
分子量: 234. 20
pH 值: 7. 5~9. 5
本品处方中不含抑菌剂。
本品为浅棕色,摇匀后为不透明的均匀混悬液。
本品适用于延长肌萎缩侧索硬化(ALS)患者的生命或延长其发展至需要机械通气支持的时间。临床试验已经证明利鲁唑可延长ALS患者的存活期。存活的定义为不需插管进行机械通气也未接受气管切开的存活患者。没有证据表明利鲁唑对运动功能、肺功能、肌束震颤、肌力和运动症状具有治疗作用。在晚期ALS患者中利鲁唑未显示出疗效。仅在ALS中研究了利鲁唑的安全性和有效性。因此,利鲁唑不得用于任何其他类型的运动神经元病。
具有运动神经元病治疗经验的专科医师才可启用本品治疗。剂量:成人和老年人:成人或老年人每日推荐剂量为100mg(每12小时50的增加每日剂量并不能显著提高预期益处。推荐每天分两次给药,每次给约10ml(10ml相当于50mg利鲁唑)。如漏服一次,按原计划时间服用下一次。根据药代动力学数据,本品在老年人群中使用无特殊说明。儿童:由于缺乏利鲁唑治疗儿童或青少年任何神经退行性疾病的安全性和有效性的数据,故不建议儿童使用本品。肾功能损伤患者:由于未在肾功能损伤患者中进行重复给药研究,故不建议该类人群使用本品。肝功能损伤患者:参见禁忌、注意事项和药代动力学。给药方法:本品不需要其他液体进行稀释,摇匀后口服给药。通过带刻度的给药注射器进行给药。应在餐前至少1小时或餐后2小时给药,给药前将药瓶轻轻摇晃至少30s。给药前和给药期间需测定血清转氨酶水平。
安全性特征总结:在利鲁唑治疗 ALS 患者的 III 期临床研究中, 最常报道的不良反应为乏力、
恶心、 肝功能检查异常。不良反应汇总表:使用以下标准对下文列举的不良反应进行分类: 十分常见(≥1/10); 常见(≥1/100 至<1/10); 偶见(≥1/1000 至<1/100); 罕见(≥1/10000 至<1/1000) ;十分罕见 (<1/10000) ; 未知(无法从可用数据中评估)。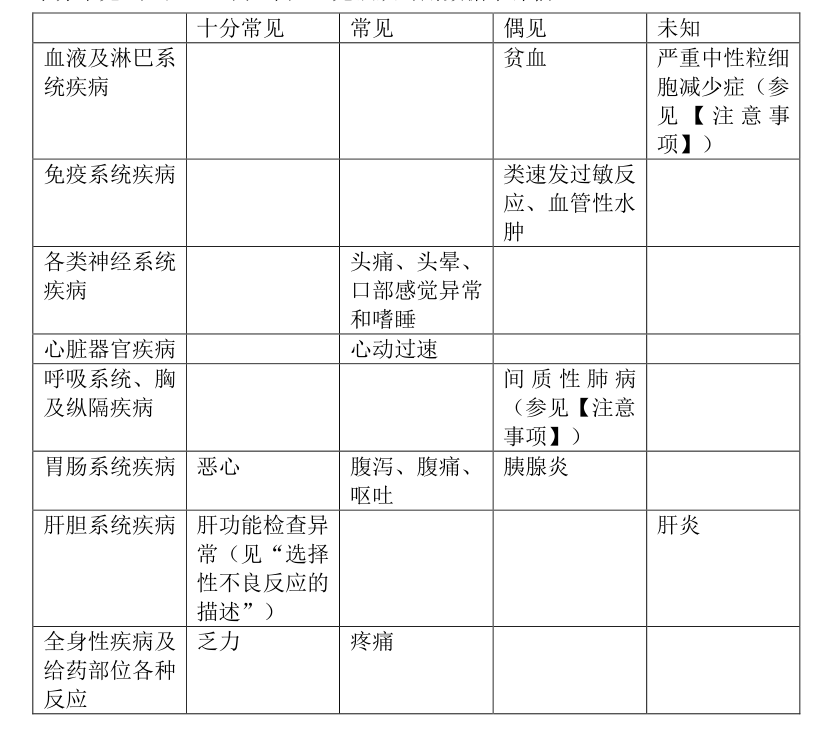
选择性不良反应的描述:肝胆疾病:ALT 升高通常发生于利鲁唑治疗的前三个月 内; 其升高通常是一过性的, 且当治疗继续时, 其水平在 2 至 6 个月 内恢复至低于正常上限 2 倍, 这些增高可伴有黄疸。 在临床试验中 ALT 升高超过正常范围上限 5 倍的患者(n = 20) 中止治疗后 ALT 水平在 2-4 个月 内恢复至正常范围上限 2 倍以下(参见【注意事项】)。研究数据表明: 亚洲患者可能更易出现肝功能检查异常——亚洲患者为3. 2%(194/5995) , 高加索患者为 1. 8%(100/5641) 。
对利鲁唑或其任何成份过敏的患者。肝脏疾病或基线转氨酶高于正常上限3倍者。妊娠或哺乳期。
肝损害:利鲁唑慎用于肝功能异常患者或血清转氨酶(ALT、 AST 升至正常上限(ULN)3 倍) 、 胆红素和/或γ -谷氨酰胺转移酶(GGT) 轻度升高的患者。 肝功能检测的基线增高(尤其是胆红素升高) 须禁止利鲁唑的使用。因为有肝炎的风险, 在利鲁唑治疗前和治疗期间需测定血清转氨酶, 包括ALT。 在治疗的前 3 个月 , 需每月 检测 ALT, 在第 1 年每 3 个月 检测一次, 以后每年一次。 对于发生 ALT 水平增高的患者, 需进行更为频繁的 ALT 水平检测。若 ALT 水平增加至 5 倍 ULN, 须停止利鲁唑治疗。 在发生 ALT 增加至 5 倍ULN 的患者尚无减量或再次给药的经验。 不推荐利鲁唑在这种情况的患者中再次给药。若出现肝功能障碍的迹象(如胆红素升高), 则停止使用本品。 与其他肝毒性药物合并使用可能会增加肝毒性风险。中性粒细胞缺乏症:应当提醒患者向其医生报告所有的发热疾病。 发热疾病的报告提醒医生检查白细胞计数, 在中性粒细胞减少情况下停止利鲁唑的治疗。间质性肺病:已有接受利鲁唑治疗报告间质性肺病的病例, 其中一部分为严重病例。 如果出现呼吸症状, 例如干咳和/或呼吸困难, 应进行胸部 X 线检查,如果有提示间质性肺病的发现(例如两侧肺弥散不透明), 应立即停用利鲁唑。 在大多数报道病例中, 停药和对症治疗后, 症状消除。肾损害:在中度或重度慢性肾功能不全(肌酐清除率在 10-50mL/min) 的患者和健康志愿者单次口服 50mg 利鲁唑给药后, 其药代动力学参数无显著差异。 本品不应用于肾功能损害的患者, 因为在此人群中尚未进行重复给药研究。对驾车和使用机器能力的影响:须警告患者有头晕或眩晕的可能, 建议在发生这些症状时不要驾车或操作机
器。尚无对驾车或使用机器影响的研究。产品含有液体山梨醇(E420), 因此患有果糖不耐受罕见遗传病的患者不可服用此药。
在孤立病例中曾观察到神经和精神症状、 急性中毒性脑病伴木僵、 昏迷、 高铁血红蛋白血症。若出现药物过量, 需进行对症和支持治疗。采用亚甲蓝治疗后可迅速逆转高铁血红蛋白血症。
由于利魯唑应用于儿童或青少年中的有关神经变性作用的有效性和安全性尚未确立,因此不推荐儿童使用本品。
尚无临床研究以评估利鲁唑与其他药品的相互作用。使用人肝脏微粒体制剂进行的体外研究显示CYP1A2是参与利鲁唑初始氧化代谢的主要同工酶。CYP1A2的抑制剂(如咖啡因、双氯芬酸、地西泮、尼麦角林、氯米帕明、丙咪嗪、氟伏沙明、非那西丁、茶碱、阿米替林和喹诺酮类)可潜在降低利鲁唑的消除率,而CYP1A2的诱导剂(如香烟、炭烤食品、利福平、奥美拉唑)可增加利鲁唑的清除率。ALS患者的临床试验排除了合并使用潜在肝毒性药物(如别嘌呤醇、甲基多巴、磺胺吡啶)的患者。接受本品治疗的患者服用其他肝毒性药物可能会增加肝毒性的风险。
ITALFARMACO, S.A.
86978532000037
利鲁唑在肌萎缩侧索硬化症(ALS) 患者中发挥治疗作用的机制尚不清楚。
遗传毒性:利鲁唑 Ames 试验、 体外小鼠淋巴瘤 Tk 试验、 体外人淋巴细胞染色体畸变试验、大鼠体内细胞遗传学试验和小鼠体内微核试验结果均为阴性。利鲁唑主要活性代谢产物 N-羟基利鲁唑体外小鼠淋巴瘤 Tk 试验和体外小鼠淋巴瘤细胞微核试验结果为阳性; HPRT 基因突变试验、Ames 试验、 体外人淋巴细胞染色体畸变试验和小鼠体内微核试验结果为阴性。生殖毒性:雄性大鼠于交配前至交配成功、 雌性大鼠于交配前至整个妊娠期和哺乳期经口给予利鲁唑 3、 8、15mg/kg/天, 高剂量下可见生育力指数下降、 胚胎-胎仔死亡率升高, 子代出生后存活率、 生长和功能发育降低, 该剂量也可见母体毒性。生育力、 早期胚胎发育、 围产期发育毒性的无影响剂量为 8mg/kg/天(以 mg/m2计, 约相当于人每日推荐剂量 100 mg)。妊娠大鼠于器官发生期经口给予利鲁唑 3、 9、 27mg/kg/天, 高剂量可抑制胎仔生长(体重和身长), 胚胎-胎仔发育毒性的无影响剂量为 9mg/kg/天(以 mg/m2计, 约相当于人每日推荐剂量 100 mg)。妊娠兔于器官发生期经口给予利鲁唑 3、10、 60mg/kg/天, 高剂量下胚胎-胎仔死亡率升高,且高、 中剂量下可见胎仔体重降低和形态变异增加, 胚胎-胎仔发育毒性的无影响剂量为 3mg/kg/天(以 mg/m2计, 低于人每日推荐剂量 100 mg)。 大鼠和兔在高剂量下均可见母体毒性。致癌性:小鼠和大鼠分别连续 2 年经口给予利鲁唑达 20 mg/kg/天、 10 mg/kg/天(以
mg/m2计, 约相当于人每日推荐剂量 100 mg), 未见致癌性。
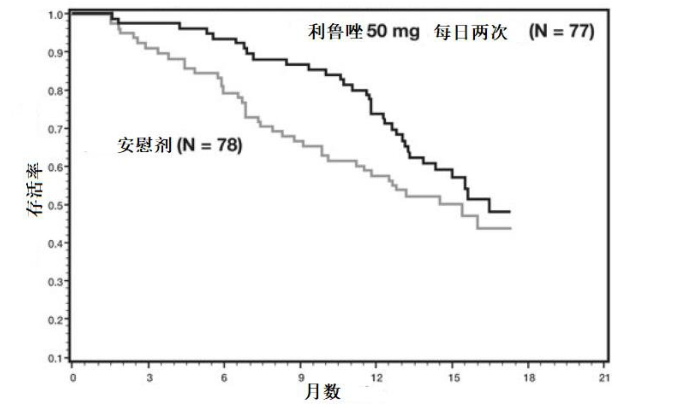
本品的有效性是基于比较本品与利鲁唑口服片剂的生物利用度研究。利鲁唑的有效性在两项研究(研究 1 和 2) 中得到证实, 这些研究评价了肌萎缩侧索硬化症(ALS) 患者每日两次给药 50 mg 利鲁唑口服片剂。 两项研究均包括家族性或散发性 ALS 患者, 病程小于 5 年, 基线用力肺活量大于或等于正常值的 60%。研究 1 是一项随机、 双盲、 安慰剂对照的临床研究, 其纳入了 155 例 ALS 患者。 患者随机接受利鲁唑 50 mg 每日两次(n = 77) 或安慰剂(n = 78), 并随访至少 13 个月 (最长可达 18 个月 )。 临床终点指标为至患者接受气管切开术或死亡的时间。与安慰剂相比, 接受利鲁唑治疗的患者达到患者接受气管切开术或死亡的时间更长。 与安慰剂相比, 接受利鲁唑治疗的患者的存活率早期增加。 图 1 显示了到达死亡或接受气管切开术时间的存活曲线。 纵轴表示在治疗开始(横轴) 后的不同时间尚未进行气管切开术且存活的个体的比例。 尽管按照研究方案规定的分析方法进行评价时, 这些存活曲线未显示出统计学显著差异(Logrank 检验 p =0. 12), 但另一种恰当的分析方法却发现了差异的统计学显著性(Wilcoxon 检验p = 0. 05)。 如图 1 所示, 该研究显示接受利鲁唑治疗的患者的存活率有早期增加。 在研究期间达到需要气管切开术或死亡终点的患者中, 每日两次给药利鲁唑50 mg 与安慰剂组之间的中位生存期差异约为 90 天。图 1 研究 1 中 ALS 患者至气管切开术或死亡的时间(Kaplan-Meier 生存率曲线)
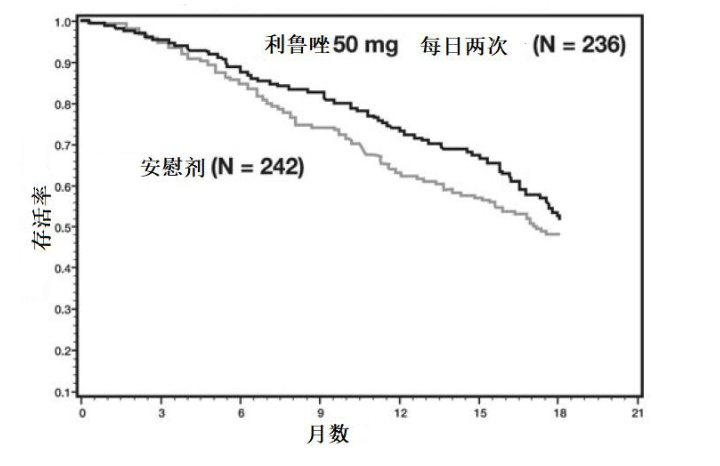
研究 2 是一项随机、 双盲、 安慰剂对照的临床研究, 其纳入了 959 例 ALS 患者。 患者随机接受利鲁唑 50 mg 每日两次给药(n = 236) 或安慰剂(n = 242),并随访至少 12 个月 (最长可达 18 个月 )。 临床终点指标为至患者接受气管切开术或死亡的时间。与安慰剂相比, 接受利鲁唑治疗的患者达到患者接受气管切开术或死亡的时间更长。 图 2 显示了随机接受每日 100 mg 利鲁唑治疗或安慰剂的患者到达死亡或接受气管切开术时间的存活曲线。 尽管按照研究方案规定的分析方法进行评价时, 这些存活曲线未显示出统计学显著差异(Logrank 检验 p = 0. 076), 但另一种恰当的分析方法却发现了差异的统计学显著性(Wilcoxon 检验 p = 0. 05)。 图2 中未显示利鲁唑 50 mg/day(推荐日剂量的一半) 的结果, 因为其与安慰剂无法在统计学上区分, 也未显示利鲁唑 200mg/day(推荐日剂量的两倍) 的结果,因为其与 100 mg 每天的结果也无法区分。 在研究期间达到需要气管切开术或死亡终点的患者中, 每日两次给药利鲁唑 50mg 与安慰剂组之间的中位生存期差异约为 60 天。尽管两项研究中利鲁唑均改善了存活率, 但对肌力和神经功能的检测指标未呈现有利结果。图 2 研究 2 中 ALS 患者至气管切开术或死亡的时间(Kaplan-Meier 生存率曲线)
在健康男性志愿者中, 通过单一剂量口服 25-300 mg 利鲁唑片和每日两次重复口服 25-100 mg 对利鲁唑片的药代动力学进行评估。 其血药浓度水平的升高与剂量呈线性关系, 其药代动力学特性是非剂量依赖性的。重复剂量给药时(50mg 利鲁唑片, 每日两次, 10 天疗程), 利鲁唑原形在血浆中蓄积至单次给药的 2 倍, 并于 5 日内达到稳态期。吸收:利鲁唑片口服给药后, 吸收迅速, 并在 60 到 90 min 内达到最大血浆浓度(C max =173±72(sd) ng/ml)。 大约剂量的 90%被吸收, 绝对生物利用度为 60±18%。在高脂饮食的同时服用利鲁唑, 其吸收率及吸收程度下降(Cmax 降低 44%,AUC 降低 17%)。在生物等效性研究中, 利鲁唑 50 mg 片剂和本品给药后的 AUC 具有生物等效性(几何均值比: 106. 84%; 90%置信区间: 96. 98-117. 71%)。 利鲁唑口服混悬液给药后, 吸收更快速(T max 约为 30 min), C max 约比利鲁唑片给药后高 20%(几何均值比: 122. 32%; 90%置信区间: 103. 28-144. 88%)。分布:利鲁唑在体内广泛分布, 可通过血脑屏障。 利鲁唑的分布容积约为 245±69L(3. 4L/kg)。 利鲁唑的蛋白结合率约为 97%, 其主要与血清白蛋白及脂蛋白结合。代谢或生物转化:利鲁唑主要以原形存在于血浆中, 并由细胞色素 P450 广泛代谢继而糖脂化,在体外试验中使用人肝脏制剂开展的研究表明细胞色素 P450 1A2 是参与利鲁唑代谢的主要同工酶。 在尿液中鉴定到的代谢产物有 3 种酚类衍生物、 1 种脲基衍生物和原形利鲁唑。已鉴别和非结合的代谢产物在动物中不显示利鲁唑的药效特性, 因此在人体中未做研究。排泄:消除半衰期范围在 9 到 15 小时。 利鲁唑主要从尿液中排出。尿中总排泄率为剂量的 90%。 葡萄糖醛酸衍生物占尿中代谢产物的 85%以上,仅有剂量 2%的利鲁唑以原形存在于尿中。特殊人群:肾功能损伤患者:在中度或重度慢性肾功能不全的患者(肌酐清除率在 10 到 50 ml/min 之间)和健康志愿者中利鲁唑 50mg 单次口服给药后, 药代动力学参数无明显差异。老年人:在老年人(>70 岁) 中利鲁唑多次口服给药(50mg 利鲁唑每天两次治疗 4. 5天) 的药代动力学参数不受影响。肝功能损伤患者:利鲁唑 50mg 单次口服给药后, 轻度和中度慢性肝功能不全患者的 AUC 分别约增加 1. 7 倍和 3 倍。人种:在健康的日本和高加索成年男性中进行了一项临床研究, 每天两次给药 8 天后, 评价利鲁唑及其代谢产物 N-羟基利鲁唑的药代动力学。 在日本和高加索受试者中, 没有发现利鲁唑及其代谢产物的药代动力学参数有人种间的差异。性别:利鲁唑在女性中的平均 AUC 约比男性患者高 45%。 对本品和利鲁唑片进行了生物等效性研究。 结果表明, 这两种制剂在女性受试者中呈现生物等效性, 而在男性受试者中, 观察到 C max 和 AUC 暴露较高, 预期无临床重要意义。吸烟者:吸烟者中利鲁唑的清除率比非吸烟者高 20%。
口服混悬剂
300ml:1.5g
采用琥珀色玻璃瓶(III 型)包装,配有儿童防护螺旋盖和注射器适配器。 每瓶装 300ml, 每盒1瓶。 盒内配有 10ml 口服给药注射器。
遮光,不超过25℃密闭保存。
1790.00
36个月
国药准字HJ20220053

