惠尔金说明书
Mogamulizumab Injection
莫格利珠单抗
主要成份:莫格利珠单抗,莫格利珠单抗是抗CCR4(C-C 趋化因子的 G 蛋白偶联受体)的基因重组人源化单克隆抗体。辅料:一水合枸橼酸、甘氨酸、聚山梨酯 80、氢氧化钠、盐酸。
澄清至微带乳光,无色溶液。
本品适用于既往接受过系统性治疗的复发或难治性 Sézary 综合征(SS)或 晚期(III/IV)蕈样肉芽肿(MF)成人患者。 本品基于境外临床试验数据获得附条件批准上市,治疗中国患者的有效性和 安全性尚待上市后进一步确证。
本品应在具有肿瘤治疗经验的医师监督下使用。须配备复苏设备并由医护专业人员实施治疗。 剂量:本品推荐剂量为1mg/kg,静脉输注至少60分钟。每28天为一个治疗周期, 在首个周期每周给药一次,分别在第1、8、15和22天给药;在随后周期按每两周输注一次,分别在第1和15天给药,直至出现疾病进展或不可接受的毒性。
应在计划给药日给药,最晚不应超过2天。如果遗漏给药超过2天,则应尽快进行下一次给药,此后应根据新的计划日继续执行给药方案。建议在首次输注本品前使用退热和抗组胺药物进行预治疗。如果发生输液反 应,在随后输注本品前应给予预治疗。 毒性导致的剂量调整:皮肤反应:如果出现轻度(1级)皮疹,考虑局部外用皮质类固醇。 如果出现严重程度为2级或3级(中度或重度)的皮疹(与药物相关), 必须中断本品的治疗,并给予至少2周的局部外用皮质类固醇。 直至皮疹改善至 1 级或更低(轻度),之后可以恢复本品治疗。 如果出现危及生命(4级)的皮疹或任何级别的史蒂文斯-约翰逊综合征 (SJS)或中毒性表皮坏死松解症(TEN),应永久性停用本品。如果怀疑为SJS或TEN,停止本品治疗,除非已排除SJS或TEN且皮肤反应已好转至1级或以下,否则不得重新开始治疗。输液反应: 如果出现轻度至重度(1-3级)输液反应和需接受治疗的症状,应暂时中断输注本品。在症状消退后重新开始输注时,输注速率应至少降低50%。 如果输液反应复发且无法控制,则终止输液。如果出现危及生命(4级)的输液反应,应永久性停用本品。如果发生输液反应,则在随后的莫格利珠单抗输液前给予预治疗(如苯海拉明和对乙酰氨基酚)。特殊人群:肾功能不全:基于群体药代动力学分析,不建议在轻度至重度肾功能受损患者中进行 剂量调整。肝功能不全:基于群体药代动力学分析,不建议在轻度或中度肝功能损害患者中进行剂量调整。尚未在重度肝功能损害患者中对本品进行研究。老年人:老年患者中无需进行剂量调整。儿童:尚无本品用于18岁以下患者的临床研究资料。给药方法: 本品仅用于静脉输注给药,不得通过皮下注射、肌内注射、推注或快速静脉输注方式给药。 通过静脉输注的方式给药时,输注持续时间至少为60分钟。如果发生了输液反应,则请遵循上述建议。 配制:因本品不含防腐剂,在开封后,应立即稀释本品并进行输注给药前,目视检查本品是否存在颗粒物和变色。本品是一种澄清至微带乳光, 无色溶液。如果观察到混浊、变色或颗粒物,则应将药瓶丢弃。根据患者的体重,计算配制1mg/kg剂量的输注溶液所需的本品体积。无菌条件下抽取所需体积的本品到注射器中,然后转移到装有9mg/ml(0.9%)氯化钠注射液的输注袋中。轻轻翻转数次以混匀稀释溶液。不得振摇。稀释溶液的最终浓度应在0.1mg/mL至3.0mg/mL之间。每支药瓶仅供一次性使用。按照当地要求丢弃药瓶中剩余的任何未使用部分。给药注意事项: 稀释溶液可放置于聚氯乙烯(PVC)或聚烯烃(PO)输注袋中。本品不得与其他药品混合或同时输注。应使用带有无菌、低蛋白结合力的0.22微米(或相当的)管路过滤器的静脉输液管进行输注液输注,输注时间为至少60分钟。输注液配制后储存:在室温(25℃)和室内光照下,化学和物理稳定性可保持24小时。上述时限包括输注液在输液袋中的储存时间和输注持续时间。从微生物学的角度看,药品必须立即使用。稀释操作在受控和经验证的无菌条件下进行,但未立即使用,给药人员应对药品使用中的储存时间和储存条件负责,确保药品保存在2℃-8℃且不超过24小时。
安全性特征总结:最常见的严重不良反应是肺炎、发热、输液反应和蜂窝织炎。最常见的不良反应是输液反应和药物性皮炎(药疹);在这些反应中,大部分是非严重的,为1级或2级。重度不良反应包括4级呼吸衰竭(1.1%)以及5级不良反应多发性肌炎和脓毒症(各0.5%)。不良反应汇总表:按系统器官分类和采用以下惯例定义的发生频率类别列出了不良反应:十分常见(≥1/10);常见(≥1/100 至<1/10);偶见(≥1/1000 至<1/100);罕见(≥1/10000 至<1/1000);十分罕见(<1/10000);未知(根据现有数据,无法进行估计)。在 每个发生频率分组中,按照严重性降序排列了不良反应。表 1: 接受本品治疗的患者中发生的药物不良反应(N=184)


特定不良反应的描述:皮肤反应:接受本品治疗的患者出现药物性皮炎(药疹),其中一些是重度和/或严重的。大多数治疗相关皮肤反应为1级或2级,其中有4.3%的患者出现了≥3级的药疹。暂无证据表明药疹和皮疹不良反应事件的发生存在潜伏期;早期和迟发性事件均有发生。输液反应:在33%接受本品治疗的患者中观察到输液反应。大多数治疗相关输液反应为1级或2级,发生在首次输注期间或输注后不久。有 4%的患者出现了重度反应(3级)。在首次输注后,输液反应的发生率最高(28.8%的受试者),第2次或后续输注后,发生率降低至3.8%甚至更低。大约有6%的患者发生了输注中断,其中大多数(约90%)发生在莫格利珠单抗治疗的第一个周期。0761-010研究中有不足1%的治疗患者由于输液反应而终止了治疗。严重感染:由于皮肤疾病导致的皮肤完整性遭到破坏,以及真皮外疾病产生的免疫抑制作用,使MF或SS患者发生严重感染的风险升高,接受莫格利珠单抗治疗也可能会增加该风险。接受莫格利珠单抗治疗的受试者中有14.3%发生了严重感染,包括脓毒症、肺炎和皮肤感染。首次给药后的事件发生潜伏期存在很大差异。大多数患者感染后痊愈。在临床试验(0761-010)中,有2例重度肺炎患者在开始莫格利珠单抗治疗9个月后出现呼吸衰竭并报告致死结局。免疫原性:在使用本品治疗成人T细胞白血病淋巴瘤或皮肤T细胞淋巴瘤的临床研究中,输注莫格利珠单抗后,大约14%的患者(313例可评估患者中的44例)初期治疗检测呈抗莫格利珠单抗抗体阳性。未见患者出现阳性中和抗体反应。末次给药后的安全性:在研究0761-010中暴露于莫格利珠单抗的319例受试者中,有21例 (6.6%)受试者在研究药物末次给药后90天内发生了至少一例严重药物不良反应(SADR)。其中,有一例以上患者报告的SADR均编码在如下SOC类别:感染及传染类疾病(7例[2.2%]患者)、一般病情和用药部位的表现(5例[1.6%]患者)、呼吸道、胸腔及纵隔疾病(4例[1.3%]患者)、骨骼肌和结缔组织疾病(3例[0.9%]患者)、肝胆疾病(2例[0.6%]患者)以及创伤、中毒及操作并发症 (2例[0.6%]患者)。所有其余SOC均仅有一例患者发生SADR(0.3%)。在莫格利珠单抗末次给药后90天内观察到的安全性特征与在研究治疗期间观察到的安全性特征一致。上市后经验:在莫格利珠单抗批准使用期间发现了以下不良反应。由于这些反应是由样本量不确定的人群自发报告的,因此并不总是能够可靠地估计其发生率或确定与药 物暴露的因果关系。感染:乙型肝炎病毒再激活,心脏疾病:应激性心肌病
对活性成分或辅料存在超敏反应的患者禁用本品
1.皮肤反应:在接受莫格利珠单抗治疗的患者中发生了致死和危及生命的皮肤不良反 应,包括史蒂文斯-约翰逊综合征(SJS)和中毒性表皮坏死松解症(TEN)。皮疹 (药疹)是与莫格利珠单抗治疗相关的最常见不良反应之一。药疹的发作因人而异,受累部位和外观也各不相同。在0761-010研究中, 至发作的中位时间为15周,25%的病例发生在31周后。报告的更常见临床表现包括丘疹样皮疹或斑丘疹、苔藓样皮炎、海绵状皮炎或肉芽肿性皮炎和麻疹样皮 疹。其他表现包括鳞屑状斑块、脓疱皮疹、毛囊炎、非特异性皮炎和银屑病样皮炎。在整个治疗过程中监测患者是否出现皮疹。皮肤毒性的处理包括局部外用皮质类固醇和中断或永久终止莫格利珠单抗治疗。考虑进行皮肤活组织检查,以帮助区分药疹和疾病进展。如果出现SJS或TEN或任何危及生命(4级)反应,应永久终止莫格利珠单抗治疗。如果出现SJS或TEN,应中断莫格利珠单抗治疗,除非排除SJS或TEN且皮肤反应已好转至1级或以下,否则不得重新开始治疗。2. 输液反应:在接受莫格利珠单抗治疗的患者中报告了致死和危及生命的输液反应。大多 数反应(约90%)发生在首次输液期间或之后不久。输液反应也可在后续输液中发生。最常报告的体征包括寒战、恶心、发热、心动过速、寒颤、头痛和呕吐。考虑在所有患者首次输注莫格利珠单抗前给予预治疗(如苯海拉明和对乙酰氨基酚)。尚未确定预治疗是否降低了这些反应的风险或严重程度。在 0761-010 研究中,42%未接受预治疗的患者和 32%接受预治疗的患者发生输液反应。密切监测患者的输液反应体征和症状,如果出现任何级别的反应,应中断输液,并及时治疗。3. 感染:接受莫格利珠单抗治疗的MF或SS受试者发生严重感染和/或病毒再激活的风险升高。尚未研究莫格利珠单抗与全身性免疫调节药品或与其他批准用于MF或SS的治疗合并用药的情况,因此不建议合并使用,特别是考虑到莫格利珠单抗治疗患者中的重度感染风险。在莫格利珠单抗治疗期间可以局部使用类固醇或 使用低剂量的全身性皮质类固醇;然而,在合并给予全身性免疫抑制药物的情况下,发生严重感染和/或病毒再激活的风险可能会更高。应对患者的感染体征和症状进行监测并给予及时治疗。在开始莫格利珠单抗治疗之前,应对患者进行乙型肝炎感染检测。对于当前 /先前的乙型肝炎感染检测结果呈阳性的患者,推荐咨询有专业治疗乙型肝炎经验的医生,以寻求有关预防乙型肝炎再激活的适当措施的建议。4. 莫格利珠单抗治疗后异体造血干细胞移植(HSCT)的并发症据报告,在莫格利珠单抗给药后接受异体HSCT的患者发生移植并发症的风 险增加,包括重度(3 级或 4 级)急性移植物抗宿主病(GVHD)、类固醇难治性GVHD和移植相关死亡。在移植前接受莫格利珠单抗的患者中,如果在HSCT前 较短的时间(约50天)内给予莫格利珠单抗,则报告的移植并发症的风险较高。 密切随访患者以关注早期移植相关并发症。5. 肿瘤溶解综合征在接受莫格利珠单抗治疗的患者中已观察到肿瘤溶解综合征(TLS)。TLS最常见于治疗的第一个月内。肿瘤迅速增生和肿瘤负荷高的患者存在发生TLS的风险。应通过适当的实验室和临床检查对患者的电解质状态、水合状态和肾功能 进行密切监测,特别是在治疗的第一个月,同时应根据最佳医学实践进行管理。 TLS的治疗包括积极补水、纠正电解质异常、抗高尿酸血症治疗以及支持性治疗。6. 心脏器官疾病
在接受莫格利珠单抗治疗的临床试验 MF/SS 患者中观察到一例急性心肌梗 死。在患有其他T细胞淋巴瘤的临床试验患者中,报告了应激性心肌病(1例) 和急性心肌梗死(1例)。受试者的病史包括了各种风险因素。应对存在心脏疾病 相关风险因素的患者进行监测,并采取适当的预防措施。7. 大细胞转化(LCT)有关LCT患者的可用数据有限。8. 自身免疫并发症据报告,在接受莫格利珠单抗治疗的患者中发生了致死和危及生命的免疫介 导并发症。≥3级的免疫介导或可能的免疫介导反应包括肌炎、心肌炎、多发性 肌炎、肝炎、肺部炎症,肾小球肾炎和格林巴利综合征的一种变异疾病。试验 0761- 010 中 1.9%(6/319)的接受莫格利珠单抗治疗患者报告使用全身免疫抑制剂治 疗免疫介导的反应,包括1例2级风湿性多肌痛。1.3%的患者报告了新发甲状腺功能减退症(1级或2级),并通过观察或给予左甲状腺素进行处理。如果出现 疑似免疫介导的不良反应,酌情中断或永久终止莫格利珠单抗治疗。注意考虑莫格利珠单抗在有自身免疫性疾病史的患者中的获益/风险。9.其他
不得通过皮下或肌内注射、快速静脉输注或静脉推注的方式给予莫格利珠单抗。本品每剂含不足1mmol钠,可视为基本上“无钠”。莫格利珠单抗对驾驶和机械操作能力所产生的影响很小。接受莫格利珠单抗给药后可能会出现疲乏。
尚未获得有关莫格利珠单抗用药过量的信息。如果发生了用药过量,则应对患者(包括其生命体征)进行密切监测(至少1小时),并在需要时给予支持性治疗。
尚未确定本品在18岁以下患者中的安全性和有效性。
尚未进行药物相互作用研究。在未进行相容性研究的情况下,本品不得与其他药品混合使用。莫格利珠单 抗不应与其他药品通过同一根静脉输液管同时输注。
Toyobo Company Limited, Otsu Pharmaceutical Plant
86982988000060
在成年T细胞白血病-淋巴瘤(ATL)和CTCL患者中评价了剂量范围0.01至1mg/kg莫格利珠单抗每周或每2周多次给药的药代动力学(PK),包括推荐剂量1.0mg/kg和给药方案(首个28天周期在第1、8、15和22天给药,后续28天周期在第1和15天给药)。群体PK分析包含了在6项临床试验中接受莫格利珠单抗治疗的444例患者。在0.1至1.0 mg/kg剂量范围内,莫格利珠单抗的暴露量与剂量成比例增加。吸收:莫格利珠单抗通过静脉途径给药,因此可立即并完全得到生物利用。分布:基于群体PK分析,中央室分布容积(Vc)的几何平均值[变异系数百分比 (CV%)]为3.57L(20.1%)。生物转化:尚未确定莫格利珠单抗的代谢途径。预计莫格利珠单抗的代谢方式与内源性IgG相同,即通过分解代谢途径降解为小肽和氨基酸。消除:基于群体PK分析,清除率(CL)的几何平均值(变异系数百分比[CV%]) 为12.0mL/h(83.7%),消除半衰期(t1/2)的几何平均值为17天(65.5%)。
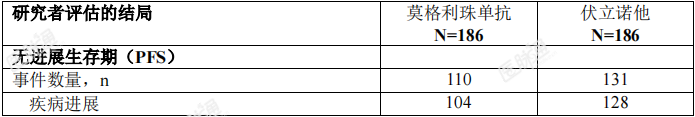
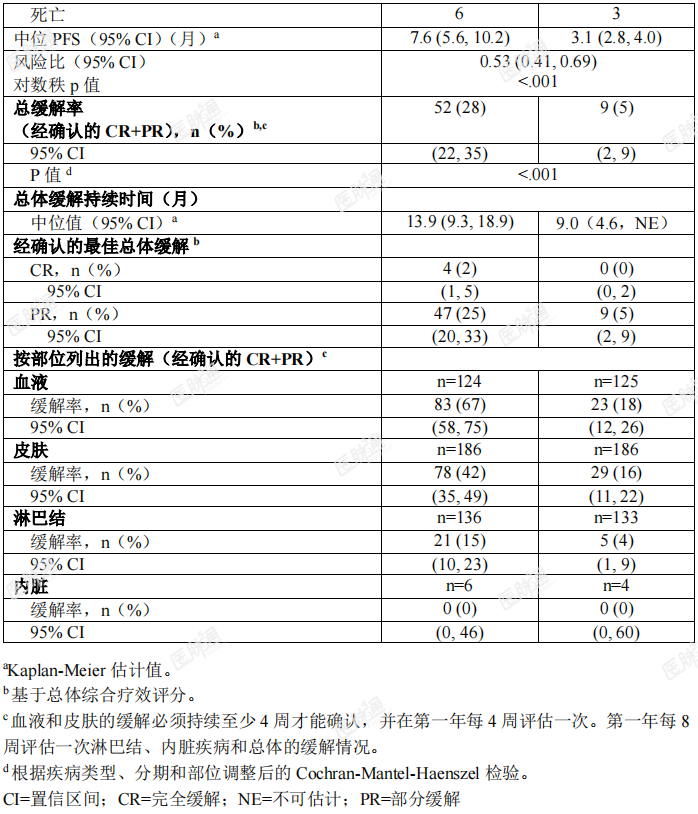
线性和蓄积莫格利珠单抗在0.01mg/kg至1mg/kg的剂量范围内PK显线性。基于群体PK分析,当采用推荐的剂量方案给药时,在12周的重复给药后达到了莫格利珠单抗的稳态浓度,全身蓄积指数为1.7倍。在幂模型分析中,没有观察到剂量比 例的明显偏离。肾功能不全:通过群体PK分析在轻度(肌酐清除率[CrCL]在60和89之间;n=157)、中度(CrCL在59和30之间;n=80)或重度肾功能受损(CrCL低于30mL/min; n=2)患者中评价了肾功能受损对莫格利珠单抗的清除率的影响。在轻度至重度肾功能受损患者与肾功能正常患者之间,未发现莫格利珠单抗的清除率存在具有 临床意义的差异。肝功能不全:通过群体PK分析在轻度肝功能受损患者(总胆红素[TB]小于或等于正常值 范围上限[ULN]且AST大于ULN,或TB在1至1.5倍ULN之间且无论AST高低;n=80)或中度肝功能受损患者(TB在1.5至3倍ULN之间且无论AST高低;n=3)中评价了肝功能受损对莫格利珠单抗的清除率的影响。在轻度至中度肝功能受损患者与肝功能正常患者之间,未发现莫格利珠单抗的清除率存在具有临床意义的差异。尚未在重度肝功能受损患者(TB大于3倍的ULN且无论 AST 高低)中对莫格利珠单抗进行研究。其他特殊人群:在群体PK分析中评估了各种不同的协变量对莫格利珠单抗的PK的影响。 以下因素对莫格利珠单抗的CL无临床意义上的影响:年龄(范围:22至101岁)、性别、种族(除日本人以外,其他种族人群的数据有限)、肾功能受损、轻度或中度肝功能受损、疾病亚型(蕈样肉芽肿(MF)或 Sézary 综合症(SS))、 CCR4 表达程度或ECOG状态,但应注意的是,临床试验不包括ECOG PS≥2的患者。药代动力学/药效学关系:暴露量-效应分析表明,在关键性研究中,有效性与莫格利珠单抗暴露量无相关性。基于研究者评估的PFS改善来衡量的有效性与莫格利珠单抗暴露量的增加无相关性。在一项随机、多中心、开放性研究(0761-010;NCT01728805)中评价了莫 格利珠单抗在既往接受过至少一种全身治疗的蕈样肉芽肿(MF)或 Sézary综合征(SS)患者中的有效性,该研究将372例患者以1:1的比例随机分配至莫格利 珠单抗组(186例患者;MF56%,SS44%)或伏立诺他组(186例患者;MF 53%, SS 47%)。该试验纳入的患者未考虑肿瘤CCR4表达状态,排除了组织学转化、 既往异体HSCT、90天内自体HSCT、活动性自身免疫性疾病或活动性感染的患 者。试验要求患者的中性粒细胞绝对计数(ANC)≥1500/μL(如果累及骨髓, ANC≥1000/μL)、血小板计数>100000/μL(如果累及骨髓,血小板计数≥75000/μL)、 肌酐清除率>50mL/min 或血清肌酐≤1.5mg/dL 和肝转氨酶≤2.5倍ULN(如果淋 巴瘤肝脏浸润,≤5倍ULN)。在首个28天周期的第1、8、15和22天以及后续每个周期的第1天和第15天,通过静脉给予1mg/kg的莫格利珠单抗至少60分钟。伏立诺他400mg口服 给药,每日一次,连续给药,28天为一个周期。治疗持续至出现疾病进展或不可 接受的毒性。允许出现疾病进展或不可接受的毒性的伏立诺他治疗患者转换至莫 格利珠单抗组。患者的中位年龄为64岁(范围:25-101岁),58%的患者为男性,70%的患者为白人。在研究基线时,38%的患者处于IB-II期,10%的患者处于III期,52%的患者处于IV期。既往经过全身治疗的中位数量为3次。在莫格利珠单抗组中, 140例患者(75%)通过免疫组化确定了基线CCR4表达状态,在皮肤活组织检 查中,上述所有患者均在淋巴细胞上检测到CCR4的表达≥1%,140例患者中的134例(96%)在淋巴细胞上检测到CCR4的表达大于≥10%。伏立诺他组的CCR4表达状态相似。在随机治疗期间,莫格利珠单抗组的中位暴露持续时间为5.6个月(范围: <1至45.3个月),48%的患者暴露时间为至少6个月,23%的患者暴露时间为至 少12个月。伏立诺他组的中位暴露持续时间为2.8个月(范围:<1至34.8个 月),22%的患者暴露时间为至少6个月。基于研究者评估的无进展生存期(PFS)来评价有效性,PFS定义为从随机分组之日起至记录疾病进展或死亡的时间。其他有效性指标包括基于综合评估各疾病部位(皮肤、血液、淋巴结和内脏)的总体复合疗效反应的总缓解率 (ORR)。需要连续两次的疾病评估来确认缓解,包括改良的严重程度加权评估工具、皮肤照片、中心流式细胞术和计算机断层扫描。试验表明,与伏立诺他相比,莫格利珠单抗显著延长了PFS(表2)。研究者评估的PFS的Kaplan-Meier曲线见图1。莫格利珠单抗组和伏立诺他组中研究者评估的PFS的估计中位随访时间分别为13个月和10.4个月。通过独立审查委员会评估,莫格利珠单抗组和伏立诺他组的估计中位PFS分别为6.7个月 (95% CI,5.6-9.4)和3.8个月(95% CI,3.0-4.7)(风险比0.64;95% CI: 0.49,0.84)。
图 1: 研究者评估的无进展生存期的 Kaplan-Meier 曲线
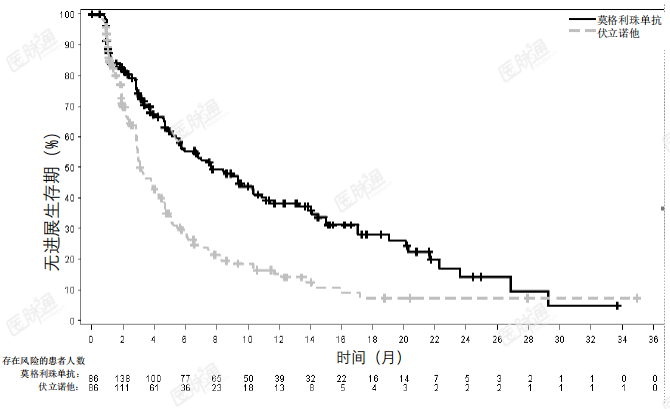
表 2还按疾病部位汇总了研究者评估的经确认的总体缓解率。试验表明, 莫格利珠单抗可改善 ORR。表 2: 随机化治疗的有效性(研究 0761-010)
本品基于境外临床试验数据获得附条件批准上市,治疗中国患者的有效性和安全性尚待上市后进一步确证。
注射剂
西林瓶装注射剂型:20mg(5ml)/瓶
1瓶/盒。 本品为西林瓶包装,包装系统包括10ml I型透明硼硅酸盐管制玻璃瓶,注射制剂用覆聚乙烯-四氟乙烯膜丁基橡胶塞和输液瓶用铝塑组合盖。
于2~8℃避光保存和运输,禁冻结。
50.00
36个月
国药准字SJ20220018

