赛美纳说明书
Befotertinib Mesylate Capsules
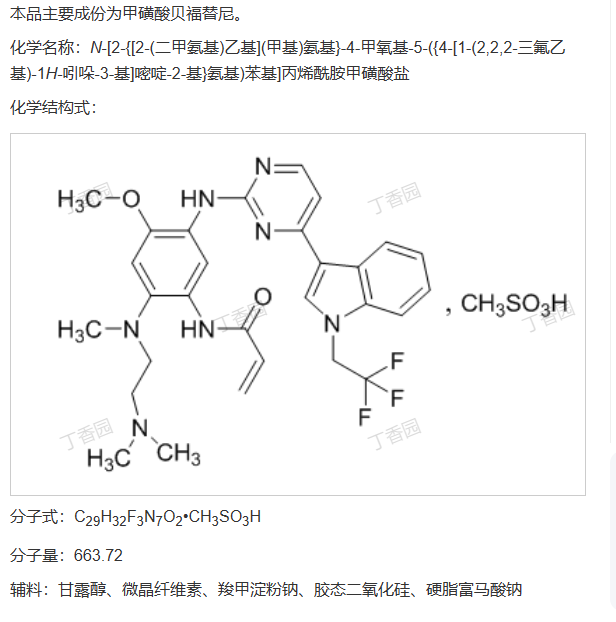
甲磺酸贝福替尼
本品适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI) 治疗时或治疗后出现疾病进展,并且经检测确认存在EGFRT790M突变阳性的局部晚期或转移性非小细胞肺癌 (NSCLC) 成人患者的治疗。
本品应在具有丰富经验的肿瘤专科医生指导下使用。在使用本品治疗前,首先需要明确EGFRT79OM突变状态。应采用经批准的检测方法确定存在EGFRT790M突变。患者服药前医师应进行COMPASS-CAT评分,针对高风险患者(≥ 7分)评估其用药的风险与获益,告知患者相关风险;如使用本品,可给予预防性抗凝治疗。剂及给药方法:口服,每日一次,从75 mg起始剂量开始服用,连续服用21日;若无严重副作用或未发生≥2级的血小板降低和/或未发生≥2级的头痛,21日后剂量调整为100mg,日一次。直至出现疾病进展或不可耐受的毒性。本品空腹或餐后服用均可。建议每天大致同一时间服用。如果漏服本品1次,若距离下一次服药时间大于12小时,则应补服本品。剂量调整:根据患者个体的安全性和耐受性,可暂停用药或减量。出现不良反应后的减量原则。特殊人群:肝功能损害:轻度肝功能损害患者无需进行剂量调整。中重度肝功能损害患者使用本品的安全性和有效性尚不明确。肾功能损害:轻中度肾功能损害患者无需进行剂量调整。重度肾功能损害患者使用本品的安全性和有效性尚不明确。
对本品活性成份或任何一种辅料过敏者。
EGFRT790M突变状态的评价:当考虑使用本品治疗局部晚期或转移性NSCLC时,首先需要明确EGFRT790M突变的状态。应采用经批准的检测方法对采自肿瘤组织样本的DNA或血浆样本中的循环肿瘤DNA (ctDNA) 进行检测。在对肿瘤DNA (通过组织或血浆样本)的EGFRT790M突变状态进行检测时,通过组织或血浆ctDNA检测后,如果EGFRT790M突变为阳性,则提示可使用本品治疗。然而,由于血浆检测可能会出现假阴性的结果,如果使用的是血浆ctDNA检测,且结果为阴性,则在可能的情况下应再进行肿瘤组织检测。血栓:在临床研究中,使用本品的部分患者曾观察到不同程度的血栓事件,静脉血栓栓塞主要表现为四肢静脉血栓形成和/或肺栓塞等,动脉血栓栓塞事件包括动脉血栓形成、脑血管意外、血管闭塞或心肌梗死。可累及不同部位,部分患者无临床症状,因影像学评估发现。脑梗病史、高血压病史、具有临床意义的D-_聚体升高异常、COMPASS-CAT 评分高风险(≥7分)的患者在使用贝福替尼治疗期间发生血栓栓塞事件的风险可能增加。所有患者服药前,应进行COMPASS-CAT评分量表评估(≥7分为高风险),关注临床高危因素脑梗病史、高压病史、具有临床意义的D--聚体升高异常等,针对高风险患者评估其用药的风险与获益,如高风险患者使用本品,需告知相关风险,可给予预防性抗凝治疗。接受本品推荐剂量治疗后发生血栓的患者中有78 6% (66/84) 仅需药物抗凝治疗,17.9% (15/84) 还接受了非药物治疗(如静脉滤器植入术、溶栓、取栓等)。临床研究中排除了经药物治疗后仍不能控制的高血压患者(SBP>160mmHg或DBP>100 mmHg)、肺栓塞患者。服药3个月内,患者应在医师的指导下进行血栓相关的监测,钥检查凝血功能尤其是D-二聚体,重点关注血栓相关症状(下肢肿痛、皮温升高等),必要时增加影像学评估频率,及时发现风险并干预。对于COMPASS-CAT评分高风险且合并脑梗病史、融压病史、具有临床意义的D-二聚体升高异常的患者,可采用预防抗凝措施,增加监测次数及评估仿法。服药3个后,进行临床常规监测。发现凝血指标异常、影像学检查(如CT、B超)异常和/或血栓相关症状后,患者应及时就诊,通过对症检查(血常规、凝血功能等实验室检查;静脉彩超等影像学检查)进一步明确诊断。接受本品治疗出现血栓事件,暂停给药后继续使用可能再次发生(再激发阳性),部分患者需持续给予抗凝治疗。根据血栓事件的评估结果进行暂停、再次使用本品、降低剂量、永停药。考虑获益风险评估是否继续接受本品治疗。血小板减少症:接受本品推荐剂量治疗的患者可发生药物诱导的血小板减少症,血小板减少症的中位发生时间为22天,中位持续时间为304天。患者应在医师的指导下在开始治疗前及治疗期间监测血小板计数。已出现血小板减少症的患者应根据其严重程度级别,在医师的指导下调整监测频率,血小板计数< 50.0 x109/L (CTCAE≥3级) 或25.0x 109/L (CTCAE≥4级)的患者,医师应对其进行更频繁的监测,及时给予对症治疗,并根据具体情况进行剂量调整。
避孕:育龄期男/女性服用本品期间应避免生育,在完成本品治疗后3个月内仍应使用有效的避孕措施。合并服用本品后,不能排除激素类避孕药暴露量下降的风险。妊娠:目前尚无妊娠女性使用本品的数据,对胎儿可能的安全性风险目前不详。根据作用机制,妊娠女性使用本品时可能对胎儿造成危害。哺乳:目前尚不明确本品或其代谢产物是否会通过人的乳汁排泄。建议本品治疗期间及末次给药后至少3个月内停止哺乳。
贝达药业股份有限公司
86904611000179;86904611000186
贝福替尼是表皮生长因子受体(EGFR)激酶抑制剂,对EGFR耐药或激活突变体(如EGFRT790M、L858R 和外显子19缺失)具有不可逆的抑制作用,IC50约为1nM。贝福替尼对上述突变EGFR的抑制作用较野生型EGFR强,对于携带上述相关突变的肿瘤细胞抑制作用亦强于野生型肿瘤细胞。
遗传毒性:甲磺酸贝福替尼Ames试验、人外周血淋巴细胞染色体畸变试验和大鼠骨髓微核试验结果均为阴性。生殖毒性:尚未开展甲磺酸贝福替尼生育力试验。大鼠4周重复给药毒性试验中,雌、雄大鼠每天1次,连续4周经口给予甲磺酸贝福替尼,给药剂量≥50 mg/kg (以AUC计,雌鼠、雄鼠暴露量约为人推荐剂量100 mg/天的1.3 倍和2.6倍;以体表面积计,约为人推荐剂量100 mg/天的4.8倍)时,可见阴道上皮细胞粘液样变;给药剂为150 mg/kg (以 AUC计,雌鼠、雄鼠暴露量约为人推荐剂量100 mg/天的6.5倍和3.6倍;以体表面积计,约为人推荐剂量100 mg/天的14.5倍)时,可见精囊腺上皮空泡变、子宫颈上皮粘液样变、卵巢黄体细胞空泡变、子宫和阴道萋缩。大鼠胚胎-胎仔发育毒性试验中,妊娠大鼠于妊娠第6-20天,飫1次,经口给予甲磺酸贝福替尼10、30、 75 mg/kg。给药剂量≥30 mg/kg (以AUC计,约为人推荐剂量100 mg/天的0.9倍;以体表面积计,约为人推荐剂量100 mg/天的2.9倍)时,可见母体毒性,包括竖毛、体重降低和摄食量减少。给药剂为30mg/kg时,可见胎仔体重明显降低。给药剂量为75 mg/kg (以AUC计,约为人推荐剂量100 mg/天的2.0倍;以体表面积计,约为人推荐剂量100 mg/天的7.3倍)时,可见子宫连胎重、胎仔体重和冠臀长明显降低;可见胎仔外观异常和骨骼异常,包括前掌过度屈曲、头盖骨缺失、胸骨节骨化异常(骨化不全、未骨化、双向骨化、分叉、单侧骨化、线性不正/缺失/裂缝)、胸椎体双向骨化、 胸椎弓裂缝、波状肋、肋骨短、肋软骨融合、肋骨缺失。给药剂量为10 mg/kg (以AUC计,约为人推荐剂量100 mg/天的0.3倍;以体表面积计,约为人推荐剂量100mg/天的0.97倍)时,规母体毒性,规对胚胎胎仔发育产生不良影响。胎仔匀浆中可检测到一定水平甲磺酸贝福替尼,甲磺酸贝福替尼可通过胎盘屏障。致癌性:尚末进行甲磺酸贝福替尼的致癌性研究。
贝福替尼治疗EGFRT790M突变部晚期或转移性NSCLC患者的II 期研究(IBIO-102) :IBIO-102研究是一项多中心、开放性的II期研究,该研究-共入选了290例既往接受过一代或二代EGFR-TKI耐药后产生T790M突变的局部晚期或转移性NSCLC患者。这些患者服用推荐剂量(75- →100 mg)贝福替尼,即从每日75mg起始剂开始服用,连续服用21日;若无严重副作用或不耐受, 21日后剂量调整为每日100 mg。该研究的主要疗效终点为根据实体瘤疗效评价标准1.1版(RECIST1.1)由独立评审委员会(IRC) 评估的客观缓解率(ORR) 。 次要疗效终点包括无进展生存期(PFS)、 缓解持续时间 (DoR)、疾病控制率(DCR)、颅内客观缓解率(iORR)、颅内病灶的无进展生存期(iPFS) 和总生存期(OS) 。该研究的中位随访时间为13.7个月。290例纳入有效性数据分析的患者基线特征为:中位年龄为62.5岁(范围: 37-79岁) ;其中男性34.5%, 女性655%; 262%的患者有吸烟史,73.8%无吸烟史 98.6% 的患者为腺癌,0.7% 为腺鳞癌,0.7% 为其他病理分型;均为EGFRT790M突变阳性,其中65.9%的患者伴19外显子缺失,32 8%伴L858R突变,1.4% 伴其他突变; 21 .4%的患者ECOG评分为0分, 78.6%为1分;36 2%的患者伴有脑转移(IRC 评估)。表3汇总了贝福替尼II期关键性研究中由IRC评估的整体有效性数据,包括ORR、DCR、 中位PFS和中位DoR,中位OS数据尚未成熟。CNS转移患者的疗效数据在研究治疗开始前至少4周内,脑转移无症状或无需类固醇药物治疗、疾病稳定的脑转移患者可入组研究。II 期关键性研究入组了105 例(36.2%) 经IRC判断基线有脑转移的患者,其中34例患者经IRC评估有颅内靶病灶。由IRC根据:RECISTv1.1标准评估的CNS疗效总结如下: CNSORR为55.9% (95%CI:37.9%,72.8%),3例(8.8%)为烷全缓解(CR) ,16例(47.1%) 为部分缓解(PR) ; CNSDCR为97.1% (95%Cl: 84.7%, 99.9%) ,CNSmPFS尚未达到,数据成熟度为17.1%,95%CI下限为16.5个月; CNSmDoR 尚未达到,数据成熟度为17.9%,95%CI下限为15.1个月。IBIO-103研究是一项随机、对照、多中心、开放性的1II期研究,在既往未接受过系统治疗的EGFR敏感突变阳性的局部晚期或转移性NSCLC患者中,评价贝福替尼(75 →100mg,每天-次)对比埃克替尼(125 mg,每天三次)的有效性和安全性。目前该研究已完成受试者入组并达成主要终点。
吸收:晚期NSCLC患者单次空腹口服本品75 mg或100 mg剂后,血浆中原型药物的中位达峰时间(Tmax) 分别为6h (4-24h) 和4h (4-8h) ,平均峰浓度(Cmax)分别为188+67 .5nM和415+203nM,平均曲线下面积(AUC0-24) 分别为2930+1180 h*nM和6400+3850 h*nM;活性代谢产物D-0865比原型药物达峰时间延后,100 mg剂量下中位Tmax为28h (6-48h),平均Cmax为15. 2+5.59nM,平均AUC0-24为277+116 h*nM。本品的暴露与剂量呈比例化线性关系。晚期NSCLC患者每日一次连续口服给药,约第8天达稳态。100 mg剂量下原型药物的平均蓄积比(Rac (AUC) )为4.47+0.35, D-0865的平均Rac (AUC) 为15.2+7.12,提示连续给药后,贝福替尼及其代谢物在体内均存在一定程度的蓄积。高脂高热量饮食对本品的药动学参数影响不大。分布:体外试验显示,约99%的贝福替尼与人血浆蛋白结合,且在1μM至10μM范围内,其血浆蛋白结合率不随浓度改变而明显变化,贝福替尼均匀分布于血细胞和血浆之间。晚期NSCLC患者单次口服本品100 mg剂后,贝福替尼的平均表观分布容积(Vz/F) 为803+347L。代谢:体外试验显示本品主要通过CYP3A4进行代谢,其次是CYP3A5、CYP2C8和CYP2D6代谢。健康受试者单次口服75 mg/50μCi的[14C贝福替尼后,在体内代谢广泛,主要代谢途径为氧化、N去甲基、半胱氨酸和谷胱甘肽结合等。贝福替尼在血浆中主要以原形药物形式存在,主要活性代谢产物为N去甲基化代谢物D-0865,其在血浆、尿液及粪便中的比例分别为19%、2.15% 及9.92%。排泄:单次给予本品100 mg后,在晚期NSCLC患者体内原型药物贝福替尼的平均消除相半衰期(T1/2) 为76.6+21.4h, D-0865的平均T12为154+37.1 h。贝福替尼的平均表观清除率(CL/F) 为7. 44+3.27Uh。健康受试者单次口服75 mg/50μCi的[14C]贝福替尼后,原型药物及代谢产物主要经粪便排泄,少部分经尿液排泄。截止第21天收集样品结束时,放射性累积排泄率为89 03%+2.19%,其中粪便累积排泄率为83. 46%+1.88%,尿液排泄率为5.57%+0.78%。特殊人群:尚未针对儿童进行药代动力学研究。尚未针对老年患者进行独立的药代动力学研究。群体药代动力学分析结果显示,年龄(分布范围为34-79岁,中位年龄为62岁)对贝福替尼及其代谢物的药代动力学参数没有明显影响。尚未针对肝功能损害患者进行独立的药代动力学研究。群体药代动力学分析结果显示,轻度肝功能损伤对贝福替尼及其代谢物的药代动力学参数没有明显影响。在已开展临床研究中,排除了ALT/AST>2.5倍正常值上限(ULN)、或总胆红素 >1.5倍ULN的患者(或者如果有肝转移,相应限值放宽到5.0倍ULN及3.0倍ULN),尚无中重度肝功能损害患者服用本品的临床试验数据。尚末针对肾功能损害患者进行独立的药代动力学研究。群体药代动力学分析结果显示,轻中度肾功能损伤对贝福替尼及其代谢物的药代动力学参数没有明显影响。在已开展临床研究中,排除了血清肌酐> 1.5 倍ULN或肌酐清除率< 50 ml /min(根据Cockroft-Gault公式计算)的患者,尚无重度肾功能损害患者服用本品的临床试验数据。
胶囊剂
50mg(按C₂₉H₃₂F₃N₇O₂计)
25mg*40粒
6000.00
国药准字H20230012;国药准字H20230011