亿立舒说明书
Efbemalenograstim alfa Injection
艾贝格司亭α
活性成份:人粒细胞集落刺激因子(G-CSF )双分子和人免疫球蛋白(hIgG2)Fc片段组成的重组融合蛋白[由中国仓鼠卵巢细胞表达并纯化得到]。分子量: 93.4KD。辅料:冰醋酸,醋酸钠,山梨醇,聚山梨酯20,依地酸二钠
本品为无色或淡黄色澄明液体。
本品适用于成年非髓性恶性肿瘤患者在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,降低以发热性中性粒细胞减少症为表现的感染发生率。本品不适用于造血干细胞移植的外周血祖细胞的动员。
本品在每个化疗周期抗肿瘤药物给药结束48小时后皮下注射。成人推荐使用剂量为皮下注射20mg,每个化疗周期注射一-次。请勿在使用细胞毒性化疗药。物前14天到化疗后24小时内给予本品。注射前,应当检查本品溶液是否澄清透明,如观察到悬浮物质产生或变色,不得继续使用。在使用前,预充式注射器需在室温下放置约30分钟。如果本品在室温下放置超过48小时,请勿使用。本品的预充式注射器中针帽含有合成橡胶,橡胶过敏人群请勿使用本品。
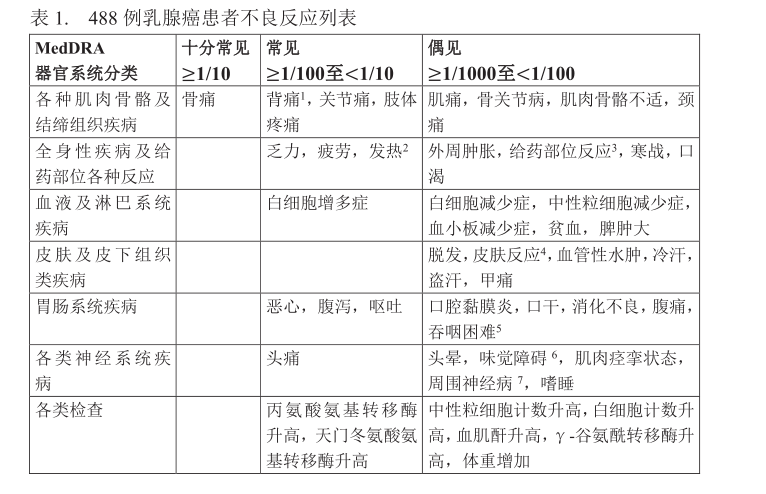
由于临床试验在不同条件下完成,在临床试验中观察到的药物不良反应率不能直接和其他药物在临床试验中的不良反应率相比较,且未必反映在实际应用中的不良反应率。以下几项严重不良反应见:脾破裂、急性呼吸窘迫综合征、严重过敏反应、镰状细胞病危象、肾小球肾炎、白细胞增多症、毛细血管渗漏综合征、对肿瘤恶性细胞生长的潜在刺激效应和主动脉炎。本品安全性数据包含7个临床试验中的727例接受本品治疗的化疗后女性乳腺癌患者。患者年龄范围为25至83岁,66%种族为高加索人种,33%为亚洲人种和<1%的拉丁裔、黑人等其他人种。大多数患者(n=488 例)每化疗周期接受本品20 mg皮下注射一次,共4个化疗周期。基于727例患者的安全性数据,本品发生率≥5%的不良反应为骨痛和背痛,发生率分别为11.1%和 5%,其余不良反应<5%。以“下不良反应数据来自于488例乳腺癌患者在化疗结束24小时或48小时后使用20mg本品的临床试验数据,详见表1。按照器官系统分类和发生频率显示这些不良反应。发生频率定义为:十分常见(≥1/10);常见(≥1/100至<1/10);偶见(≥1/1000至<1/100);罕见(≥1/10000至<1/1000);十分罕见(<1/10000)。在每一发生频率组,按严重程度从高到低依次列出这些不良反应。
免疫原性:与所有治疗性蛋白药物一样,本品具有潜在的免疫原性。抗药抗体检测高度依赖于检测方法的灵敏度和特异性。此外,抗药抗体(包括中和抗体)阳性发生率还受多种因素的影响,包括检测方法、样本处理、样本采集时间、合并用药、基础疾病。基于以上原因,当比较本品临床试验和其他产品临床试验中观察到的抗药抗体发生率时,可能会存在误导。基于436例患者血液样本的免疫原性试验结果,本品治疗中抗药抗体发生率为4.6%,无中和抗体活性。
已知对本品严重过敏者禁用。严重肝、肾、心、肺功能障碍者禁用。骨髓中幼稚粒细胞未显著减少的骨髓性白血病患者或外周血中检出幼稚粒细胞的骨髓性白血病患者禁用。
用药期间的注意事项包括但不限于以下情况:1、请勿在使用细胞毒性化疗药物前14天到化疗后24小时内注射。2、使用本品过程中应注意血常规的监测,特别是中性粒细胞计数的变化情况。3、如使用本品出现过敏症状或疑似过敏症状,需对症治疗,如重复使用本品后过敏症状仍出现,建议不再使用本品。4、生长因子治疗可使骨髓造血活性增加,从而导致骨显像变化一过性阳性。当使用本品时,解释骨显像结果时应考虑。5、本品仅供在医生指导下使用。长期使用本品的安全有效性尚未建立,以下不良反应在本品临床研究中尚未观察到。据国外同类药物研究报道,G-CSF还可能引起以下不良反应,如有下列反应的患者应立即联系医师,并告知症状:1、脾破裂:患者在使用rhG-CSF或PEG-G-CSF产品(如非格司亭,聚乙二醇非格司亭和本品)时,可能发生脾破裂,可为致命性。若患者在使用本品后出现左上腹或肩部疼痛应警惕并及时评估是否发生了脾肿大或脾破裂。2、急性呼吸窘迫综合征( ARDS)患者在使用rhG-CSF或PEG-G-CSF产品(如非格司亭,聚乙二醇非格司亭和本品)时,可能发生急性呼吸窘迫综合征。若患者在使用本品后出现发热、肺浸润或呼吸窘迫,应立即就诊确定其是否为急性呼吸窘迫综合征。若患者出现急性呼吸窘迫综合征应停止使用本品。3、严重过敏反应患者在使用rhG-CSF或PEG-G-CSF产品(如非格司亭,聚乙二醇非格司亭和本品)时,可能发生严重的过敏反应,包括过敏性休克。对本品发生严重过敏反应的患者应永久停用本品。对本品有严重过敏反应史的患者禁用。4、镰状细胞病危象:镰状细胞病患者使用rhG-CSF或PEG-G-CSF产品,如非格司亭,聚乙二醇非格司亭和本品后,可能会发生严重的甚至致命的镰状细胞病危象。5、肾小球肾炎:目前已有患者接受rhG-CSF或PEG-G-CSF产品治疗后发生肾小球肾炎的报道。主要根据氮质血症、血尿、蛋白尿和肾活检明确诊断。一般来说肾小球肾炎在减少G-CSF产品的剂量或停用后可缓解。如果怀疑是肾小球肾炎,需评估其原因。如果认为与药物相关,应考虑进行减量或中断治疗。6、白细胞增多症:接受rhG-CSF或PEG-G-CSF产品治疗的患者中已观察到白细胞(WBC)计数≥100x109/L。建议接受本品治疗期间监控全血细胞计数(CBC)。7、毛细血管渗漏综合征:使用rhG-CSF或PEG-G-CSF产品后已有发生毛细血管渗漏综合征的报道,表现为低血压、低白蛋白血症、水肿和血液浓缩。发生的频率和严重程度不同,治疗延误可能会危及生命。应对发生毛细血管渗漏综合征症状的患者密切监测,并给予标准的治疗,必要时进行重症监护。8、对肿瘤恶性细胞生长的潜在刺激效应在肿瘤细胞系中发现可与rhG-CSF或PEG-G-CSF作用的G-CSF受体,艾贝格司亭a作为任何类型肿瘤的生长因子的可能性不能被排除,包括艾贝格司亭未被批准应用的髓性恶性肿瘤和骨髓增生异常。9、主动脉炎:患者使用rhG_CSF或PEG-G-CSF产品治疗后,已有发生主动脉炎的报道。最早可在初次给药一周内发生。主动脉炎的表现可能包括全身性体征和症状,例如发烧、腹痛、不适、背痛和炎症标志物(例如C-反应蛋白和白细胞计数)升高。患者发生这些体征和症状但病因不明应警惕主动脉炎。如果怀疑是主动脉炎,应停止使用本品。
在单次或多次给药剂量中,能安全使用的本品的最大限量尚未完全确定。过量应用本品可能会导致白细胞增多和骨痛。1例乳腺癌患者连续2天皮下注射本品共计40mg,没有严重的不良反应发生,白细胞最大值为29.3x10%/L,中性粒细胞计数最大值为23.6x10%/L。在过量事件中,应监测患者的不良反应。没有证据表明白细胞去除术能有效解决由于使用该类药物而产生的白细胞升高。
在儿童患者中的安全性和有效性尚未确定。
目前尚未进行本品和其它药物之间相互作用的研究。
亿一生物制药(北京)有限公司
86983514000011
艾贝格司亭a是由人G-CSF和人IgG2 Fc片段组成的重组融合蛋白。人粒细胞集落刺激因子(G-CSF)可作用于造血细胞,驱动中性粒细胞的分化、增殖和成熟,增加外周血中性粒细胞水平。艾贝格司亭a可促进正常小鼠、大鼠和食蟹猴外周血白细胞计数和中性粒细胞计数的增加。在中性粒细胞减少的动物模型(5-氟尿嘧啶诱导小鼠模型、Co-γ射线照射诱导小鼠模型、环磷酰胺诱导食蟹猴模型)中,艾贝格司亭a可加快白细胞和中性粒细胞的恢复
遗传毒性:尚未进行艾贝格司亭a.的遗传毒性研究。生殖毒性:雌雄大鼠每周1次皮下注射艾贝格司亭a,在最高至0.75 mg/kg剂量下(按体表面积换算,雄鼠给药10次累积剂量约为人体推荐剂量单次皮下注射20 mg的3.6倍;雌鼠给药6次累积剂量约为人体推荐剂量单次皮下注射20mg的2.16倍)对大鼠生育力和早期胚胎发育未见明显影响。妊娠大鼠于器官发生期每隔1天皮下注射艾贝格司亭a,在最高至0.75 mg/kg剂量下(按体表面积换算,给药7次累积剂量约为人体推荐剂量单次皮下注射20mg的2.6倍)对大鼠胚胎-胎仔发育未见明显影响。妊娠大鼠分别于妊娠第6、13、 20天和哺乳期第4、11、18天皮下注射艾贝格司亭a,在最高至0.75mg/kg剂量下(按体表面积换算,给药6次累积剂量约为人体推荐剂量单次皮下注射20 mg的2.16倍)对大鼠子代发育、生殖等未见明显影响。妊娠兔于器官发生期每隔1天皮下注射艾贝格司亭a,在最高至0.1 mg/kg 。剂量下(按体表面积换算,给药7次累积剂量约为人体推荐剂量单次皮下注射20mg的0.68倍)对兔胚胎胎仔发育未见明显影响。致癌性:尚未进行艾贝格司亭a的致癌性研究。
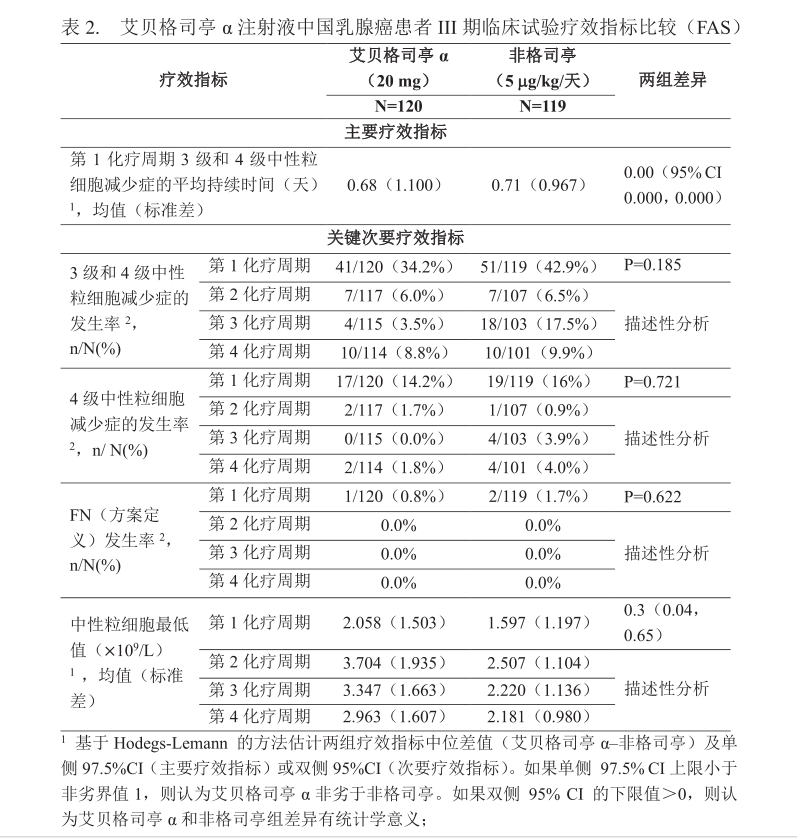
在三项随机对照II期临床试验中评价了本品的疗效和安全性。试验1在中国开展,试验2和试验3在欧洲和美国开展。试验1:试验1为一项接受化疗的乳腺癌患者中比较本品与非格司亭(惠尔血®)有效性和安全性的开放性随机对照III期临床试验。共242例中国乳腺癌患者进入本试验,其中120例接受本品20mg固定剂量,119例接受非格司亭治疗(5μug/kg/天)。两组受试者接受4个周期的表柔比星100mg/m2联合环磷酰胺600mg/m2的辅助化疗,每周期21天。本品在每个化疗周期的第3天(即化疗开始后48+4小时)皮下注射一次,对照药每个疗程的第3天(即化疗开始后48+4小时)起每日皮下注射一次,连续治疗≤2周或者当ANC从谷底恢复至5.0x10%/L时停用。试验1结果显示本品20mg剂量组主要疗效指标(第1化疗周期3级和4级中性粒细胞减少症的平均持续时间)非劣效于阳性对照非格司亭[分别为0.68天,0.71天,中位差异为0.00天,97.5%CI (0.000) ]。 本品在4个化疗周期的中性粒细胞最低值高于非格司亭对照组,组间差异有统计学意义;第3化疗周期4级中性粒细胞减少症的发生率、3级和4级中性粒细胞减少症的发生率低于非格司亭对照组,组间差异有统计学意义。其余关键次要指标在第1化疗周期和整个化疗周期组间差别无统计学意义。全部4个化疗周期,发热性中性粒细胞减少症(FN)发生率较低。本品和非格司亭对照组分别只有1例和2例患者因FN或感染事件入院治疗。

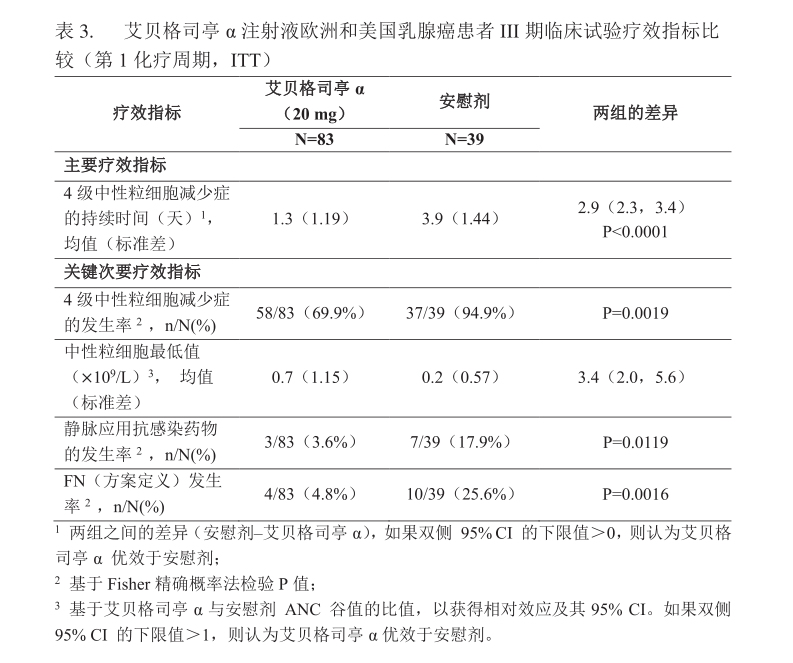
试验2:试验2为--项接受化疗的乳腺癌患者中比较本品与安慰剂的有效性和安全性的双盲随机对照的II期临床试验。共122例乳腺癌患者进入本试验,其中83例接受本品20 mg固定剂量,39例在第1周期接受安慰剂对照治疗,第2-4周期接受本品20 mg。两组受试者均接受4个周期的多柔比星60 mg/m2联合多西他赛75mg/m2化疗,每周期21天。本品或安慰剂在每个化疗周期的第2天(即化疗结束24小时后)皮下注射一次。试验2达到预设主要疗效指标。接受本品治疗的患者主要疗效终点(第1周期4级中性粒细胞减少症持续时间)相比安慰剂组患者显著缩短(分别为1.3天和3.9天,P<0.0001; 均值差异2.9天)。本品治疗组第1周期FN发生率相比安慰剂组显著降低(分别为4.8%,25.6%), 第1周期静脉应用抗感染药物的发生率显著低于安慰剂组( 分别为3.6%和17.9%)。只有1名患者(安慰剂治疗组)因发热性中性粒细胞减少症或感染住院。
试验3:试验3为一项接受化疗的乳腺癌患者中比较本品与培非格司亭(Neulasta®)的有效性和安全性的开放性随机对照的II期临床试验。共393例乳腺癌患者进入本试验,其中197例接受本品20 mg固定剂量,196 例接受6 mg培非格司亭阳性对照治疗。两组受试者均接受4个周期多西他赛75 mg/m2和环磷酰胺600mg/m2化疗,每周期21天。本品与对照药均在每个化疗周期的第2天(即化疗结束24小时后)皮下注射一次。试验3结果达到预设主要疗效指标。主要疗效终点(第1周期4级中性粒细胞减少症平均持续时间)两组均为0.2天[平均值差异0.0天, 95%CI(-0.1,0.1)]。在全部4个化疗周期中,两组FN的发生率和静脉应用抗感染药物的天数组间无显著差异。两组均有1例患者因FN或感染住院。本品治疗组总体感染发生率为7.1%,培非格司亭治疗组为8.7%。其他疗效终点均证实了本品和培非格司亭的可比性。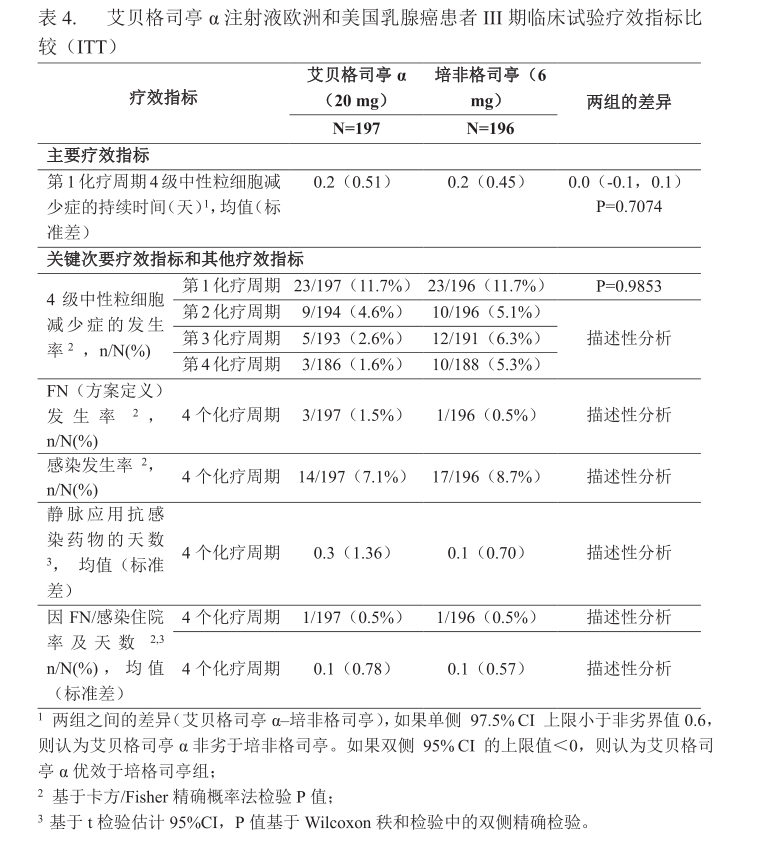

本品药代动力学呈非线性特征,清除率随给药剂量的增加而降低。中国健康受试者接受20mg本品单次皮下注射后,血药浓度快速增加,中位达峰时间Tmax约为24小时(范围: 16 小时~36小时)。消除相半衰期T1n平均值(标准差)为46.898+37.305小时。清除率CL和表观分布容积Vz平均值(标准差)分别为1.307+1 .805 L/h和89.108+125.123 L。
注射剂
20 mg(1.0 ml)/支(预充式注射器)
预充式注射器装20mg (1.0mL) /支,每盒1支。
在2°C至8°C下避光处保存和运输。
100.00
18个月
国药准字S20230026


