睿妥说明书
Selpercatinib Capsules
塞普替尼
本品主要成份为塞普替尼。
化学名称:6-(2-羟基-2-甲基丙氧基)-4-(6-(6-((6-甲氧基吡啶-3-基)甲基)-3,6-二氮杂双环[3.1.1]庚基-3-基)吡啶-3-基)吡啶[1,5-a]吡啶-3-腈
化学结构式:
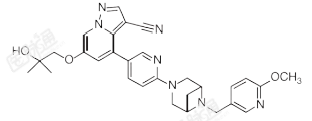
分子式:C29H31N7O3
分子量:525.61
辅料:胶囊内容物:微晶纤维素、胶态二氧化硅
40mg胶囊壳:明胶、二氧化钛、氧化铁
80mg胶囊壳:明胶、二氧化钛、FD&C蓝色#1
印字:虫胶、氢氧化钾和氧化铁
本品为灰色不透明胶囊,表面有“Lilly”、“3977”和“40 mg”的黑色油墨印字,内容物为白色或类白色至淡黄色粉末(40mg 规格)。本品为蓝色不透明胶囊,表面有“Lilly”、“2980”和“80 mg”的黑色油墨印字,内容物为白色或类白色至淡黄色粉末(80mg 规格)。
本品用于转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。本品适用于需要系统性治疗的晚期或转移性RET突变型甲状腺髓样癌(MTC)成人和12岁及以上儿童患者的治疗,以及需要系统性治疗且放射性碘难治(如果放射性碘适用)的晚期或转移性RET融合阳性甲状腺癌成人和12岁及以上儿童患者的治疗。上述适应症均是基于一项RET基因改变晚期实体瘤研究的结果给予的附条件批准。该适应症的完全批准将取决于正在进行的确证性试验的临床获益。
本品应由在抗肿瘤治疗方面富有经验的医生处方使用。患者选择:使用本品前必须明确有经充分验证的检测方法检测到RET基因融合阳性(非小细胞肺癌或甲状腺癌)或RET突变(甲状腺髓样癌)。推荐剂量:基于体重,本品的推荐剂量为:低于50kg:120mg;50kg或以上:160mg;本品口服给药,每日2次(大约间隔12小时),直至发生疾病进展或不可耐受的毒性。整颗吞服胶囊。请勿压碎或咀嚼胶囊。如有漏服本品,且距下一次计划服药时间大于6小时,应补服错过的剂量。如果在服用本品后出现呕吐,请勿补服额外的剂量,请按计划继续服用下个剂量。重要的服药说明:除与质子泵抑制剂(PPI)联合用药时,本品与食物同服或不同服均可。剂量调整:针对不良反应的剂量调整:表1提供了发生不良反应时推荐的剂量降低。表1:发生不良反应时推荐的剂量降低
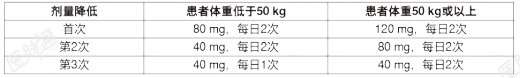
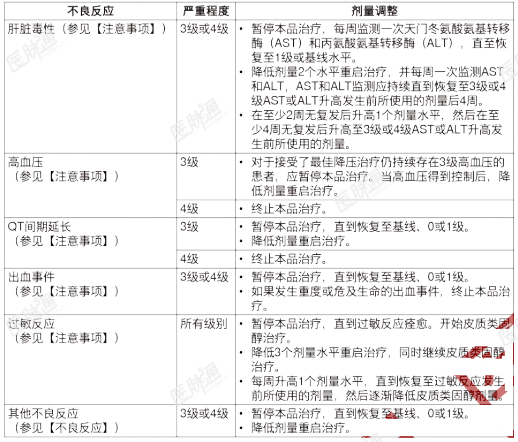
不能耐受3次剂量降低的患者应永久终止本品治疗。表2中提供了发生不良反应时推荐的剂量调整。表2:发生不良反应时推荐的剂量调整
合并使用抗酸剂时的剂量调整:避免本品与PPI、组胺-2(H2)受体拮抗剂或局部作用的抗酸剂联合用药。如不能避免联合用药:当与PPI联合用药时,本品需与食物同服。在H2受体拮抗剂服药前2小时或服药后10小时服用本品。在局部作用的抗酸剂服药前2小时或服药后2小时服用本品。与强效CYP3A抑制剂联合用药时的剂量调整
避免本品与强效CYP3A抑制剂联合用药。如无法避免,根据表3中的建议降低本品剂量。在停用CYP3A抑制剂3至5个消除半衰期后,以开始CYP3A抑制剂治疗前所使用的剂量重启治疗。表3:与强效CYP3A抑制剂联合用药时的推荐剂量

特殊人群用药:肝功能不全:重度肝功能不全时的剂量调整:对于重度肝功能不全患者,根据表4的建议降低推荐剂量。表4:重度肝功能不全患者的推荐剂量

轻度和中度肝功能不全:轻度(总胆红素≤ULN,且AST大于ULN,或总胆红素大于1至1.5倍ULN且伴任何AST)或中度(总胆红素大于1.5倍至3倍ULN伴任何AST)肝功能不全患者使用本品不建议调整剂量。应监测肝功能不全的患者服用本品时相关的不良反应。肾功能不全:轻度至重度肾功能不全(根据肾脏病饮食改良[MDRD]公式估计的肾小球滤过率[eGFR]≥15至89mL/min)患者使用本品不建议调整剂量。尚未确定终末期肾病(ESRD)患者中的推荐剂量
由于临床试验是在各种不同条件下进行的,因此不同药物在临床试验中观察到的不良反应发生率无直接可比性,且可能无法反映临床实践中观察到的不良反应发生率。RET基因融合阳性或RET突变的实体瘤:以及下文中描述的安全性人群反映了在LIBRETTO-001研究中702名患者口服本品160mg每日2次的暴露情况。在702名接受本品治疗的患者中,65%暴露6个月或以上,34%暴露1年以上。在这些患者中,95%至少服用了1次本品的推荐剂量(160mg口服给药,每日2次)。中位年龄为59岁(范围:15至92岁);0.3%为12至16岁的儿童患者;52%为男性;69%为白人,22%为亚洲人,5%为西班牙裔/拉丁裔,3%为黑人。最常见的肿瘤为NSCLC(47%)、MTC(44%)和非髓样甲状腺癌(5%)。接受本品治疗的患者中有33%发生了严重不良反应。最常见的严重不良反应(发生于≥2%的患者)为感染性肺炎。3%的患者发生了致死性不良反应;超过1名患者的致死性不良反应为脓毒血症(n=3)、心脏停搏(n=3)和呼吸衰竭(n=3)。接受本品治疗的患者中有5%因不良反应而永久终止治疗。导致永久终止治疗的不良反应包括ALT升高(0.4%)、脓毒血症(0.4%)、AST升高(0.3%)、药物过敏反应(0.3%)、疲乏(0.3%)和血小板减少症(0.3%)。接受本品治疗的患者中有42%因不良反应而暂停服药。导致≥2%的患者暂停服药的不良反应为ALT升高、AST升高、高血压、腹泻、发热和QT间期延长。
接受本品治疗的患者中有31%因不良反应而降低剂量。导致≥2%的患者剂量降低的不良反应为ALT升高、AST升高、QT间期延长和疲乏。最常见的不良反应(包括实验室监测结果异常;≥25%)为AST升高、ALT升高、葡萄糖升高、白细胞减少、白蛋白减少、钙减少、口干、腹泻、肌酐升高、碱性磷酸酶升高、高血压、疲乏、水肿、血小板减少、总胆固醇升高、皮疹、钠减少和便秘。表5中总结了LIBRETTO-001研究中的不良反应。表5:LIBRETTO-001研究中接受本品治疗的患者发生的不良反应(发生率大≥15%)
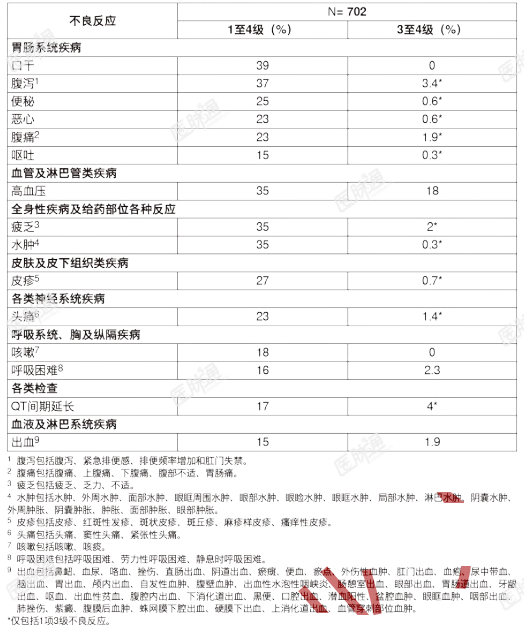
发生率≤15%的临床相关不良反应为甲状腺功能减退症和肿瘤溶解综合征。表6总结了LIBRETTO-001研究中的实验室检查结果异常。表6:LIBRETTO-001研究中接受本品治疗的患者发生的较基线恶化的实验室检查结果异常(发生率≥20%)
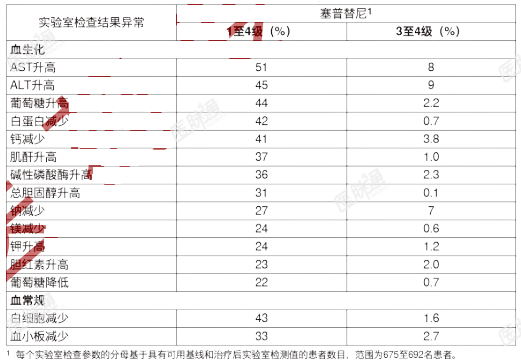
肌酐升高:在接受本品160mg每日2次口服给药的健康受试者中,血清肌酐在10天后升高18%。如果观察到血清肌酐持续升高,考虑使用其他肾功能标志物
禁用于对活性成分或任何辅料过敏者。
肝脏毒性:接受本品治疗的患者中有2.6%发生了严重的肝脏不良反应。51%的患者发生了AST升高,包括发生3级或4级事件的8%的患者;45%的患者发生了ALT升高,包括发生3级或4级事件的9%的患者。至首次发生AST升高的中位时间为4.1周(范围:5天至2年),至首次发生ALT升高的中位时间为4.1周(范围:6天至1.5年)。在开始本品治疗前,应监测AST和ALT,在治疗的最初3个月内,每2周监测一次,此后每月监测一次,或存在临床指征时进行监测。根据肝脏毒性的严重程度暂停本品治疗、降低本品剂量或永久终止本品治疗。高血压:35%的患者发生了高血压,包括发生3级高血压的17%的患者和1名(0.1%)发生4级高血压的患者。总体而言,4.6%的患者因高血压而暂停治疗,1.3%的患者因高血压而降低剂量。治疗期间出现的高血压通常能通过降压药得到控制。
血压控制不佳的高血压患者请勿开始本品治疗。在开始本品治疗之前应优化血压。在治疗开始后1周监测血压,随后至少每月1次或存在临床指征时进行监测。酌情启用或调整降压治疗。根据高血压的严重程度暂停本品治疗、降低本品剂量或永久终止本品治疗。QT间期延长:本品可引起浓度依赖性QT间期延长。在6%的患者中QTcF间期延长至>500毫秒,15%的患者中QTcF间期相比基线延长至少60毫秒。尚未在具有临床意义的活动性心血管疾病的患者或近期发生心肌梗死的患者中进行研究。应监测有发生QTc间期延长显著风险的患者,包括已知患有长QT间期综合征、具有临床意义的心动过缓以及重度或控制不佳的心力衰竭患者。在基线时和治疗期间定期评估QT间期、电解质和TSH,并根据包括腹泻在内的危险因素调整评估频率。在开始本品治疗之前和治疗期间治疗低钾血症、低镁血症和低钙血症。当本品与强效CYP3A抑制剂或已知会延长QTc间期的药物联合用药时,应更频繁地监测QT间期。根据QT间期延长地严重程度暂停本品治疗、降低本品剂量或永久终止本品治疗。出血事件:
本品治疗期间会发生严重(包括致死性)出血事件。接受本品治疗地患者中有2.3%发生了≥3级的出血事件,包括发生致死性出血事件(大脑出血、气管造口术部位出血和咯血各1例)的3名患者(0.4%)。发生重度或危及生命的出血患者应永久终止本品治疗。过敏反应:接受本品治疗的患者中有4.3%发生了过敏反应,包括1.6%的患者发生3级过敏反应。至过敏反应发生的中位时间为1.7周(范围:6天至1.5年)。过敏反应的体征和症状包括发热、皮疹和关节痛或肌痛,伴有血小板减少或转氨酶升高。如果发生过敏反应,暂停本品治疗,并以1mg/kg泼尼松(或当量)开始皮质类固醇治疗。在过敏反应事件痊愈后,降级剂量重启本品治疗,每周升高1个剂量水平,直至达到过敏反应发生前所使用的剂量。应继续类固醇治疗,直至达到患者目标剂量,然后逐渐减量。如果过敏反应复发,永久终止本品治疗。肿瘤溶解综合征:接受本品治疗的甲状腺髓样癌患者中有1%的患者发生了肿瘤溶解综合征(TLS)。如果患者肿瘤生长迅速、肿瘤负荷高、存在肾功能不全或脱水,则可能存在TLS风险。密切监测存在风险的患者,考虑采取适当的预防措施,包括补液,并根据临床指征进行治疗。伤口愈合不良的风险:接受抑制血管内皮生长因子(VEGF)信号通路的药物治疗的患者可能会发生伤口愈合不良。因此,本品有可能对伤口愈合产生不利影响。在进行择期手术之前,暂停本品治疗至少7天。在进行重大手术后,请勿使用本品治疗至少2周,直到伤口充分愈合。尚未确定伤口愈合并发症痊愈后重启本品治疗的安全性。胚胎-胎儿毒性:根据动物生殖研究的数据及其作用机制,当本品用于妊娠女性时可能会导致胎儿损害。妊娠大鼠在器官形成期接受本品给药,母体暴露量在约等于人体推荐剂量160mg每日2次时,导致了胚胎死亡和畸形。告知育龄女性本品对胎儿的潜在风险。建议具有生育能力的女性患者在本品治疗期间和最后1次服药后至少1周内采取有效的避孕措施。建议具有生育能力的女性伴侣的男性患者在本品治疗期间和最后1次服药后1周内采用有效的避孕措施。具有生育能力的女性和男性:妊娠试验:在服用本品前应核实具有生育能力女性的妊娠状态。
避孕:女性:建议具有生育能力的女性患者在本品治疗期间和最后1次服药后1周内采用有效的避孕措施。男性:建议有具有生育能力的女性伴侣的男性患者在本品治疗期间和最后1次服药后1周内采用有效的避孕措施。
生育能力本品可能损害女性和男性的生育能力
尚未确立药物过量的症状。如果怀疑药物过量,应提供全面支持性治疗。
在702名接受本品治疗的患者中,34%(239名患者)≥65岁,10%(67名患者)≥75岁。在≥65岁的患者中,未观察到本品在安全性或有效性上存在总体差异。
其他药物对本品的影响:抗酸剂:将本品于抗酸剂联合用药会降低本品血浆浓度,这可能会降低本品的抗肿瘤活性。避免将本品与PPI、H2受体拮抗剂或局部作用的抗酸剂联合用药。如无法避免,将本品与食物同服(当与PPI联合用药时),或改变其服药时间(当H2受体拮抗剂或局部作用的抗酸剂联合用药时)。强效CYP3A抑制剂:将本品与强效CYP3A抑制剂联合用药会升高本品血浆浓度,这可能会增加本品不良反应的风险,包括QTc间期延长。避免本品与强效CYP3A抑制剂联合用药。如果不能避免与强效CYP3A抑制剂联合用药,降低本品剂量,并更频繁地通过ECG监测QT间期。强效和中效CYP3A诱导剂:本品与强效或中效CYP3A诱导剂联合用药会降低本品血浆浓度,这可能会降低本品地抗肿瘤活性。避免本品与强效或中效CYP3A诱导剂联合用药。本品对其他药物的影响:CYP2C8和CYP3A底物:本品是中效CYP2C8抑制剂和弱效CYP3A抑制剂。将本品与CYP2C8和CYP3A底物联合用药会升高其血浆浓度,这可能会增加与这些底物相关的不良反应风险。避免将本品与浓度的微小变化可能会引起不良反应增多的CYP2C8和CYP3A底物联合用药。如无法避免,请遵循CYP2C8和CYP3A底物批准的产品说明书的建议服药。导致QT间期延长的药物:本品与QTc间期延长有关。对于需要和已知会延长QTc间期的药物进行联合用药的患者,应更频繁地采用ECG监测QT间期。
Lilly del Caribe, Inc.
86978403001545;86978403001552
塞普替尼为激酶抑制剂, 可抑制野生型 RET、 多种 RET 突变亚型以及 VEGFR1 和VEGFR3, IC50 值范围为 0.92 nM 至 67.8 nM。 在其他酶试验中, 塞普替尼在临床可及的较高浓度下可抑制 FGFR1、 2 和 3。 在细胞试验中, 塞普替尼抑制 RET 的浓度比 FGFR1和 2 低约 60 倍, 比 VEGFR3 低约 8 倍。RET 的某些点突变或 RET 与染色体多种其它部分可译融合的染色体重排均可产生组成型激活的嵌合 RET 融合蛋白, 可作为致癌驱动因子促进肿瘤细胞系的细胞增殖。 在体外和体内肿瘤模型中, 塞普替尼在基因融合和突变(包括 CCDC6-RET、 KIF5B-RET、RET、V804M 和 RET M918T) 引起 RET 蛋白组成型激活的细胞中可见抗肿瘤活性。 此外,塞普替尼 在颅内植入患者来源的 RET 融合阳性肿瘤的小鼠中可见抗肿瘤活性。
遗传毒性:塞普替尼的 Ames 试验、 人外周血淋巴细胞染色体畸变试验结果为阴性。 在浓度大于7 倍人用剂量的 C max (160 mg, 每日 2 次) 时, 塞普替尼的大鼠体内微核试验为阳性。生殖毒性:一般毒理学试验中, 雄性大鼠和小型猪在塞普替尼的暴露量约为人推荐剂量的临床暴
露量(基于 AUC) 的 0.4 倍(大鼠) 和 0.1 倍(小型猪) 时, 可见与附睾腔内细胞碎片及精子减少有关的睾丸变性。 一项专门的雄性大鼠生育力试验中, 雄性大鼠在与未经治疗的雌性大鼠交配之前, 连续 28 天给予塞普替尼, 剂量高达 30 mg/kg/日(以 AUC 计, 约为
临床剂量 160 mg 每日 2 次的 2 倍), 未见对交配或对生育力产生明显影响。 雄性大鼠在 ≥
3 mg/kg 的剂量下(以 AUC 计, 约为临床剂量 160 mg 每日 2 次的 0.2 倍) 可见剂量依赖性
的睾丸生殖细胞耗竭和精子细胞滞留增加, 30 mg/kg 剂量下伴随精子形态改变。一项专门的雌性大鼠生育力试验中, 雌性大鼠从交配前 15 天至妊娠第 7 天给予塞普替尼, 75 mg/kg 剂量下(以 AUC 计, 约相当于临床剂量 160 mg 每日 2 次) 可见发情周期数减少, 尽管塞普替尼对交配行为或妊娠能力未见明显影响, 但 75 mg/kg 剂量组一半雌性大鼠的所有胚胎未能存活, 相同剂量水平下, 有胚胎存活的雌性大鼠可见着床后丢失增加。 一项小型猪 3 个月 一般毒理学试验中, 15 mg/kg 剂量下(以 AUC 计, 约为临床剂量160 mg 每日 2 次的 0.3 倍) 可见黄体减少或缺失, ≥ 2 mg/kg 剂量下(以 AUC 计, 约为临床剂量 160 mg 每日 2 次的 0.07 倍) 可见黄体囊肿。妊娠大鼠于器官发生期经口给予塞普替尼 ≥100 mg/kg(以 AUC计, 约为临床剂量160mg 每日 2 次的 3.6 倍), 导致 100%的着床后丢失, 50 mg/kg(以 AUC 计, 约相当于临床剂量 160 mg 每日 2 次) 剂量下, 8 只雌性动物中有 6 只可见 100% 的早期胚胎吸收, 其余2 只雌性动物可见高水平的早期胚胎吸收, 2 窝中仅有 3 只活胎仔, 所有活胎仔均可见体重减少和畸形(2 只短尾, 1 只小鼻以及胸颈部局部水肿)。致癌性:塞普替尼尚未进行致癌性试验。其它毒性:一项 4 周一般毒理学试验中, 大鼠在暴露量约≥3 倍人体暴露量(临床剂量 160 mg 每日 2 次) 的剂量下可见骨骺增生和牙齿发育不良的迹象。 一项 13 周一般毒理学试验中,小型猪在 15 mg/kg(以 AUC 计, 约为临床剂量 160 mg 每日 2 次的 0.3 倍) 高剂量下, 可见骺板厚度微小至显著增加的迹象。 4 周和 13 周毒理试验中, 大鼠在高剂量(以 AUC 计,约为临床剂量 160 mg 每日 2 次的 1.5 倍) 下出现咬合不良和牙齿变色, 恢复期内未见恢
复。
RET融合阳性非小细胞肺癌:在一项多中心、开放标签、多队列临床试验(LIBRETTO-001,NCT03157128)入组的RET融合阳性的晚期NSCLS患者中对本品的有效性进行了评价。该研究在单独的队列中入组了在含铂化疗后发生疾病进展的RET融合阳性的晚期或转移性NSCLC患者,以及既往未曾接受系统性治疗的晚期或转移性NSCLC患者。在当地实验室使用下一代测序(NGS)、聚合酶链式反应(PCR)或荧光原位杂交(FISH)前瞻性地确定了RET基因改变。成人患者口服本品160mg每日2次,直至发生无法耐受的毒性或疾病进展;入组剂量递增部分的患者可以调整剂量至160mg每日2次。主要的有效性指标包括经确认的客观缓解率(ORR)和缓解持续时间(DOR),由独立盲态审查委员会(BIRC)根据RECIST第1.1版确定。既往曾接受含铂化疗的RET融合阳性的转移性NSCLC对入组的LIBRETTO-001研究一个队列的既往曾接受含铂化疗的105名RET融合阳性的NSCLC患者的有效性进行了评价(数据截止日期:2019年12月16日)。中位年龄为61岁(范围:23至81岁);59%为女性;52%为白人,38%为亚洲人,4.8%为黑人,3.8%为西班牙裔/拉丁裔。ECOG体能状态为0-1分(98%)或2分(2%),98%的患者患有转移性疾病。患者接受的既往系统性治疗种数的中位数为3种(范围1-15);55%既往曾接受受抗PD-1/PD-L1治疗。90%的患者使用NGS检测出RET融合(81.9%为肿瘤样本;7.6%为血液或血浆样本);8.6%的患者使用FISH,1.9%的患者使用PCR检测出RET融合。RET融合阳性NSCLC的有效性结果总结于表8种。表8:LIBRETTO-001研究的有效性结果(既往接受含铂化疗的RET融合阳性的转移性NSCLC)
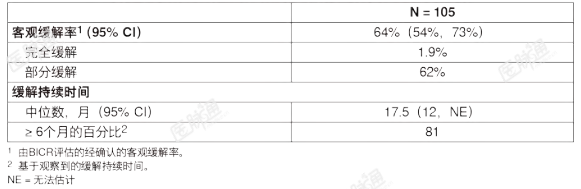
对于58名既往曾接受抗PD-1或抗PD-L1治疗(与含铂化疗序贯使用或同步使用)的患者,探索性亚组分析显示ORR为66%(95%CI:52%,78%),中位DOR未达到(95%CI:12.0,NE)。LIBRETTO-001研究更新的有效性数据(数据截止日期:2021年6月15日)显示,对于247名既往接受含铂化疗的患者,由IRC评估的ORR为61%(95%CI:55%,67%),中位DOR为28.6个月(95%CI:20%,NE),中位PFS为24.9个月(95%CI:19%,NE)。对于26名基线存在可测量CNS病灶的NSCLC患者,CNS ORR为85%(95%CI:65,96),中位CNS DOR为9.4个月(95%CI:7,15)。6个月、12个月和24个月的CNS DOR率分别为82%(95%CI:59,93)、36%(95%CI:16,56)和21%(95%CI:7,40)。既往未曾接受治疗的RET融合阳性的NSCLC对入组的LIBRETTO-001研究一个队列的39名既往未曾接受治疗的RET融合阳性NSCLC患者的有效性进行了评价(数据截止日期:2019年12月16日)。
中位年龄为61岁(范围23至86岁);56%为女性;72%为白人,18%为亚裔,8%为黑人。所有患者(100%)的ECOG体能状态为0-1分,所有患者(100%)均患有转移性疾病。92%的患者使用NGS检测出RET融合(69%为肿瘤样本;23%为血液样本);8%的患者使用FISH检测出RET融合。既往未曾接受治疗的RET融合阳性的NSCLC的有效性结果总结于表9中。表9:LIBRETTO-001研究的有效性结果(既往未曾接受治疗的RET融合阳性的转移性NSCLC)
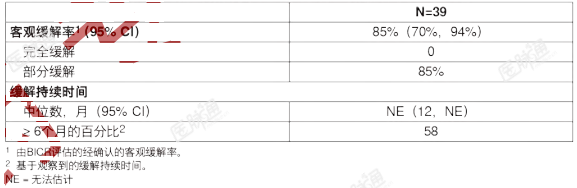
LIBRETTO-001研究更新的有效性数据(数据截止日期:2021年6月15日)显示,对于69名初治的患者,由IRC评估的ORR为84%(95%CI:73%,92%),中位DOR为20.2个月(95%CI:13%,NE),中位PFS为22.0个月(95%CI:14%,NE)。RET突变的甲状腺髓样癌:在一项多中心、开放标签、多队列临床试验(LIBRETTO-001,NCT03157128)中入组的RET突变的MTC患者中对本品的有效性进行了评价。该研究在单独的队列中入组了既往曾接受卡博替尼或凡德他尼(或两者)治疗的RET突变的晚期或转移性MTC患者,以及既往未曾接受卡博替尼和凡德他尼治疗的RET突变的晚期或转移性MTC患者。既往曾接受卡博替尼或凡德他尼治疗的RET突变的MTC对入组的LIBRETTO-001研究一个队列的55名既往曾接受卡博替尼或凡德他尼治疗的RET突变的晚期MTC患者的有效性进行了评价。中位年龄为57岁(范围:17至84);66%为男性;89%为白人,7%为西班牙裔/拉丁裔,1.8%为黑人。ECOG体能状态为0-1分(95%)或2分(5%),98%的患者患有转移性疾病。患者接受的既往系统性治疗种数的中位数为2种(范围1至8)。82%的患者使用NGS检测出RET突变状态(78%为肿瘤样本;4%为血液或血浆样本);16%的患者使用PCR,2%的患者使用未知检测方法检测出RET突变状态。研究方案排除了携带同义、移码或无义RET突变的患者;用于确定和入组患者的具体突变介绍于表10中。表10:LIBRETTO-001研究中用于确定和入组RET突变的MTC患者的突变类型
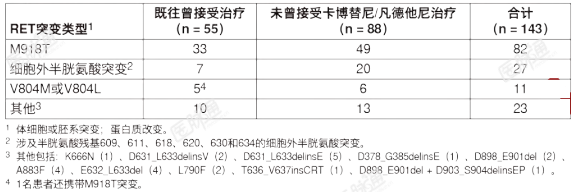
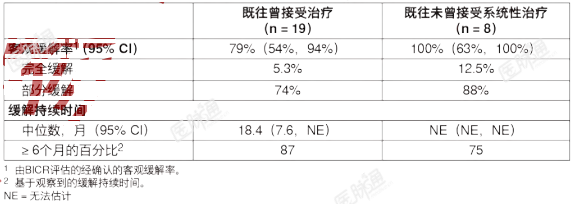
RET突变的MTC的有效性结果总结于表11中。表11:LIBRETTO-001研究的有效性结果(既往曾接受卡博替尼或凡德他尼治疗的RET突变的MTC)
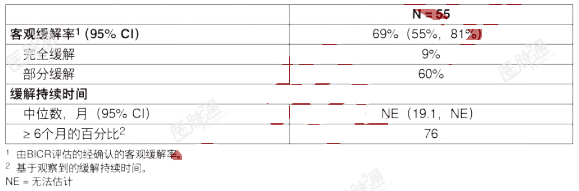
既往未曾接受卡博替尼和凡德他尼治疗的RET突变的MTC对入组LIBRETTO-001研究一个队列的88名既往未曾接受卡博替尼和凡德他尼治疗的RET突变的MTC患者的有效性进行了评价。中位年龄为58岁(范围:15至82岁),2名患者(2.3%)年龄12至16岁;66%为男性;86%为白人,4.5%为亚裔,2.3%为西班牙裔/拉丁裔。ECOG体能状态为0-1分(97%)或2分(3.4%)。所有患者(100%)均患有转移性疾病,18%既往曾接受1至2种系统性治疗(包括8%接受激酶抑制剂治疗,4.5%接受化疗,2.3%接受抗PD-1/PD-L1治疗,以及1.1%接受放射性碘治疗)。77.3%的患者使用NGS检测出RET突变状态(75.0%为肿瘤样本;2.3%为血液样本);18.2%的患者使用PCR,4.5%的患者使用未知检测方法检测出RET突变状态。用于确定和入组患者的具体突变介绍于表10中。既往未曾接受卡博替尼和凡德他尼治疗的RET突变的MTC的有效性结果总结于表12中。表12:LIBRETTO-001研究的有效性结果(既往未曾接受卡博替尼和凡德他尼治疗的RET突变的MTC)
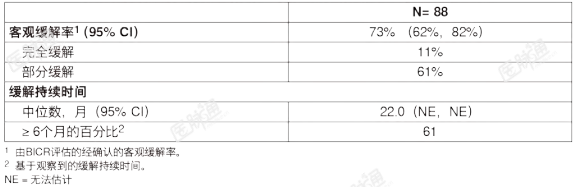
RET融合阳性甲状腺癌:在一项多中心、开放标签、多队列临床试验(LIBRETTO-001,NCT03157128)中入组的RET融合阳性的晚期甲状腺癌患者中对本品的有效性进行了评价。在单独的队列中,对27名放射性碘(RAI)治疗(如适用)难治的,且既往未曾接受系统性治疗的RET融合阳性的甲状腺癌患者,以及RAI难治的,且既往曾接受索拉菲尼、乐伐替尼或两者治疗的RET融合阳性的甲状腺癌患者的有效性进行了评价。中位年龄为54岁(范围20至88岁);52%为男性;74%为白人,11%为西班牙裔/拉丁裔,7.4%为亚裔,3.7%为黑人。ECOG体能状态为0-1分(89%)或2分(11%)。所有(100%)患者均患有转移性疾病,其原发性肿瘤组织学包括甲状腺乳头癌(78%)、低分化甲状腺癌(11%)、未分化甲状腺癌(7%)和Hürthle细胞甲状腺癌(4%)。患者接受的既往治疗种数的中位数为3种(范围1至7)。93%的患者通过NGS方法适用肿瘤样本,7%适用血液样本检测出RET融合状态。RET融合阳性的甲状腺癌的有效性结果总结于表13中。表13:LIBRETTO-001研究的有效性结果(RET融合阳性甲状腺癌)
本品为基于替代终点获得附条件批准上市,暂未获得临床终点数据,尚待上市后进一步确证
在局部晚期或转移性实体瘤患者服用本品 160 mg 每日 2 次后, 评价了本品的药代动力学。 在 20 mg 每日 1 次至 240 mg 每日 2 次 [推荐最大每日总剂量的 0.06 至 1.5 倍] 的剂量范围内, 本品稳态 AUC 和 C max 以略高于与剂量成比例的方式升高。服用本品 160 mg 每日 2 次大约 7 天后达到稳态, 其中位蓄积比为 3.4。 本品平均稳态C max 为 2,980 ng/mL(变异系数 CV%=53%), AUC 0-24h 为 51,600 ng*h/mL(CV%=58%)。吸收:本品的中位 t max 为 2 小时。 健康受试者中本品的平均绝对生物利用度为 73%(60%至82%)。食物效应:健康受试者服用高脂餐(大约 900 卡路里, 58 克碳水化合物、 56 克脂肪和 43 克蛋白质) 后, 未观察到本品 AUC 或 C max 存在具有临床意义的差异。分布:本品的表观分布容积(V ss /F) 为 191 L。本品的体外蛋白结合率为 96%, 且与浓度无关。 血液与血浆的浓度比为 0.7。消除:患者中本品的表观清除率(CL/F) 为 6 L/h, 健康受试者口服本品后, 半衰期为 32 小时。代谢:
本品主要通过 CYP3A4 代谢。 健康受试者单次口服放射性标记的本品 160 mg 后, 其原型占血浆中放射性药物浓度的 86%。排泄:健康受试者单次口服放射标记的本品 160 mg后, 69%的给药剂量在粪便中回收(14%为原型药物), 24%在尿液中回收(12%为原型药物)。特殊人群:本品的表观分布容积和清除率随着体重的增加而增加(27 kg 至 177 kg)。根据年龄(15 至 90 岁)、 性别和轻度、 中度或重度肾功能不全(eGFR ≥ 15 至 89mL/min), 未观察到本品的药代动力学存在具有临床意义的差异。 尚未对 ESRD 对本品药代动力学的影响进行研究。肝功能不全患者:与肝功能正常的受试者相比, 轻度(总胆红素小于或等于 ULN, 且 AST 大于 UNL,或总胆红素大于 1 至 1.5 倍 ULN 且伴任何 AST)、 中度(总胆红素大于 1.5 至 3 倍 ULN 且伴任何 AST) 和重度(总胆红素大于 3 至 10 倍 ULN且伴任何 AST) 肝功能不全患者中本品 AUC 0-INF 分别升高 7%、 32%和 77%。药物相互作用研究:临床试验和模型方法:质子泵抑制剂( PPI ): 空腹状态下, 本品和奥美拉唑(PPI) 联合用药时, 本品的AUC 0-INF 和 C max 降低。 进餐状态下, 本品和奥美拉唑联合用药, 本品的 AUC 0-INF 和 C max无显著性变化。(表 7)。
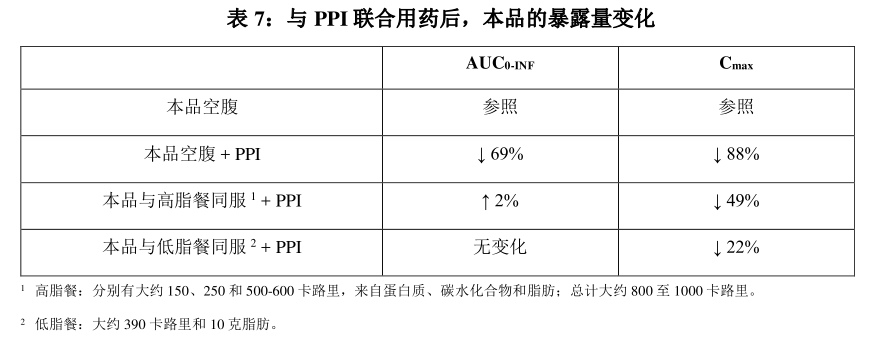
H2 受体拮抗剂: 在空腹服用本品给前 10小时至服用后 2 小时之间与雷尼替丁(H2 受体拮抗剂) 联合用药, 未观察到本品药代动力学存在具有临床意义的差异。强效 CYP3A 抑制剂: 与伊曲康唑(强效 CYP3A 抑制剂) 多次联合用药时, 本品的AUC 0-INF 增加 133%, C max 增加 30%。强效 CYP3A 诱导剂: 与利福平(强效 CYP3A 诱导剂) 多次联合用药时, 本品的AUC 0-INF 降低 87%, C max 降低 70%。中效 CYP3A 诱导剂: 与波生坦或依非韦仑(中效CYP3A诱导剂) 多次联合用药时,本品 AUC 预计会降低 40-70%, C max 降低 34-57%。弱效 CYP3A 诱导剂: 与莫达非尼(弱效 CYP3A诱导剂) 多次联合用药时, 本品 AUC预计会降低33%, C max 降低 26%。CYP2C8 底物: 与瑞格列奈(敏感 CYP2C8 底物) 联合用药时, 瑞格列奈的 AUC 0-INF增加 188%, C max 增加 91%。CYP3A 底物: 与咪达唑仑(敏感 CYP3A 底物) 联合用药时, 咪达唑仑的 AUC 0-INF 增加 54%, C max 增加 39%。P- 糖蛋白( P-gp ) 抑制剂: 与利福平(P-gp 抑制剂) 单次联合用药时, 未观察到本品药代动力学发生具有临床意义的变化。MATE1 底物: 与二甲双胍(MATE1 底物) 联合用药时, 未观察到葡萄糖水平发生具有临床意义的变化。体外研究:CYP 酶: 在临床相关浓度下, 本品并不会抑制或诱导 CYP1A2、 CYP2B6、 CYP2C9、CYP2C19 或 CYP2D6。转运蛋白系统: 在临床相关浓度下, 本品会抑制 MATE1、 P-gp 和 BCRP, 但不会抑制 OAT1、 OAT3、 OCT1、 OCT2、OATP1B1、 OATP1B3、 BSEP 和 MATE2-K。 本品可通过抑制 MATE1 降低肌酐的肾小管分泌来升高血清肌酐 。 本品是 P-gp和 BCRP 的底物, 但不是 OAT1、 OAT3、 OCT1、 OCT2、 OATP1B1、 OATP1B3、 MATE1或 MATE2-K的底物。
胶囊剂
80mg
聚氯乙烯/聚三氟氯乙烯固体药用复合硬片和药用铝箔包装。 40 mg 胶囊:14粒/盒,42粒/盒,56粒/盒,168粒/盒。80mg胶囊:14粒/盒, 28 粒/盒, 56 粒/盒, 112 粒/盒
密封,不超过30℃保存。
32833.50
24个月
国药准字HJ20220077附条件批准上市; 国药准字HJ20220078附条件批准上市

