达伯坦说明书
Pemigatinib Tablets
佩米替尼
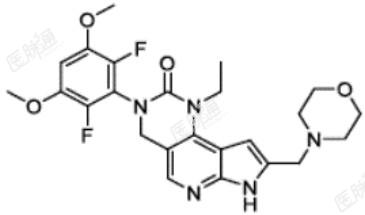
达伯坦是一种激酶抑制剂,化学名称为 3-(2,6-diflfluoro-3,5-dimethoxyphenyl)-1-ethyl-8-(morpholin-4-ylmethyl)-1,3,4,7-tetrahydro-2H-pyrrolo[3′,2′:5,6]pyrido[4,3-d]pyrimidin-2-one。达伯坦分子式为C24H27F2N5O4,分子量为487.5克/莫耳。达伯坦的化学结构如下:
达伯坦佩米替尼片为白色至类白色椭圆形片,一面刻有“I”凹印,另一面刻有"9"凹印。
适用于成人接受过全身性药物治疗、肿瘤具有FGFR2融合或重排、不可手术切除的局部晚期或转移性胆管癌,本适应症系依据客观整体反应率和反应持续期间加速核准,此适应症仍须执行确认性试验 以证明其临床效益
病人选择:选择具有FGFR2融合或重组的局部晚期或转移性胆管癌病人接受达伯坦治疗 建议剂量:达伯坦的建议剂量为13.5毫克,每日口服一次,连续服用14天,接着停药7天,整个周期为期21天。请继续接受治疗,直到疾病恶化或出现无法接受的毒性。 达伯坦可与或不与食物并服,请每天大约于同一时间服药。请整颗吞服药锭。请勿压碎、咀嚼、切开或溶解药锭。如果病人错过一剂达伯坦,超过4小时或更久的时间,或出现呕吐,请直接于下一次用药 时间服药。因不良反应调整剂量: 因不良反应而降低建议剂量的相关信息,表1、因不良反应而降低达伯坦建议剂量
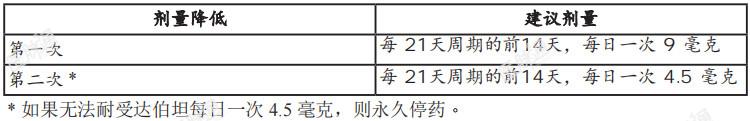
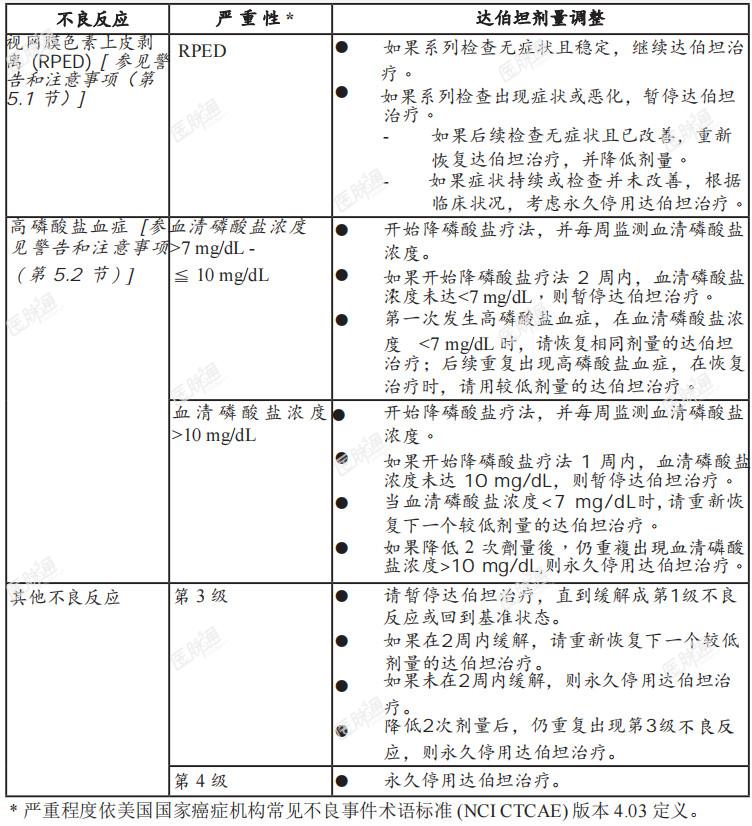
表2、因不良反应而调整达伯坦之建议剂量
并用强效或中度 CYP3A 抑制剂的剂量调整:避免达伯坦与强效或中度CYP3A抑制剂并用。如果无法避免并用强效或中度CYP3A抑制剂:请将达伯坦剂量从13.5毫克降为9毫克。请将达伯坦剂量从9毫克降为4.5毫克。如果已停止并用强效或中度CYP3A抑制剂,请提高达伯坦剂量(在CYP3A抑制剂的3次 血浆半衰期之后)至使用抑制剂之前的剂量。剂型和剂量:药锭:4.5毫克:圆形、白色至米白色的药锭,一侧中央凹刻「I」字样,另一侧则刻有数字「4.5」。9毫克:椭圆形、白色至米白色的药锭,一侧中央凹刻「I」字样,另一侧则刻有数字「9」。13.5毫克:圆形、白色至米白色的药锭,一侧中央凹刻「I」字样,另一侧则刻有数字 「13.5」。
达伯坦的建议剂量为13.5毫克,每日口服一次,连续服用14天,接着停药7天,整个周期为期21天。请继续接受治疗,直到疾病恶化或出现无法接受的毒性。
以下不良反应已于本药品说明书其他处讨论:眼睛毒性。高磷酸盐血症。临床试验经验:由于个别临床试验是分别在广泛不同的条件下执行,因此一种药物在临床试验中观察到的 不良反应发生率不能与另一种药物在临床试验中观察到的不良反应发生率,直接做比较,也可能无法反映临床实务中观察到的不良反应发生率。临床试验FIGHT-202进行达伯坦的安全性评估,此试验纳入了146名先前曾接受过治疗,患有局部晚期或转移性胆管癌的病人 [ 参见临床试验(第 14.1 节)]。这些病人口服13.5毫克达伯坦,每日一次,连续服用14天,接着停药7天,直到疾病恶化或出现无法接受的毒性为止。治疗期间的中位数为181天(范围:7至730天)。接受达伯坦治疗之病人的年龄中位数为 59 岁(范围 26-78 岁),其中 58% 为女性,71%为白人。45%接受达伯坦治疗的病人发生严重不良反应。≥2%接受达伯坦治疗的病人出现包括腹痛、发热、胆管炎、肋膜积水、急性肾损伤、感染性胆管炎、存活不良、高血钙症、低血钠症、小肠阻塞和尿道感染等严重不良反应4.1%的病人出现致命性不良反应,其中包括存活不良、胆管阻塞、胆管炎、败血症和肋膜积水。接受治疗的病人中,9% 因出现不良反应而永久停用达伯坦。≥1% 的病人因出现肠道阻塞 和急性肾脏损伤之不良反应,而需永久停用达伯坦。接受达伯坦治疗的病人中,43%因出现不良反应而中断治疗。≥1% 的病人因出现口腔炎、 肢端红肿症候群、关节痛、疲劳、腹痛、麸草醋酸转胺酶 [AST] 上升、无力、发热、麸丙 酮酸转胺酶 [ALT] 上升、胆管炎、小肠阻塞、碱性磷酸酶浓度上升、腹泻、黄疸、心电图QT昏厥、急性肾损伤、脱甲症和低血压等不良反应,而需中断达伯坦治疗。 波延长、食欲下降、脱水、高血钙症、高磷酸盐血症、低磷酸盐血症、背痛、四肢疼痛、 昏厥、急性肾损伤、脱甲症和低血压等不良反应,而需中断达伯坦治疗。接受达伯坦治疗的病人中,14%因出现不良反应而降低达伯坦剂量。≥ 1% 的病人因出现口 腔炎、关节痛、肢端红肿症候群、无力和脱甲症等不良反应,而需降低达伯坦剂量。表3总结了 FIGHT-202 中的不良反应。表4总结了 FIGHT-202中的实验室异常结果。表3、在FIGHT-202中接受达伯坦治疗病人的不良反应(≥15%)
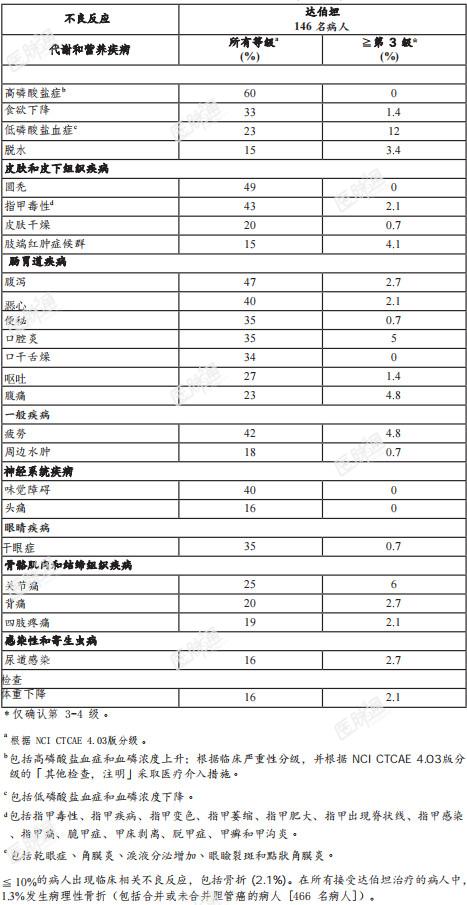
表4、较于基准值,在FIGHT-202中接受达伯坦治疗病人中,实验室异常值恶化者(≥10%)
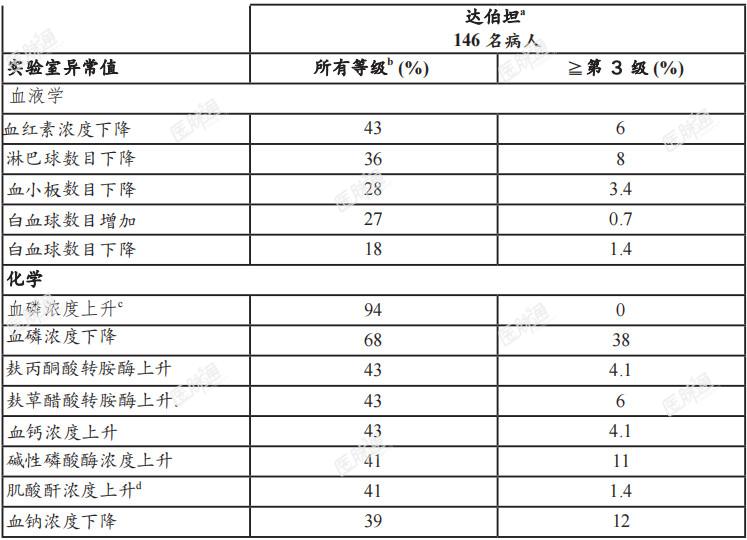
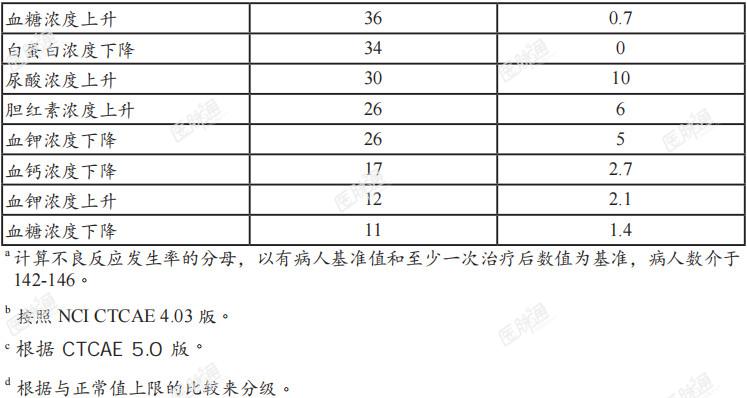
肌酸酐浓度上升:在首个为期21天的达伯坦给药周期中,血清肌酸酐浓度上升(平均值上升0.2mg/dL),于第8天达到稳定状态,然后在停药7天期间浓度下降。如果观察到血清肌酸酐浓度持续上升,请考虑监测其他肾功能指标。
无。
本药须由医师处方使用
眼睛毒性:视网膜色素上皮剥离(RPED):达伯坦可造成 RPED,进而引起例如视线模糊、飞蚊症或闪光等症状。达伯坦的临床试验并 未例行性使用包括干涉光视网膜断层扫描仪 (OCT) 等来监测无症状的 RPED。因此,达伯 坦引起之无症状 RPED 的发生率,目前尚不可知。 纳入466名病人的达伯坦跨临床试验显示,6%的病人出现RPED,其中包括0.6%的第3-4级RPED。第一次出现RPED的中位数时间为 62天。RPED导致1.7%的病人中断达伯坦治 疗,并分别导致0.4%的病人调整达伯坦剂量和0.4%的病人永久停用达伯坦治疗。因RPED而需要调整达伯坦剂量的病人中,87.5%的RPED已得到缓解或改善至不良反应第1级。开始达伯坦治疗之前,以及开始治疗前6个月内的每2个月,和其后治疗期间的每3个月, 请进行完整眼科检查(包括OCT)。如果出现视觉症状,请紧急转介病人接受眼科评估, 症状缓解或停止达伯坦治疗之前,每3周追踪一次。请按建议调整剂量或永久停止达伯坦治疗。干眼症:纳入466名病人的达伯坦跨临床试验显示,27%的病人出现干眼症,其中包括0.6%的病人出现第3-4级干眼症。请按需要使用眼用缓和剂治疗病人。高磷酸盐血症:磷酸盐浓度增加为 达伯坦 的药效学作用。包含466名病人 的达伯坦跨临床试验显示,92%的病人出现高磷酸盐血症(实验室数值高于正常值上限)。出现高磷酸盐血症的中位数时间为8天(范围为1-169天)。接受达伯坦治疗的病人中,有29%需要进行降磷酸盐疗法。当血清磷酸盐浓度>5.5mg/dL时监测高磷酸盐血症,并开始低磷酸盐饮食。针对血清磷酸 盐浓度>7mg/dL,请根据高磷酸盐血症的时间长短和严重程度,开始降磷酸盐疗法并暂停、降低剂量或永久停用达伯坦。胚胎-胎儿毒性:在胎儿器官形成期间口服达伯坦,当大鼠母体曝露量低于人体于临床建议剂量13.5毫克的 检查曝露量[ 根据曲线下面积 (AUC)] 即会造成胚胎畸形、胚胎生长迟缓,及胚胎-胎儿死亡。 体重下降 请告知怀孕女性病人,本品对胚胎有潜在风险。请告知具生育能力的女性病人,在接受达 * 仅确认第3-4级。伯坦治疗期间以及接受完最后一剂后1周内,使用有效的避孕措施;男性病人的女性伴侣 若具有生育能力,在接受达伯坦治疗期间以及接受完最后一剂后1周内,使用有效的避孕措施
临床试验中尚未报告过药物过量病例。若出现药物过量,应密切监测患者是否出现不良反应的症状或体征,并立即给予适当的对症治疗。
怀孕:风险总结:根据动物试验的结果和其作用机转,怀孕女性接受达伯坦治疗可造成胚胎损伤或流产。目前尚无怀孕女性接受达伯坦治疗的资料。怀孕大鼠在胎儿器官形成期间口服达伯坦,当大鼠母体血浆曝露量低于人体临床剂量13.5毫克之曝露量,即会造成胚胎畸形、胚胎生长迟缓和胚胎-胎儿死亡(参见资料)。请告知怀孕女性,达伯坦对胚胎具有潜在风险。在美国总人口经临床确认的怀孕事件中,发生重大出生缺陷与流产的背景估计风险分别为2-4%和15-20%。资料:动物资料在胎儿器官形成期间,怀孕大鼠每日一次口服达伯坦会造成100%胚胎死亡,因为当剂量 ≥0.3毫克/公斤即可造成着床后流产(约为临床剂量13.5毫克AUC曝露量的0.6倍)。每日0.1毫克/公斤的剂量,不会影响胎儿存活率;但是,每日一次口服给予0.1毫克/公斤达伯坦(约为临床剂量13.5毫克AUC曝露量的0.2倍),会造成胎儿平均体重下降,增加胎儿骨骼与内脏畸形、重大血管变异,以及骨质减少。哺乳:风险总结:目前尚无达伯坦或其代谢物在人类乳汁,或对哺乳儿童或乳汁分泌影响的资料。由于达伯坦可能对哺乳儿童造成严重不良反应,请劝告女性在治疗期间以及接受完最后一剂后1周内勿哺乳。具生殖能力的女性和男性:怀孕检测:开始达伯坦治疗之前,请先确认具生殖能力女性病人是否怀孕[参见特殊族群的使用(第8.1节)]。避孕:怀孕女性接受达伯坦治疗,可造成胎儿损害[参见特殊族群的使用(第8.1节)]。女性:请劝告具生殖能力的女性病人,在达伯坦治疗期间以及接受完最后一剂后1周内,使用有效的避孕措施。男性:男性病人的女性伴侣若具有生育能力,在达伯坦治疗期间以及接受完最后一剂后1周内,使用有效的避孕措施。儿童使用达伯坦治疗的安全性和疗效尚未建立。动物毒性资料:在针对大鼠和非人类灵长类的4或13周重复剂量毒理学试验中,动物在达伯坦曝露量低于临床剂量13.5毫克的人体曝露量时,会出现骨骼和牙齿的毒性,包括多处骨骼出现生长板和软骨发育不良,大鼠出现牙齿(门齿)异常(完全失去釉质母细胞且伴随继发性变化)。停药6周后,这些异常并未出现复原的完整证据,而且在13周的试验中还出现其他牙齿相关异常(齿列不整、门齿白化、断裂,和削减/变薄)。在FIGHT-202中,32%病人年满65岁或以上,8%病人年满75岁或以上。这些病人的安全性或疗效与年轻病人相比,并无整体性差异。肾功能不全:对于患有轻度或中度肾功能不全的病人,建议不必调整剂量(以肾脏疾病的饮食调整方程式 (MDRD) 估计的肾丝球过滤率(GFR)≥30至<90毫升/分钟)。重度肾功能不全(GFR<30毫升/分钟)病人尚未建立达伯坦的建议剂量[参见临床药理学。 肝功能不全:对于患有轻度(总胆红素 > 正常值上限 (ULN) 至1.5倍ULN或 AST > ULN)或中度肝功能不全(总胆红素 >1.5-3倍ULN合并任何AST值)的病人,建议不必调整剂量。重度肝功能不全(总胆红素》3倍ULN合并任何AST值)的病人尚未建立达伯坦的建议剂量
其他药物对达伯坦的影响:强效和中度CYP3A诱导剂:达伯坦并用强效或中度CYP3A诱导剂,会降低血浆中的达伯坦浓度,可能会降低达伯坦的疗效。请避免并用达伯坦与强效或中度CYP3A诱导剂。强效和中度CYP3A抑制剂:达伯坦并用强效或中度CYP3A抑制剂,会增加血浆中的达伯坦浓度,可能会增加不良反应的发生率和严重程度。如果无法避免与强效或中度CYP3A抑制剂并用,请降低达伯坦剂量
Lonza Tampa LLC
86984133000024;86984133000017
佩米替尼是靶向成纤维细胞生长因子受体(FGFR) 1、2、3的小分子激酶抑制剂,IC50值低于2nM。在体外佩米替尼也可抑制FGFR4,但抑制浓度约高于对FGFR1、2、3抑制浓度的100倍。佩米替尼可抑制FGFR1-3磷酸化和信号通路,降低携带有可致FGFR信号通路组成性活化的FGFR扩增与融合改变的肿瘤细胞株活性。FGFR信号通路的组成性活化可支持恶性细胞的增殖和存活。在携带可致FGFR组成性活化的FGFR1、FGFR2或FGFR3变异的人肿瘤细胞株的小鼠异种移植模型中,佩米替尼可见抗肿瘤活性,包括来自胆管癌患者的表达致癌性FGFR2-TRA2b(FGFR2- Transformer-2 beta homolog)融合蛋白的肿瘤细胞异种移植瘤模型。
遗传毒性:佩米替尼Ames试验、体外染色体畸变试验、大鼠体内微核试验结果均为阴性。生殖毒性:尚未开展佩米替尼生育力试验、围产期毒性试验。大鼠、非人灵长类动物经口给予佩米替尼,未见可能导致雌雄生育力损害的剂量相关性毒性。妊娠大鼠于器官发生期每日经口给予佩米替尼,给药剂量≥0.3 mg/kg/天(按AUC计,约为临床剂量13.5mg暴露量的0.6倍)时,可见因着床后丢失导致的胚胎/胎仔全部死亡;给药剂量为0.1 mg/kg/天(按AUC计,约为临床剂量13.5mg暴露量的0.2倍)时,未见影响胎仔存活,但是可致平均胎仔重量降低,胎仔骨骼和内脏异常、大血管变异增加,胎仔骨化降低。致癌性:尚未开展佩米替尼致癌性研究。其他毒性:在大鼠和非人灵长类动物的4周或13周重复给药毒性试验中,当低于临床剂量13.5mg暴露量时,可见动物骨骼和牙齿毒性。两种动物种属的多处骨骼可见骨骺和软骨发育不良,大鼠可见牙齿(门牙)异常(成釉细胞完全缺失且有继发性变化)。停药6周后,以上毒性未完全恢复,且在13周试验中还可见其他牙齿相关异常(门齿不齐整、白化、断裂和消减/变薄)
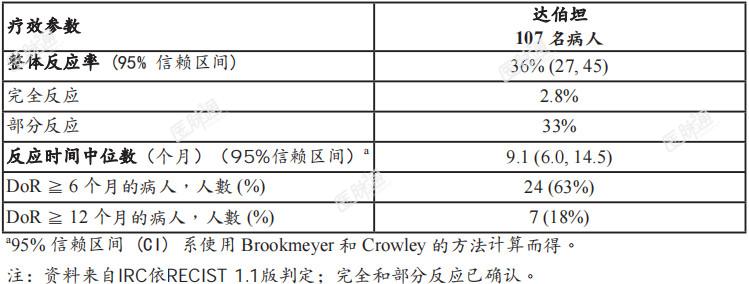
胆管癌:FIGHT-202(NCT02924376) 是一项多中心、开放性、单一组别试验,评估达伯坦对107名病人的疗效;试验病人有局部晚期、无法切除或转移性胆管癌,经至少1线治疗药物治疗后,疾病发生恶化,并在中央实验室进行之临床试验测定已确定患有FGFR2基因融合或非融合重组。符合框内基因融合与其他基因重组者,预期在 FGFR2基因内含子17/外显子18处 会发生断裂点,而 FGFR2 激酶区会保持完整。接受达伯坦21天周期治疗的病人,每日口服一次13.5毫克,连续14天,接着停药7天。持续服用达伯坦,直到疾病恶化或出现无法接受的毒性为止。主要疗效结果测量方法为整体反应率 (ORR) 和反应时间 (DoR),是由独立审查委员会 (IRC) 根据RECIST版本1.1所判定。 试验病人的年龄中位数为56 岁(范围:26 至 77 岁);其中 61% 为女性,74% 为白人,而且有 95% 的病人其美国东岸癌症临床研究合作组织 (ECOG) 体能状态基准期为0分 (42%)或1分 (53%)。98%的病人患有肝内胆管癌。86% 的病人有FGFR2框内基因融合,最常见的FGFR2融合为FGFR2-BICC1 (34%)。14%的病人有其他FGFR2重组,此类基因重组无法可靠地预测是框内融合,包括无可辨识共伴基因的基因重组。所有病人曾接受过至少1次前1线全身性治疗,其中 27% 曾接受过先前 2 线治疗药物,12%曾接受过先前3线或以上的治疗药物。96%的病人曾接受过含铂药物治疗,其中 76% 曾接受过 gemcitabine/cisplatin。疗效结果总结于表 5。 反应时间的中位数为2.7个月(范围0.7-6.9个月)。表 5、FIGHT-202 的疗效结果
佩米替尼13.5 mg每日一次口服给药后,其AUCo.24h的稳态几何平均值为2620nM:h (变异系数: 54%), Cmax 为236 nM (变异系数: 56%)。 在1~20 mg的范围内(推荐剂量的0.07~1.5倍),佩米替尼稳态浓度随剂量增加而成比例上升。每日- .次重复给药可于4天内达到稳态。每日一次重复给药,佩米替尼在体内蓄积,中位蓄积比为1.63 (范围0.63 ~3.28)。吸收:佩米替尼血浆浓度中位达峰时间(Tmax) 为1.13 (0.50~6.00)小时。食物影响:佩米替尼伴随高脂和高热量饮食1000卡路里,其中150卡路里来自蛋白质、250卡路里来自碳水化合物、500~600卡路里来自脂肪)给药对佩米替尼药代动力学无具有临床意义的影响。分布:口服13.5 mg剂量后,表观分布容积为235L (60.8%)。 体外试验中,佩米替尼的血浆蛋白结合率为90.6%,与浓度无关。消除:佩米替尼消除半衰期(t1/2) 几何均值为15.4h (变异系数: 51.6%), 表观清除率(CL/F)的几何均值为10.6L/h (变异系数:54%)。代谢:体外研究表明,佩米替尼主要通过CYP3A4代谢。血浆中的主要药物相关成分为佩米替尼原型。排泄单次口服11 mg放射性标记的佩米替尼后,82.4%的剂量由粪便排出(1.4%为原型药物),12.6%的剂量 由尿液排出( 1%为原型药物)。特殊人群:未发现年龄(21~79岁)、性别、人种/种族(68.2%白人、16%亚裔、6.3%黑人、6%西班牙裔、3.5%其他)或体重(39.8-156 kg)对佩米替尼的全身暴露量具有临床意义的影响。佩米替尼在中国晚期恶性肿瘤患者的稳态暴露参数(Cmxss,AUSS,0-24)与西方受试者未见明显差异。肾功能不全患者:在轻度至中度肾功能不全(eGFR 30~89 mL/min, MDRD)或接受间歇性血液透析的终末期肾病(eGFR < 15 mL/min/1.73m2)患者中,未观察到佩米替尼全身暴露量存在有临床意,义的差异。与肾功能正常患者相比,重度肾功能不全( eGFR15~29 mL/min/1.73 m2)患者的佩米替尼AUCo in几何均值增加59%。肝功能不全患者:在轻度( 总胆红素> ULN至 1.5xULN或AST>ULN)至中度(总胆红素>1.5~3xULN,伴任何AST)肝功能不全患者中,未观察到佩米替尼全身暴露量存在有临床意义的差异。与肝功能正常的患者相比,重度肝功能不全(总胆红素>3xULN,伴任何AST)患者的佩米替尼AUCo.inf几何均值增加136%。
片剂
药锭有4.5毫克、9毫克和13.5毫克三种剂量。
达伯坦药锭有以下剂型:4.5毫克:圆形、白色至米白色的药锭,一侧中央凹刻「I」字样,另一侧则刻有数字「4.5」,14锭装于密封之 Aclar/PVC 泡壳胶膜 (Blister Film) 并置于盒中。 ●9毫克:椭圆形、白色至米白色的药锭,一侧中央凹刻「I」字样,另一侧则刻有数字「9」,14锭装于密封之 Aclar/PVC 泡壳胶膜 (Blister Film) 并置于盒中。 ●13.5毫克:圆形、白色至米白色的药锭,一侧中央凹刻「I」字样,另一侧则刻有数字「13.5」,14锭装于密封之 Aclar/PVC 泡壳胶膜 (Blister Film) 并置于盒中。
将达伯坦药锭储存于25℃以下。
56562.00;33271.80
36个月
国药准字HJ20220028;国药准字HJ20220027