易甘泰说明书
Yttium-90 Microsphere Injection
SIR-Spheres Y-90树脂微球(钇[90Y]微球)
本品为不透明混悬液。
钇[9Y]微球注射液适用于经标准治疗失败的不可手术切除的结直肠癌肝转移患者。
治疗技术得当,对任何器官无过度辐射时,患者在接受钇[9Y]微球注射液治疗后的常见不良反应为发热、血红蛋白- -过性下降、肝功能检查(Liver FunctionTest,LFT)轻度至中度。异常(天门冬氨酸氨基转移酶、碱性磷酸酶、胆红素轻度升高)、腹痛、恶心、呕吐和腹泻。高剂量辐射引起的潜在严重不良反应:急性胰腺炎:引起急性剧烈腹痛。通过腹部SPECT扫描(测量钇[90Y]轫致辐射)与血清,淀粉酶检测确认。放射性肺炎:引起过度干咳。通过肺炎的X射线证据确认。急性胃炎:引起腹痛。通过诊断胃溃疡的标准方法确认。急性胆囊炎:引起明显上腹部疼痛,可能需要切除胆囊缓解。通过适当的影像检查进行确认。放射栓塞性肝病(Radiation embolic liver disease, REILD):REILD是接受钇[°Y]微球注射液治疗后的罕见并发症。REILD在发病时间、临床表现、生物化学和组织病理学特征上都有明显特点。它通常发生于钇[90Y ]微球注射液治疗后约4~8周,在无肿瘤进展或胆管阻塞的情况下表现为黄疸和腹水。REILD典型生化特征是几乎在所有情况下胆红素升高(>3 mg/d1),在大多数情况下碱性
磷酸酶和γ -谷氨酰基转肽酶升高,转氨酶(天门冬氨酸氨基转移酶和丙氨酸氨基转移酶)几乎没有变化。在进行肝脏活检时,典型的组织学特点是肝窦阻塞,可能与静脉闭塞性疾病类似。非肝硬化患者和肝硬化患者均可能发生REILD。从钇[°Y]微球注射液手术当天开始用甲基强的松龙和熊去氧胆酸进行预防性治疗,持续两个月可以降低REILD的发生率。在REILD治疗中,也可考虑使用低分子量肝素,但皮质类固醇和肝素可能只在疾病治疗进程早期有用。
钇[°0Y]微球注射液禁止用于以下患者:肝脏曾接受外照射治疗;腹水或肝脏衰竭;肝功能检查明显异常,如总胆红素>2.0 mg/dl或白蛋白<3.0 g/dl;通过9Tc-MAA扫描判定肝动脉血流的肺分流超过20%;或肺部辐射剂量超过30 Gy;血管造影显示血管解剖结构异常,可能导致肝动脉血液明显回流至胃、胰腺或肠道;弥漫性肝外恶性疾病;在本品治疗前两个月内曾接受卡培他滨治疗,或在本品治疗之后的任意时间计划接受卡培他滨治疗;门静脉栓塞。
1、由于本品的放射性以及微球植入不当会产生严重的后果,处理和操作本品的医生必须进行充分的产品培训。2、Sirtex建议,可在植入本品后立即对上腹部进行SPECT扫描,通过检测钇Z[0Y ]产生的轫致辐射显示本品在肝脏内的分布。3、本品具有放射性。所有处理、分装和植入此产品的人员必须熟悉并遵守所有相关地方和国家监管要求。在操作核素和治疗患者时,应采用公认的辐射防护技术来保护工作人员。4、部分患者在治疗后可能出现胃部不适,可在植入本品前一日使用H-2阻滞剂,并根据需要继续使用以减少胃部并发症。5、植入本品后,许多患者可能会出现急性腹痛,且可能需要治疗以缓解疼痛。6、动物模型皮肤测试表明本品存在轻微致敏性。7、钇[°Y]微球注射液的非靶向输送,若将本品意外输送至肝外,例如食道、胃、十二指肠、胆囊或胰腺,可能导致这些器官的组织辐射损伤。必须采用精确的血管造影,以防止将本品非靶向输送至任何肝外组织。8、向正常肝实质输送过量的钇[°Y ]微球注射液可能导致放射栓塞性肝病(REILD)。既往有肝病的患者发生REILD的风险可能增加。在以下临床情况中,应考虑减少预期使用的钇[°Y]微球注射液活度:a、由肝脂肪变性、脂肪性肝炎、肝炎或肝硬化引起的肝功能储备减少;b)基线胆红素水平升高;c)肿瘤负荷小(肝脏受累<5%);d)肝脏体积小(<1.5L);e)既往肝切除手术;f)既往肝脏导向治疗;g)既往进行了大量的全身化疗和/或生物治疗。9、放射性肺炎高剂量辐射和/或过度的分流至肺部可能引起放射性肺炎。单次治疗肺部辐射剂量不得超过30 Gy。10、辐射安全应参照培训手册,并遵守《放射性同位素与射线装置安全防护条例》。以下是操作人员不同部位暴露剂量(热释光剂量计TLD测定)。
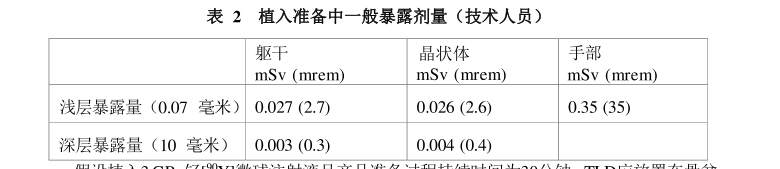
假设植入3 GBq钇[°Y]微球注射液且产品准备过程持续时间为30分钟。TLD应放置在骨盆
附近、别在衬衫领上或戴在工作手指上。
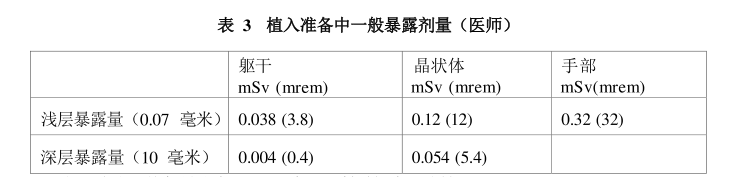
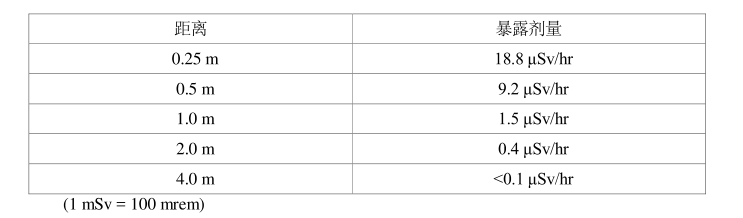
假设患者平均剂量约为2 GBq,产品注射时间为20分钟。植入后暴露剂量:植入平均2.1 GBq后约5-6小时,患者腹部的不同距离处所测得的暴露值;
11、输送装置本品输送套件中含增塑剂DEHP、TOTM①动物实验表明DEHP具有-定的不良反应,特别是对男性生殖系统和精子发育有不良影响,虽然到现在为止尚未有对人不良反应的报告,但也没有排除对人无不良反应的研究证据;②本产品不宜贮存和输注脂肪乳等脂溶性液体和药物;③新生儿、青春期前的男性、怀孕期和哺乳期的妇女不宜使用本产品输注药物。
尚未研究尚未研究
Sirtex Medical Pty Ltd
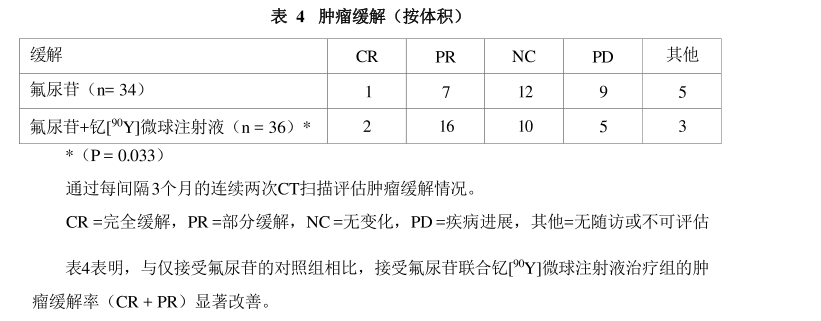
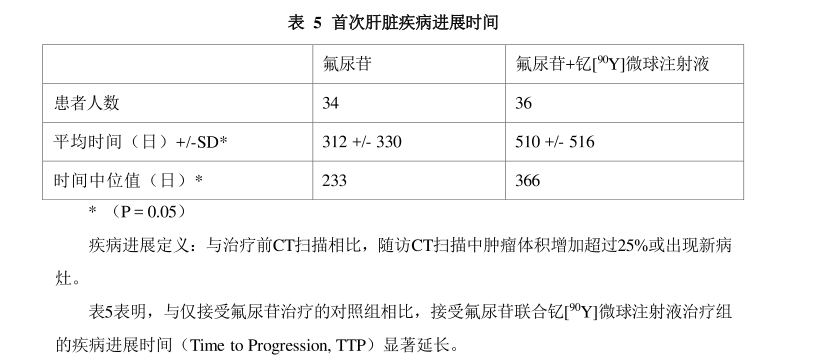
上市前关键III期研究CRI9101 (研究1)及上市后三项前瞻性国际多中心随机对照研究的Meta分析(研究2)证实了钇[90Y ]微球注射液选择性内放射治疗对不可手术切除的结直肠癌肝转移患者局部治疗的有效性。研究1:关键研究CRI 9101是一项前瞻性、多中心、随机对照研究,旨在评估与单纯氟尿苷(FUDR)肝动脉灌注化疗(HAC)相比,单次钇[9Y]微球注射液联合相同药物肝动脉化疗是否增加患者受益。共有70例受试者接受治疗,其中34例受试者接受了氟尿苷肝动脉灌注化疗(对照组),36例受试者接受了氟尿苷肝动脉灌注化疗联合钇[9Y]微球注射液治疗。受试者WHO状态评分0-1,均为不可切除的原发性大肠腺癌双叶肝转移,无论既往是否接受化疗。结果如下表所示:
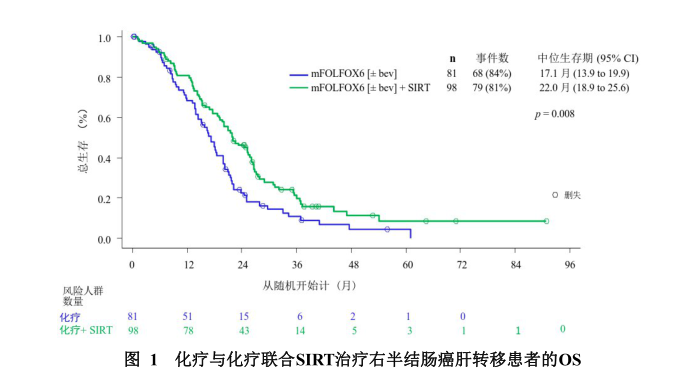
研究2.选择性内放射治疗联合化疗对比单独化疗-线治疗结直肠癌肝转移的三项(FOXFIRE、SIRFLOX和FOXFIRE Global)随机对照、国际多中心II期临床研究的Meta分析,主要终点是意向性治疗人群的总生存期。共纳入1 103例(FOXFIRE364例, SIRFLOX 530例, FOXFIREGlobal 209例)既往未接受化疗的、不适合根治性切除术或消融术的结直肠癌肝转移患者,其中554例接受内放射治疗联合化疗,549例仅接受化疗。入选标准包括经组织学确认的肝脏为主或仅发生肝转移的结直肠癌伴或不伴原发性肿瘤、局限性肝外转移灶、WHO体力状态评分0-1、预期生存期≥3个月。在FOXFIRE研究中,受试者接受全身OxMdG化疗,在SIRFLOX和FOXFIRE GLOBLE研究中,受试者接受mFOL ,FOX6化疗。在治疗方案中是否添加贝伐珠单抗西妥昔单抗由研究者决定,SIRT在第1周期或第2周期化疗时进行。中位随访时间为43.3月。两组中化疗周期中位数为12。人群特征:男性受试者占65%,中位年龄为63.0岁(IQRc:23.1-89.6岁)。约65%的受试者出现肝外转移。约68%的受试者肝脏受累程度≤25%,32%的受试者肝脏受累程度>25%。54%的受试者有意向接受生物制剂(贝伐珠单抗/西妥昔单抗)的治疗。两组受试者基线期肿瘤与人口学特征均一性良好。联合治疗组和单独化疗组的ORR为72.2% vs 63% (p=0.0012)。联合治疗组肝特异性PFS。在第12个月随访时显著优于单独化疗组,两组累计进展发生率分别为39%和22%(HR=0.51,95%CI 0.43-0.62; p<0.0001)。对179例右半结肠癌肝转移患者进行亚组分析发现,钇[9y]微球注射液联合化疗可以显著延长右半结肠癌肝转移患者的生存期(22.0月 vs 17.1月,p=0.008)。
3 GBq土10%(在校准时间)
中硼硅玻璃模制注射剂瓶、注射液和注射用无菌粉末用氯化丁基橡胶塞(配方 FM140)装。 每个铅屏蔽容器放置1瓶。
置铅容器内,密闭保存。容器表面辐射水平应符合规定。
自校准时间起24小时。

