科赛拉说明书
Trilaciclib Hydrochloride for Injection
盐酸曲拉西利
本品的活性成份为盐酸曲拉西利。化学名称:2'-{[5(4-甲基哌嗪-1-基)吡啶-2-基]氨基}-7',8'-二氢-6'H-螺[环己烷-1,9'-吡嗪并[1',2':1,5]吡咯并[2,3-d]嘧啶]-6'-酮二盐酸盐。化学结构式:
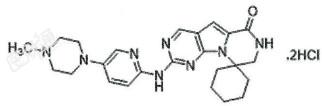
分子式:C24H30N8O·2HCI
分子量:519.48
辅料:甘露醇、一水柠檬酸、氢氧化钠、盐酸
本品适用于既往未接受过系统性化疗的广泛期小细胞肺癌患者,在接受含铂类药物联合依托泊苷方案治疗前预防性给药,以降低化疗引起的骨髓抑制的发生率。本品基于境外数据及中国研究早期临床试验数据获得附条件批准上市,治疗中国患者的有效性和安全性尚待上市后进一步确证。
推荐剂量:曲拉西利的建议剂量为240mg/m2,在当日化疗给药前4小时内经静脉(IV)滴注30分钟完成。连续多日给予曲拉西利时,两次给药的间隔时间应不超过28小时。用法:在化疗前4小时内,静脉滴注30分钟给予稀释后的曲拉西利溶液;稀释后的曲拉西利溶液必须使用包含过滤器(0.2或0.22μm)的输液装置给药。相容的在线过滤器材质包括聚乙烯砜、聚偏氟乙烯以及醋酸纤维素;请勿将稀释的曲拉西利溶液与聚四氟乙烯(PTFE)过滤器一起使用。PTFE过滤器与稀释的曲拉西利溶液不相容;请勿使用同一输液管同时给予其他药物;请勿通过中心静脉装置同时给予其他药物,除非该装置支持不相容的药物同时给药;稀释后的曲拉西利溶液滴注结束后,必须使用至少20mL无菌的0.9%氯化钠注射液或5%葡萄糖注射液冲洗输液管/套管。错过治疗:如果错过曲拉西利给药,请在错过曲拉西利给药的当日停止化疗。在治疗计划的下一个化疗日,同时恢复曲拉西利给药和化疗。终止治疗:如果停用曲拉西利,恢复化疗需要在停用曲拉西利96小时后进行。因不良反应进行剂量调整:
因不良反应需要暂停、终止或者改变曲拉西利给药方法,请参照表1。表1:针对不良反应的建议措施


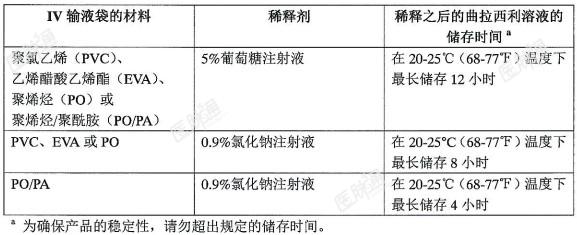
制备和用法:在静脉滴注之前曲拉西利复溶和稀释方法如下。使用无菌技术进行复溶和稀释。在复溶后和给药前只要溶液和各容器允许观察,若目视检查药物存在颗粒物和褪色,请勿使用。曲拉西利的复溶:根据患者的体表面积(BSA)计算曲拉西利的剂量、复溶曲拉西利所需溶液的总体积和所需曲拉西利的瓶数;使用19.5mL的0.9%氯化钠注射液或5%葡萄糖注射液通过无菌注射器复溶每瓶300mg的药物,得到15mg/mL的曲拉西利溶液;轻轻旋转不超过3分钟,直至无菌冻干块状物完全溶解,请勿摇晃;检查配制好的溶液是否有褪色或存在颗粒物。复溶后的曲拉西利溶液应为澄清的黄色溶液。如果配制好的溶液褪色、浑浊或含有肉眼可见的颗粒物,请勿使用;如需要,未使用的复溶溶液在转移到输液袋前可在20-25℃(68-77℉)下储存不超过4小时。请勿冷藏或冷冻;任何未用完部分应丢弃。复溶后曲拉西利溶液的稀释:从药瓶中抽取所需体积的复溶后的曲拉西利溶液,并转移至含有0.9%氯化钠注射液或5%葡萄糖注射液的静脉输液袋中,进行稀释;稀释后的曲拉西利溶液的浓度应在0.5mg/mL和3.0mg/mL之间;缓慢翻转混合稀释的溶液,请勿摇晃;供滴注使用的曲拉西利稀释溶液为澄清的黄色溶液;如果不立即使用,请按照表2所示将稀释的曲拉西利溶液存放在静脉输液袋中,如果储存时间超过此范围,应当丢弃。禁止冷藏或冷冻。表2:稀释后曲拉西利溶液的储存条件
在化疗前4小时内,静脉滴注30分钟给予稀释后的曲拉西利溶液;稀释后的曲拉西利溶液必须使用包含过滤器(0.2或0.22μm)的输液装置给药。相容的在线过滤器材质包括聚乙烯砜、聚偏氟乙烯以及醋酸纤维素;请勿将稀释的曲拉西利溶液与聚四氟乙烯(PTFE)过滤器一起使用。PTFE过滤器与稀释的曲拉西利溶液不相容;请勿使用同一输液管同时给予其他药物;请勿通过中心静脉装置同时给予其他药物,除非该装置支持不相容的药物同时给药;稀释后的曲拉西利溶液滴注结束后,必须使用至少20mL无菌的0.9%氯化钠注射液或5%葡萄糖注射液冲洗输液管/套管。
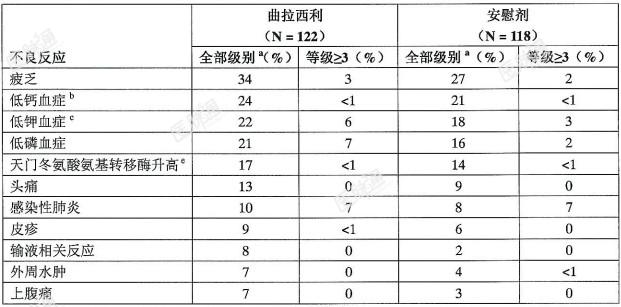
下列有临床意义的不良反应将在此说明书的其它部分中描述:注射部位反应,包括静脉炎及血栓性静脉炎;急性药物超敏反应;间质性肺病/肺部炎症。临床试验结果:由于临床试验是在不同情况下进行的,因此一个药物临床试验中观察到的不良反应发生率不能与另一种药物临床试验的不良反应发生率直接比较,也不能预测这种药物在临床实践中的不良反应发生率。在境外研究中评估了曲拉西利的安全性。化疗当日,患者于化疗前经30分钟静脉滴注曲拉西利240mg/m2。在本章节中描述的数据反映了在3项随机、双盲、安慰剂对照的试验中接受治疗的240例广泛期小细胞肺癌(ES-SCLC)患者(曲拉西利组122例,安慰剂组118例)的安全性。整合安全性分析:在表3中列出的不良反应概要是来自境外3项广泛期小细胞肺癌研究的汇总的安全性结果。包括在合并集中的患者是接受至少1剂曲拉西利(122例)或安慰剂(118例)的随机分组患者。71%的接受曲拉西利治疗的患者以及78%的接受安慰剂治疗的患者完成了至少4个治疗周期。接受曲拉西利和安慰剂治疗的患者,中位治疗持续时间相同(4个周期)。在接受曲拉西利治疗的患者中,有30%出现严重的不良反应。在接受曲拉西利治疗的患者中,超过3%的患者报告的严重不良反应包括:呼吸衰竭、出血和血栓形成。在接受曲拉西利治疗的患者中,有9%因不良反应而永久停药。导致接受曲拉西利治疗的患者永久终止任何研究治疗的不良反应包括:感染性肺炎(2%)、乏力(2%)、注射部位反应、血小板减少症、脑血管意外、缺血性中风、输液相关反应、呼吸衰竭和肌炎(每一种均<1%)。曲拉西利治疗组中有5%的患者出现致命性不良反应,包括:感染性肺炎(2%)、呼吸衰竭(2%)、急性呼吸衰竭(<1%)、咯血(<1%)和脑血管意外(<1%)。在接受曲拉西利治疗的患者中,有4.1%因不良反应而中断输液。最常见的不良反应(≥10%)包括:疲劳、低钙血症、低钾血症、低磷血症、天门冬氨酸氨基转移酶升高、头痛和感染性肺炎。在接受曲拉西利治疗的患者中,最常报道的≥3级不良反应(≥5%)发生率,与接受安慰剂治疗的患者相同或更高的是低磷血症。如表3列出了曲拉西利治疗组中发生率不低于5%且比安慰剂组患者高至少2%的不良反应。表3:曲拉西利治疗组中≥5%的SCLC患者中出现的不良反应(且曲拉西利组发生率比安慰剂组高≥2%)
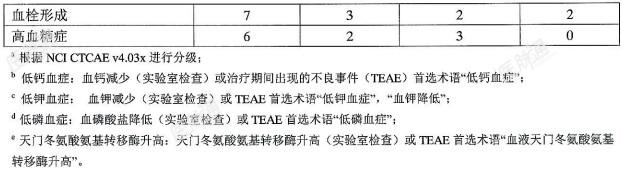
接受曲拉西利和安慰剂治疗的患者发生的3/4级血液学不良反应包括:中性粒细胞减少症(分别是32%和69%)、发热性中性粒细胞减少症(分别是3%和9%)、贫血(分别是16%和34%)、血小板减少症(分别是18%和33%)、白细胞减少症(分别是4%和17%)和淋巴细胞减少症(分别是<1%和<1%)。
该产品禁用于对曲拉西利有严重超敏反应的患者,包括速发严重过敏反应
注射部位反应,包括静脉炎及血栓性静脉炎:曲拉西利给药可引起注射部位反应,包括静脉炎及血栓性静脉炎。在临床试验经曲拉西利治疗的272例患者中,有56例患者(21%)出现了包括静脉炎和血栓性静脉炎在内的注射部位反应,其中包括2级(10%)和3级(0.4%)不良反应。从开始给药到出现反应的中位时间为15天(范围1-542天),距离上次给药的中位时间为1天(1-15天),中位持续时间为1天(已缓解患者中的时间范围为1-151天)。56例患者中的49例(88%)患者,其注射部位反应(包括静脉炎和血栓性静脉炎)出现缓解,272例患者中有3例(1%)患者因此终止治疗。注意监测患者注射部位反应,静脉炎和血栓性静脉炎的症状,包括输液过程中出现的注射部位疼痛和红斑。对于轻度(1级)至中度(2级)的注射部位反应,输液结束后,用至少20mL无菌0.9%氯化钠注射液或5%葡萄糖注射液冲洗输液管道/插管。如果发生严重(3级)或危及生命(4级)的注射部位反应,应停止滴注,并永久停用曲拉西利。急性药物超敏反应:使用曲拉西利可引起急性药物超敏反应,包括面部浮肿和荨麻疹。在临床试验接受曲拉西利治疗的272例患者中,有16例患者(6%)出现了急性药物超敏反应,包括2级反应(2%)。1例患者在接受曲拉西利治疗的4天后发生了2级速发严重过敏反应,在使用肾上腺素后缓解,并继续进行曲拉西利的治疗。从开始曲拉西利给药至发作开始的中位时间为77天(2-256天),距离上次给药的中位时间为1天(1-28天),中位持续时间为6天(已缓解的范围为1-69天)。在16例患者中有12例(75%)患者的急性药物超敏反应完全缓解。应监测患者的急性药物超敏反应的症状,包括面部、眼睛和舌头水肿、荨麻疹、瘙痒以及速发严重过敏反应。如果发生中度(2级)急性药物超敏反应,应停止输液,并暂停曲拉西利治疗,直至不良反应恢复至≤1级。如果发生重度(3级)或危及生命(4级)的急性药物超敏反应,应停止滴注,并永久性停用曲拉西利。间质性肺病/肺部炎症:接受细胞周期蛋白依赖性激酶4/6(CDK)4/6抑制剂(与曲拉西利属于同类药物)治疗的患者中可能发生重度、危及生命或致死的间质性肺病和/或肺部炎症。临床试验中接受曲拉西利治疗的272例患者中,有1例(0.4%)患者出现间质性肺病/肺部炎症。该不良反应为3级,在停用曲拉西利2个月后报告,该患者有影响判断的其他药物治疗史。该不良反应未缓解。应监测患者出现提示间质性肺病/肺部炎症的肺部症状,如低氧、咳嗽和呼吸困难。如果中度(2级)间质性肺病/肺部炎症重复发生,应永久性停用曲拉西利。如果发生重度(3级)或危及生命的(4级)间质性肺病/肺部炎症,须永久性停用曲拉西利。胚胎-胎儿毒性:根据作用机制,曲拉西利在妊娠期妇女中使用可能会引起胎儿损伤。育龄女性应在曲拉西利治疗期间以及末次给药后至少3周内使用有效的避孕方法
未进行该项研究且无可靠参考文献。
妊娠期:根据作用机制,曲拉西利在妊娠期妇女中使用可能会引起胎儿损伤。没有相关的动物试验或临床数据可用于评估与药物相关的严重出生缺陷、流产及母体/胎儿不良影响的风险,建议关注妊娠期妇女用药时对胎儿的潜在风险。对于目标人群,主要的出生缺陷和流产的背景风险尚不清楚。所有的妊娠都有出生缺陷、死亡或其它不良结局的背景风险。哺乳期:没有关于母乳或动物乳汁中存在曲拉西利的数据,也没有关于曲拉西利对哺乳婴儿或泌乳影响的数据。由于哺乳婴儿可能会使婴儿出现潜在的严重不良反应,因此建议哺乳期妇女在曲拉西利治疗期间以及末次给药后至少3周内不要进行哺乳。生育能力:妊娠测试:根据作用机制,曲拉西利在妊娠期妇女中使用可能会引起胎儿损伤。建议在开始给药前对育龄女性进行妊娠测试。避孕:曲拉西利在妊娠期妇女中使用会引起胎儿损伤,建议育龄女性患者在接受曲拉西利治疗期间以及末次给药后至少3周内采取有效的避孕方法。 不育症:尚未通过临床研究评估该产品对生育能力的影响。根据动物毒理学研究,曲拉西利可能会损伤雌性动物的生育能力
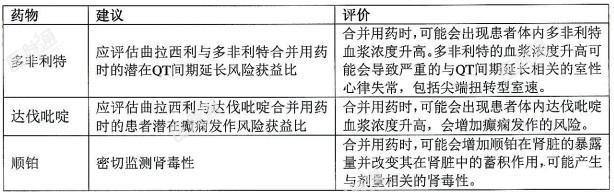
曲拉西利对其它药物(某些OCT2,MATE1和MATE-2K底物)的影响,曲拉西利是OCT2、MATE1和MATE-2K的抑制剂。合并用药可能会使OCT2、MATE1和MATE-2K底物(如多非利特,达伐吡啶和顺铂)在肾脏中的浓度升高或蓄积增加。建议在合并用药时参考这些药物的处方信息,以评估风险/获益。表4:潜在的重要药物相互作用
Patheon Manufacturing Services LLC
86984301000016
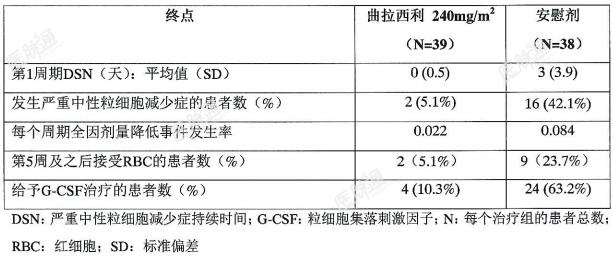
在随机、双盲、安慰剂对照G1T28-02研究中,证实了曲拉西利对既往未接受过系统治疗的广泛期小细胞肺癌(ES-SCLC)患者在接受铂类+依托泊苷治疗时的骨髓保护疗效。患者在第1周期的给药中,研究禁止使用一级预防性粒细胞集落刺激因子(G-CSF)和促红细胞生成剂(ESA)。根据临床指征,从第2周期开始允许使用ESA和预防性使用G-CSF。根据临床指征,在研究过程中随时允许使用治疗性G-CSF、RBC和血小板输注。G1T28-02研究是一项对既往未接受过化疗的ES-SCLC患者中进行的在依托泊苷和卡铂(E/P)治疗前给予曲拉西利或安慰剂的随机(1:1)、双盲、安慰剂对照研究。共有75例患者被随机分配至曲拉西利组(n=38)或安慰剂组(n=37),并根据ECOG状态进行分层(0-1vs2)。在21天的治疗周期的第1天给予卡铂(AUC5),并在第1、2和3天给予依托泊苷(100mg/m2)和曲拉西利(240mg/m2)或安慰剂,直至出现疾病进展或不可接受的毒性。
研究表明,与安慰剂相比,接受曲拉西利治疗的患者,第1周期中严重中性粒细胞减少症(DSN)的持续时间缩短(0vs3天),出现严重中性粒细胞减少症(SN)的患者比例降低(5.1%vs42.1%)(表5)。曲拉西利组有10%的患者出现3级或4级血红蛋白减少,安慰剂组的患者发生率为18%。曲拉西利组患者的RBC输注率/时间比为0.5/100周,安慰剂组为1.9/100周。曲拉西利组有3%的患者接受过ESA治疗,安慰剂组的患者为5%。表5:G1T28-02研究:化疗前接受曲拉西利或安慰剂治疗患者的骨髓保护疗效(意向性治疗分析)
本品基于境外数据及中国研究早期临床试验数据获得附条件批准上市,治疗中国患者的有效性和安全性尚待上市后进一步确证。
注射剂
300mg*1瓶
中硼硅玻璃管制注射剂瓶、注射制剂用氯化丁基橡胶塞、注射制剂瓶用铝塑组合盖。 1瓶/盒。
密闭,不超过25℃保存。
20.00
24个月
国药准字HJ20220066

