希为纳说明书
Sivelestat Sodium for Injection
西维来司他钠
本品活性成份为:西维来司他钠
化学名称: [[2-[[[4-[(2,2-二甲基丙酰基)氧基]苯基]磺酰基]氨基]苯甲酰基]氨基]乙酸钠四水合物
化学结构式: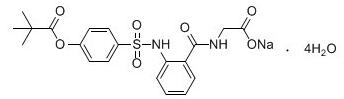
分子式:C20H21N2NaO7S·4(H2O)
分子量:528.51
辅料:甘露醇、磷酸二氢钠、氢氧化钠。
本品为白色疏松块状物或粉末。
用于改善全身性炎症反应综合征的急性肺损伤/急性呼吸窘迫综合征。
使用注意:
1、本品适用于满足下列( 1) 和( 2) 诊断标准的患者。
( 1) 全身性炎症反应综合征,符合以下项目中2项以上:
① 体温 > 38℃或 < 36℃;
② 心率 > 90次/分;
③ 呼吸频率 > 20次/分或二氧化碳分压(PaCO2) < 32 mmHg;
④ 白细胞数 > 12×109/L或 < 4×109/L或杆状核细胞(未成熟白细胞) > 10%。
( 2) 急性肺损伤/急性呼吸窘迫综合征,符合以下全部项目:
① 机械通气时PaO2/FiO2 ≤ 300 mmHg;
② 胸部X线检查两肺均有浸润阴影;
③ 能测定肺动脉楔入压时,肺动脉楔入压 ≤ 18mmHg;不能测定肺动脉楔入压时,未见左房压上升的临床表现。
2、不建议用于伴有4个及4个以上器官损伤的多器官损伤、烧伤、外伤的急性肺损伤/急性呼吸窘迫综合征。
3、在合并重度慢性呼吸系统疾病患者中的有效性及安全性尚未明确。
采用生理盐水250ml-500ml进行配伍,现配现用。
将1日剂量(4.8mg/kg)用250-500ml生理盐水稀释,24小时持续静脉给药(相当于0.2mg/kg/h),最长持续给药14天。
使用说明:
1、建议在肺损伤发生后72小时内开始使用本品。
2、根据症状改善情况也可在短期给药后停药。如果本品用药5天后的改善情况不理想,通常此后的改善情况(14天后)也会不理想。
3、避免与氨基酸输液混用。使用含钙的输液(本品浓度2mg/ml以上)或使用输液稀释后pH下降到6.0以下时,会生成沉淀。(见【注意事项】)
1、临床试验数据
支持原研药在日本获批的临床试验中,580例患者中93例(16.0%)发生229例次不良反应(包含临床检查值异常)。主要为:49例(8.4%)门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)升高等肝功能异常,36例(6.2%)碱性磷酸酶(ALP)升高,11例(1.9%)胆红素升高,9例(1.6%)白细胞减少,7例(1.2%)嗜酸性粒细胞升高。
原研药日本上市后的特别调查及上市后临床试验中,1030例患者中114例(11.1%)发生266例次不良反应(包含临床检查值异常)。主要为:75例(7.3%)AST、ALT升高等肝功能异常,32例(3.1%)ALP升高,18例(1.7%)胆红素升高,12例(1.2%)乳酸脱氢酶升高。
2、不良反应总结
(1)严重不良反应
1)呼吸困难
呼吸困难(0.2%),一旦出现应中止用药,并进行适当处理。
2)白细胞减少、血小板减少
白细胞减少(0.2%)、血小板减少(0.2%),一旦出现应中止用药,并进行适当处理。
3)肝功能损伤、黄疸
伴有AST、ALT显著升高的肝功能损伤(0.2%)、黄疸(发生频率不明),一旦出现应中止用药,并进行适当处理。
(2)其他不良反应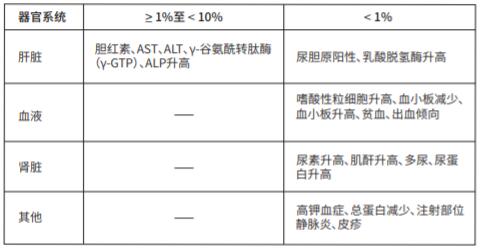
对本品成分过敏者禁用。
使用本品并不能代替急性肺损伤/急性呼吸窘迫综合征的常规治疗(辅助呼吸、补充循环血容量、抗菌治疗等),需对原发疾病进行治疗。
采用生理盐水250ml-500ml进行配伍,现配现用。使用含钙的输液时,本品浓度应低于1mg/ml(本品浓度为2mg/ml以上时会生成沉淀)。输液稀释后pH低于6.0时也会生成沉淀。使用氨基酸输液会导致本品分解,因此需避免与氨基酸输液混用。
尚无药物过量相关研究。
妊娠期的用药安全性尚不明确。孕妇或可能已妊娠的妇女,需经医生评估后认为给药的获益大于风险时,才能使用本品。动物实验中发现本品会通过乳汁排泄。使用本品治疗期间应停止哺乳。儿童用药的安全性和有效性尚不明确。因老年人生理机能下降,需谨慎用药。
本品与氨苄西林钠、氨甲环酸、甲磺酸萘莫司他、甲磺酸加贝酯无相互作用。
国外临床试验中,本品0.2mg/kg/h剂量与头孢匹胺钠1~2g/天同时给药时,对本品药物原型及代谢产物的血药稳态浓度无影响。
苏州二叶制药有限公司
86910104000045
作用机制
西维来司他钠为中性粒细胞弹性蛋白酶的选择性抑制剂。中性粒细胞弹性蛋白酶是一种蛋白分解酶,从聚集到肺部的中性粒细胞中游离出来,能分解肺结缔组织,使肺血管通透性增强,诱发急性肺损伤/急性呼吸窘迫综合征;还能促进中性粒细胞趋化因子的产生,加重炎症反应,是与全身性炎症反应综合征的急性肺损伤/急性呼吸窘迫综合征相关的重要损伤因子。
药效学
(1)对中性粒细胞弹性蛋白酶的抑制作用:西维来司他钠能明显抑制人及各种动物来源的中性粒细胞弹性蛋白酶的活性,为拮抗性抑制作用。但对其他的丝氨酸蛋白酶、半胱氨酸蛋白酶及金属蛋白酶几乎无抑制作用,为中性粒细胞弹性蛋白酶的选择性抑制剂(体外)。
生物体内的弹性蛋白酶抑制因子a1抗胰蛋白酶在中性粒细胞产生的活性氧作用下很容易失去弹性蛋白酶抑制作用,但西维来司他钠的弹性蛋白酶抑制作用不受活性氧的影响(体外)。
(2)对急性肺损伤/急性呼吸窘迫综合征模型的作用:在由人中性粒细胞弹性蛋白酶引起的仓鼠急性肺损伤/急性呼吸窘迫综合征模型中,静脉持续给予西维来司他钠,可抑制支气管肺泡冲洗液中的出血,且抑制效果与剂量相关。在眼镜蛇蛇毒或内毒素引起的仓鼠急性肺损伤/急性呼吸窘迫综合征模型中,静脉持续给予西维来司他钠,可抑制血浆中或支气管肺泡冲洗液中的弹性蛋白酶活性。
(3)对肺功能的改善作用:由盐酸引起的仓鼠误吸性肺损伤模型中,静脉持续给予西维来司他钠,可改善肺功能(动脉血氧分压)低下,改善生存率。
遗传毒性
西维来司他钠细菌回复突变试验、染色体畸变试验和小鼠微核试验结果均为阴性。
生殖毒性
雌性大鼠于妊娠前及妊娠初期静脉给药,未见对母体生育能力及胎仔的影响,母体和胎仔的未见毒性反应剂量均为75mg/kg。
雌性大鼠器官生成期静脉给药,未见对母体和胎仔影响,母体和胎仔的未见毒性反应剂量均为75mg/kgo雌兔在器官生成期静脉给药,母体体重增加被抑制、平均摄食量下降、肾脏重量增加,未见对胎仔影响,母体未见毒性反应剂量为7.5mg/kg,胎仔未见毒性反应剂量为30mg/kg。
妊娠雌性大鼠静脉给药的围产期毒性试验中,未见对母体、Fi代、 F2代的影响,未见毒性反应剂量均为75mg/kg。
1、原研药日本上市前临床试验
在1项双盲对照试验及1项以ARDSNetwork为标准的临床试验(均纳入含肺在内的3个以下器官损伤的受试者,均用药14天)中,确认了本品用于全身性炎症反应综合征的肺损伤的有效性。
(1)双盲对照试验中,共纳入234例患者,观察到对全身性炎症反应综合征的肺损伤有效,整体改善程度在“中等程度改善”以上的患者比例为70.5%(165/234例)。肺损伤发生后72h内开始给药的患者中,肺功能改善达到“中等程度改善”以上患者比例为72.5%(66/91例);肺损伤发生后超过72h才开始给药的患者中为54.5%(12/22例)。以给药5天后的肺功能改善程度为基准,给药10天后、14天后达到“中等程度改善”以上的患者比例如下所示: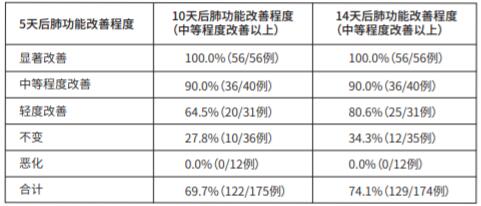
5天后“不变”中的1例因不良反应中止用药,故14天后无数据
2)另1项以ARDSNetwork为标准的临床试验,排除了合并包含肺在内的4个以上器官损伤的患者、合并重度慢性呼吸系统疾病的患者、伴有烧伤、外伤的急性肺损伤患者。共纳入20例患者,试验结果非机械通气时间(VFD)为14.3±8.6天(平均±标准差)。此外,前述双盲对照试验中,有107例患者符合上述依据ARDSNetwork标准临床试验的受试者选择标准,对其进行亚组分析,对照组VFD为10.7±10.8天,试验组为13.1±10.9天。
2、原研药日本上市后临床试验
(1)以556名全身性炎症反应综合征的急性肺损伤患者为受试者,根据ARDSNetwork标准进行了上市后临床试验(排除合并包含肺在内的4个以上器官损伤的患者、合并重度慢性呼吸系统疾病的患者、伴有烧伤、外伤的急性肺损伤患者)。
未使用本品的患者VFD为12.1±1.0天,使用本品的患者VFD为15.7±0.5天,使用本品的患者VFD更长。未使用本品的患者28天生存率(Kaplan-Meier法)为77.0%,使用本品的患者为88.6%,使用本品的患者28天生存率更高。未使用本品的患者180天生存率(Kaplan-Meier法)为56.3%,使用本品的患者为71.8%,使用本品的患者180天生存率更高。VFD、28天生存率、180天生存率的差别均有统计学意义。
备注:综合了2项独立的多中心试验数据,使用本品患者384例,未使用本品患者172例,结果根据两组间患者背景的差异进行了调整。
(2)以合并严重的慢性呼吸系统疾病的患者为受试者,进行了上市后临床试验,因为本品的受试者较少(9例),故未能确认有效性和安全性。
3、其他国家临床试验
以487例急性肺损伤患者为受试者,根据ARDSNetwork标准,进行了安慰剂对照的临床试验(排除合并重度慢性呼吸系统疾病的患者,未排除合并包含肺在内的4个以上器官损伤的患者、伴有烧伤、外伤的急性肺损伤患者)。
安慰剂组的VFD为11.9±10.1天,给予本品的试验组为11.4±10.3天;安慰剂组28天死亡率为26.0%(64/246例),试验组为26.6%(64/241例);安慰剂组180天死亡率为31.3%(77/246例),试验组为40.2%(97/241例)。与安慰剂组相比,试验组的180天死亡率更高且有统计学意义。
备注:在符合原研药日本试验入组标准的患者(排除合并包含肺在内的4个以上器官损伤的患者、伴有烧伤、外伤的急性肺损伤患者)中,对肺损伤程度与原研药日本双盲对照试验中相同程度的100例患者进行亚组分析,安慰剂组的VFD为12.0±10.3天,试验组为15.9±10.4天;安慰剂组的28天死亡率为34.0%(18/53例),试验组为12.8%(6/47例);安慰剂组的180天死亡率为45.3%(24/53例),试验组为34.0%(16/47例)。
4、本品中国验证性临床试验
本品在中国17家研究中心开展了一项随机、双盲、安慰剂对照临床试验,试验组给予本品0.2mg/kg/h持续静脉内给药,不超过14天,对照组给予安慰剂。共完成并分析227例受试者数据,试验组116例,对照组111例。
用药结束时,试验组的肺损伤改善有效率为64.66%,对照组为47.75%,(试验组—对照组)有效差值及95%置信区间为16.91%(3.98%,29.30%),差异有统计学意义(P=0.010)。
1、血药浓度
5名健康成年人接受本品0.5 mg/kg/h静滴2h, 2 h后血中本品浓度为11.678 ug/ml,AUC为61.113 ug·h/ml, 2~6 h半衰期为131.4分钟,6~10 h半衰期为199.9分钟。
2、代谢
本品主要通过肝脏代谢。主要被羧酸酯酶水解,之后与葡萄糖醛酸及硫酸结合。体外研究提示本品的代谢与细胞色紫P -450代谢酶无关。
3、排泄
本品主要通过尿排泄。5名健康成年人接受本品0.5 mg/kg/h静滴2h,给药后24 h和48h分别有81.0%和84.5%从尿中排泄。
4、蛋白结合率
人血清中蛋白结合率为99.6%(体外,超滤法)。
注射剂
0.1g(以C20H21N2NaO7S·4H2O计)
直接接触药品的包装为20ml中性硼硅玻璃管制注射剂瓶、注射用冷冻干燥无菌粉末 用氯化丁基橡胶塞,配件为抗生素瓶用铝塑组合盖。 每盒4瓶;每盒10瓶。
遮光,密闭,不超过25℃保存。
24个月
国药准字H20203093

