安伯瑞(ALUNBRIG)说明书
Brigatinib Tablets
布格替尼
本品主要成份是布格替尼
化学名称:5-氯-N4- [2-(二甲基磷酰基)苯基] -N2- {2-甲氧基-4- [4-(4-甲基哌嗪-1-基)哌 啶-1-基]苯基}嘧啶-2,4-二胺
化学结构式: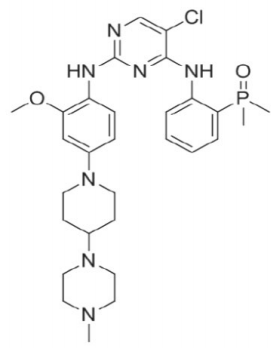
分子式:C29H39ClN7O2P
分子量:584.10
辅料:乳糖一水合物、微晶纤维素、羧甲淀粉钠(A 型)、硬脂酸镁和疏水性胶态二氧化硅,白色欧巴代 II
本品为白色至类白色薄膜衣片,除去包衣后显白色或类白色。 布格替尼片 30mg:圆形,片剂一面印有“U3”字样,另一面平坦。 布格替尼片 90mg:椭圆形,片剂一面印有“U7”字样,另一面平坦。 布格替尼片 180mg:椭圆形,片剂一面印有“U13”字样,另一面平坦。
本品单药适用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性的非小细胞肺癌(NSCLC)患者的治疗。
患者选择
服用本品前,必须获得经充分验证的检测方法证实的 ALK 阳性评估结果。
推荐剂量
本品推荐剂量方案是:
前 7 天口服90 mg,每日 1 次;然后增加剂量至口服 180 mg,每日 1 次。
本品给药直至疾病进展或出现不可接受的毒性。
如果因不良反应以外的原因中断本品治疗 14 天或更长时间,则在增加至既往耐受剂量前,以 90 mg 每日一次的剂量恢复治疗,持续 7 天。
本品与食物同服或不同服均可。应指导患者整片吞服。不要压碎或咀嚼药片。
若漏服一剂或在服药后发生呕吐,不应补充漏服剂量,而应在下次服药时间服用规定剂量。
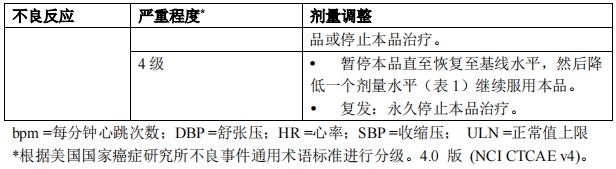
针对不良反应的剂量调整
表 1 中总结了本品剂量减量的调整方案。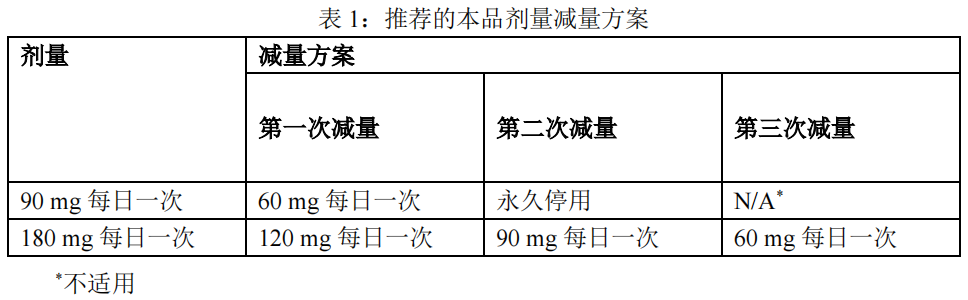
一旦因不良反应减少剂量,不要随后增加剂量。如果患者不能耐受 60 mg 每日一次的剂量,永久停止本品治疗。 表 2 列出了针对不良反应管理调整本品剂量的建议。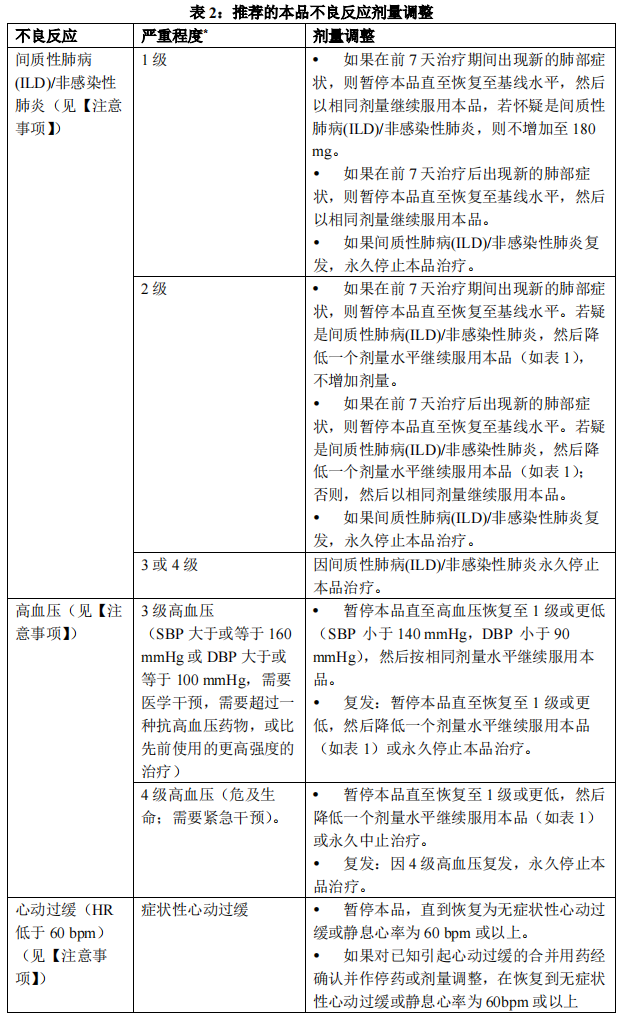
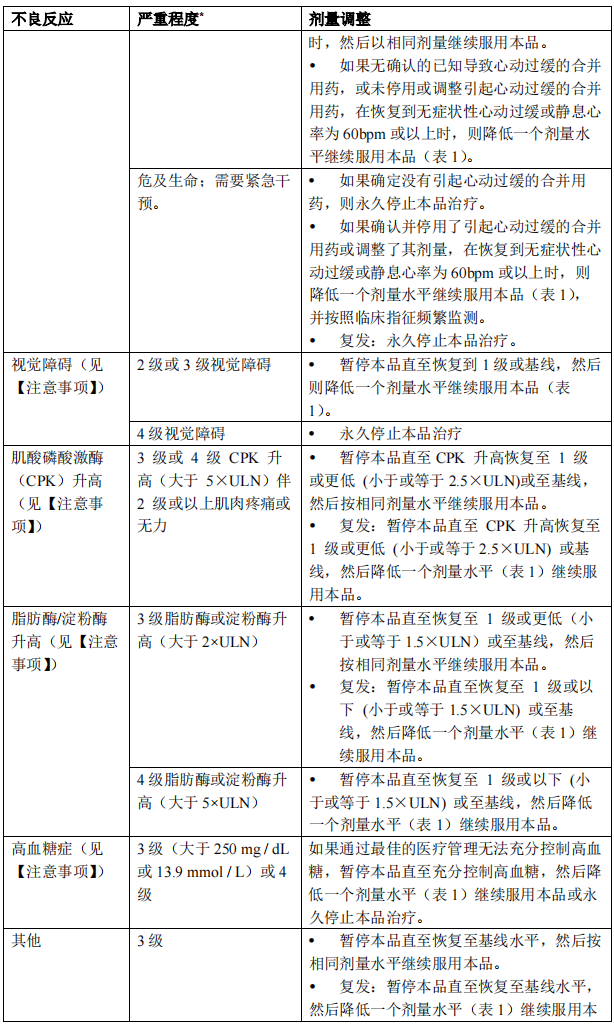
因强或中效 CYP3A 抑制剂的剂量调整
在本品治疗期间,避免同时给予强效或中效 CYP3A 抑制剂(见【药物相互作用】、【药理毒理】)。如果无法避免同时给予强效 CYP3A 抑制剂,则将本品每日一次剂量降低约 50%(即从 180 mg 降低至 90 mg,或从 90 mg 降低至 60 mg)。如果无法避免同时给予CYP3A 中效抑制剂,则将本品每日一次剂量降低约 40%(即从 180 mg 降至 120 mg、120 mg 降至 90 mg 或从 90 mg 降至 60 mg)。停用强效或中效 CYP3A 抑制剂后,恢复使用CYP3A 抑制剂前耐受的本品剂量。 因中效 CYP3A 诱导剂的剂量调整
在本品治疗期间,避免同时给予 CYP3A 中效诱导剂见【药物相互作用】、【药理毒理】)。如果无法避免同时给予 CYP3A 中效诱导剂,则在接受当前本品剂量(如耐受)治疗 7 天后,以 30 mg 增量增加本品每日一次剂量,最多为开始中效 CYP3A 诱导剂前耐受的本品剂量的 2 倍。
停用 CYP3A 中效诱导剂后,恢复使用 CYP3A 中效诱导剂前耐受的本品剂量。
肝损害患者的剂量调整
对于轻度肝损害(Child-Pugh A)或中度肝损害(Child-Pugh B)患者,不建议调整剂量。对于重度肝损害(Child-Pugh C)患者,将本品每日一次剂量降低约 40%(即从 180 mg 降至 120 mg、120 mg 降至 90 mg 或从 90 mg 降至 60 mg)(见【药代动力学】)。
肾损害患者的剂量调整
对于轻度或中度肾损害患者 [Cockcroft-Gault 报告的肌酐清除率 (CLcr) 为 30-89 mL/min],不建议调整剂量。对于重度肾损害患者[Cockcroft-Gault 公式计算的肌酐清除率(CLcr) 为 15-29 mL/min],将本品每日一次剂量降低约 50%(即,从 180 mg 降至 90 mg,或从 90 mg 降至 60 mg)(见【药代动力学】)
以下不良反应在说明书的其他部分有更加详细的论述:
间质性肺病(ILD)/非感染性肺炎(见【注意事项】);
高血压(见【注意事项】) ;
心动过缓(见【注意事项】) ;
视觉障碍(见【注意事项】) ;
肌酸磷酸激酶(CPK)升高(见【注意事项】) ;
胰酶升高(见【注意事项】) ;
高血糖症(见【注意事项】)。
临床试验经验:
由于临床试验是在各种不同条件下进行的,因此,一种药物临床试验中观察到的不良反应发生率不能与另一种药物临床试验中的不良反应发生率进行直接比较,也可能无法反映临床实践中的发生率。
既往未接受过 ALK 靶向治疗的晚期 ALK 阳性 NSCLC
ALTA 1L 研究中,在 136 例既往未接受过 ALK 靶向治疗的晚期 ALK 阳性NSCLC 患者中评价了布格替尼的安全性(见【临床试验】)。给与布格替尼治疗,前 7 天每天 90 mg 口服给药,每日一次;然后增加至每天 180 mg 口服给药,每日一次,治疗的中位持续时间为 24.3 个月。共有 106 例 (78%) 患者接受布格替尼的暴露时间大于或等于6 个月,其中包括 92 例 (68%) 患者的暴露时间大于或等于 1 年。布格替尼的中位相对剂量强度为 97%。
研究人群 (N = 275) 的特征为:中位年龄 59 岁(范围:27-89)、年龄小于 65 岁(68%)、女性 (55%)、白人 (59%)、亚裔 (39%)、IV 期疾病 (93%)、NSCLC 腺癌组织学(96%)、从不吸烟者 (58%)、ECOG 体能状态 (PS) 0 或 1 (95%) 和基线时 CNS 转移(30%) (见【临床试验】)
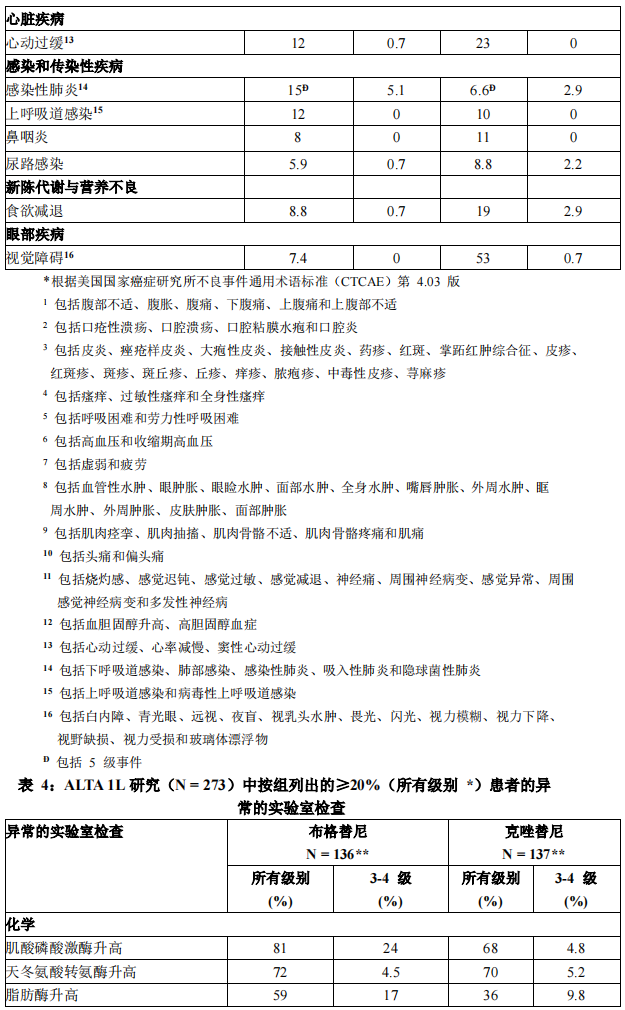
33% 接受布格替尼治疗的患者发生严重不良反应。最常见的严重不良反应为感染性肺炎(4.4%)、间质性肺病(ILD)//非感染性肺炎(3.7%)、发热(2.9%)、呼吸困难(2.2%)、肺栓塞(2.2%)和乏力(2.2%)。2.9% 的患者发生致死性不良反应,包括感染性肺炎(1.5%)、脑血管意外(0.7%)和多器官功能障碍综合征(0.7%)。
在 ALTA 1L 研究中,13% 接受布格替尼的患者因不良反应而永久停用本品。导致停药的最常见不良反应为间质性肺病(ILD)/非感染性肺炎(3.7%)和感染性肺炎(2.2%)。
在 ALTA 1L 研究中,38%的患者因不良反应需要减量。导致减量的最常见不良反应为肌酸磷酸激酶升高(15%)、脂肪酶升高(6.6%)、淀粉酶升高(4.4%)、天冬氨酸转氨酶升高(2.2%)、间质性肺病(ILD)//非感染性肺炎(2.2%)和高血压(2.2%)。
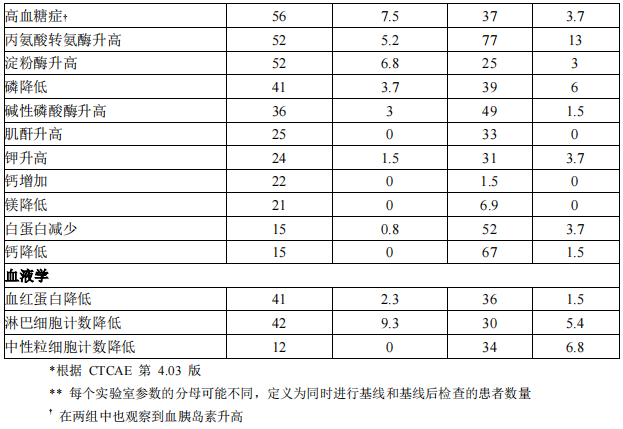
表 3 和表 4 总结了在 ALTA 1L 研究中观察到的常见不良反应和异常的实验室检查。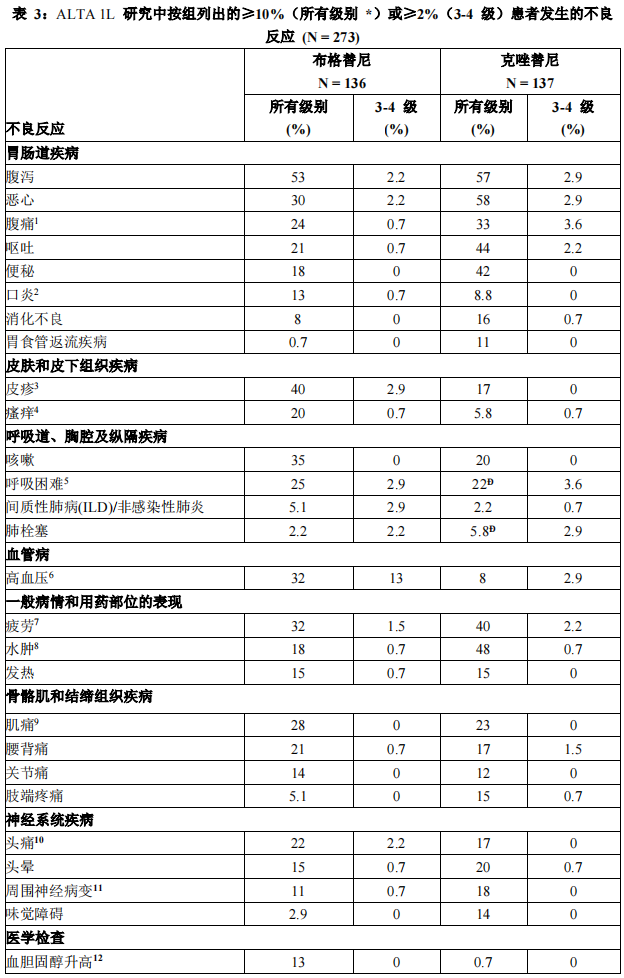
既往接受克唑替尼治疗的 ALK 阳性晚期或转移性 NSCLC
在 219 例局部晚期或转移性 ALK 阳性非小细胞肺癌(NSCLC)患者中评估了布格替尼的安全性,这些患者在接受克唑替尼治疗发生疾病进展后,在 ALTA 研究中接受至少一次布格替尼给药。患者接受布格替尼的治疗,持续 90 mg 每日一次(90 mg 组),或者 90 mg 每日一次,持续 7 天,随后 180 mg 每日一次(90→180 mg 组)。90 mg 组的中位治疗持续时间为 7.5 个月,90→180 mg 组的治疗持续时间为 7.8 个月。布格替尼暴露时间大于或等于 6 个月的患者总数为 150 例(68%),暴露时间大于或等于 1 年的患者为 42 例 (19%)。
研究人群特征为:中位年龄 54 岁(范围:18-82 岁),65 岁以下(77%),女性(57%),白人(67%),亚洲人(31%),IV 期疾病(98%),NSCLC 腺癌组织学(97%),从不吸烟或曾经吸烟(95%),ECOG 性能状态(PS)0 或 1(93%)和基线时脑转移(69%)(见【临床试验】)
90 mg 组 38%的患者和 90→180 mg 组 40%的患者出现严重不良反应。最常见的严重不良反应为感染性肺炎(总体为 5.5%,90 mg 组为 3.7%,90→180 mg 组为 7.3%)和 ILD/非感染性肺炎(总体为 4.6%,90 mg 组为 1.8%,90→180 mg 组为 7.3%)。3.7%的患者发生致死性不良反应,包括感染性肺炎(2 例)、猝死、呼吸困难、呼吸衰竭、肺栓塞、细菌性脑膜炎和尿路感染(各 1 例)。
在 ALTA 研究中,90 mg 组 2.8%的患者和 90→180 mg 组 8.2%的患者因不良反应永久停用布格替尼。导致停药的最常见不良反应为 ILD/非感染性肺炎(90 mg 组为 0.9%,90→180 mg 组为 1.8%)和感染性肺炎(仅在 90→180 mg 组为 1.8%)。在 ALTA 研究中,14%的患者因不良反应需要减少剂量(90 mg 组为 7.3%,90→180 mg 组为 20%)。在两种方案中,导致剂量减少的最常见不良反应均为肌酸磷酸激酶升高(90 mg 组为 1.8%,90→180 mg 组为 4.5%)。
表 5 和表 6 总结了在 ALTA 研究中观察到的常见不良反应和异常的实验室检查。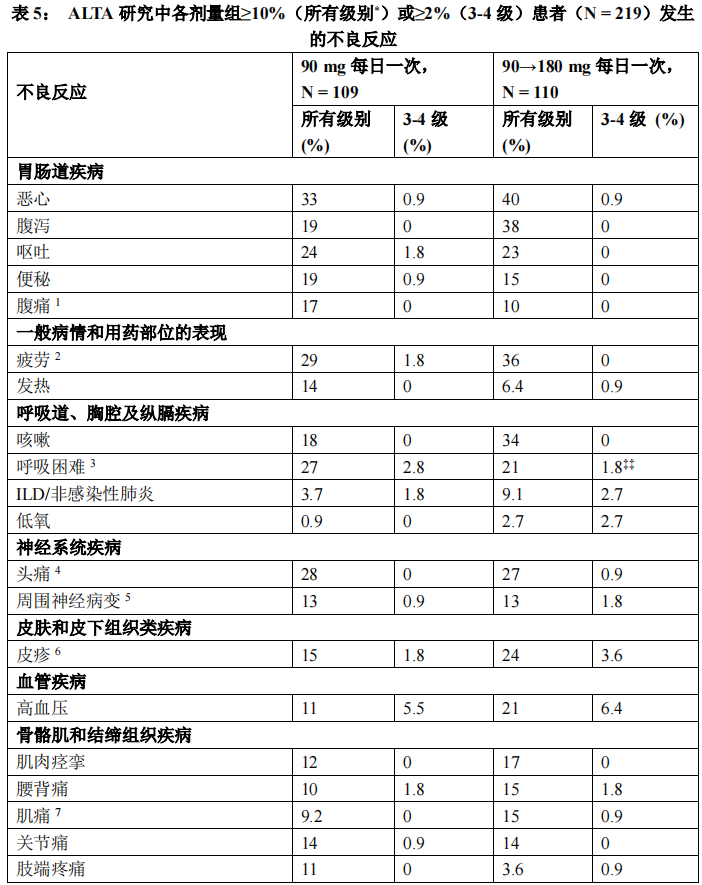
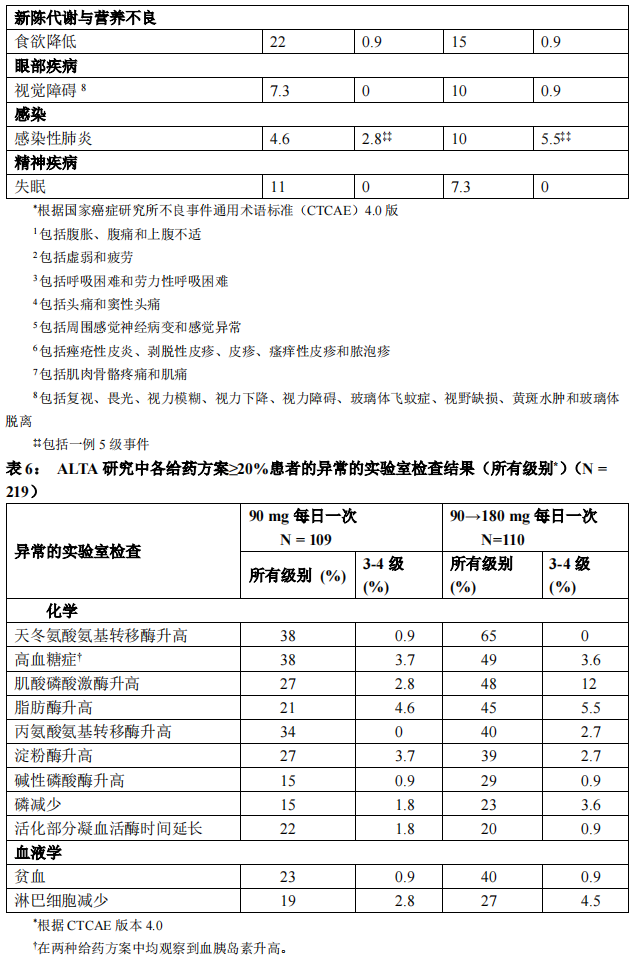
多项临床试验中的其他不良反应:
在由 3 项研究组成的汇总临床试验人群中,274 例患者接受推荐剂量的布格替尼治疗,报告了以下不良反应和异常的实验室检查:白细胞计数降低(28%)、低钠血症(20%)、低钾血症(19%)、血小板计数降低(10%)、皮肤干燥(4.7%)、疼痛(3.3%)和肌肉骨骼僵硬(1.1%)
禁用于对布格替尼或本品中任一成分过敏的患者。
间质性肺病(ILD)/非感染性肺炎
使用布格替尼曾发生与间质性肺病 (ILD)/非感染性肺炎一致的重度、危及生命和致死性肺部不良反应。
在 ALTA 1L 研究中,5.1%接受布格替尼的患者发生间质性肺病 (ILD)/非感染性肺炎。2.9%的患者在开始布格替尼治疗后 8 天内发生间质性肺病 (ILD)/非感染性肺炎,2.2% 的患者发生 3-4 级反应。
在 ALTA 研究中,90 mg 组(90 mg 每日一次)3.7% 的患者和 90→180 mg 组(180 mg 每日一次,90 mg 每日一次剂量的 7 天导入期)9.1% 的患者发生了间质性肺病(ILD)/非感染性肺炎。6.4% 的患者在开始布格替尼治疗后 9 天内(中位发生时间为 2 天)发生与可能的间质性肺病(ILD)/非感染性肺炎一致的不良反应,2.7% 的患者发生 3-4 级反应。
应监测新的呼吸道症状或恶化的呼吸道症状(例如,呼吸困难、咳嗽等),尤其是在开始布格替尼治疗的第一周。出现新的呼吸道症状或恶化的呼吸道症状患者应暂停服用布格替尼,并及时评价间质性肺病(ILD)/非感染性肺炎或其他呼吸道症状原因(如肺栓塞、肿瘤进展和感染性肺炎)。对于 1 级或 2 级间质性肺病 (ILD)/非感染性肺炎,在恢复至基线后根据表 1 降低剂量继续布格替尼治疗或停用布格替尼。因 3 级或 4 级间质性肺病(ILD)/非感染性肺炎或 1 级或 2 级间质性肺病 (ILD)/非感染性肺炎复发应永久停用布格替尼[见【用法用量】【不良反应】]。
高血压
在 ALTA 1L 研究中,32%接受布格替尼的患者报告高血压;13%的患者发生 3 级高血压。
在 ALTA 研究中,接受布格替尼的 90 mg 组 11% 的患者和 90→180 mg 组 21% 的患者报告了高血压。总体有 5.9%的患者发生 3 级高血压。
在布格替尼治疗前应控制血压。在布格替尼治疗 2 周后监测血压,此后至少每月监测一次。如果尽管接受了最佳抗高血压治疗,仍发生 3 级高血压,则应暂停服用布格替尼。
消退或改善至 1 级后,以相同剂量继续布格替尼治疗。对于 4 级高血压或 3 级高血压复发,考虑永久停止布格替尼治疗[见【用法用量】,【不良反应】]。
当布格替尼与引起心动过缓的降压药联合给药时,应谨慎(见【注意事项】)。
心动过缓
在 ALTA 1L 研究中,8.1%接受布格替尼的患者心率低于 50 次/分钟(bpm)。1 例 (0.7%)患者发生 3 级心动过缓。
在 ALTA 研究中,90 mg 组 5.7%的患者和 90→180 mg 组 7.6%的患者发生心率低于 50 次/分钟 (bpm)。90 mg 组 1 例 (0.9%) 患者发生了 2 级心动过缓。
在布格替尼治疗期间应监测心率和血压。如果无法避免伴随使用已知可引起心动过缓的药物,则应更频繁地监测患者(见【注意事项】)。
对于症状性心动过缓,应暂停服用布格替尼,并评估已知可引起心动过缓的合并用药。如果发现并停用已知可引起心动过缓的合并用药或对该药进行了调整剂量,则在症状性心动过缓消退后以相同剂量继续布格替尼治疗;否则,在症状性心动过缓消退后应降低布格替尼剂量。如果未发现有影响的合并用药,则如发生危及生命的心动过缓应永久停用布格替尼 (见【用法用量】)。
视觉障碍
在 ALTA 1L 研究中,7.4% 接受布格替尼治疗的患者报告了导致视觉障碍的 1 级或 2级不良反应,包括视力模糊、畏光、闪光和视力下降。
在 ALTA 研究中,布格替尼 90 mg 组 7.3% 的患者和 90→180 mg 组 10% 的患者报告了导致视觉障碍的不良反应,包括视力模糊、复视和视力下降。90→180 mg 组发生 3 级黄斑水肿和白内障各 1 例。
建议患者报告任何视觉症状。出现新的或恶化的 2 级或以上视觉症状的患者,应暂停服用布格替尼并进行眼科评价。在 2 级或 3 级视觉障碍恢复至 1 级严重程度或基线时,应降低剂量继续布格替尼治疗。如发生 4 级视觉障碍应永久停止布格替尼治疗(见【用法用量】,【不良反应】)。
肌酸磷酸激酶(CPK)升高
在 ALTA 1L 研究中,81% 接受布格替尼的患者发生肌酸磷酸激酶(CPK)升高。3 级或 4 级 CPK 升高的发生率为 24%。15% 的患者因 CPK 升高而减量。
在 ALTA 研究中,90 mg 组 27%接受布格替尼的患者和 90 mg→180 mg 组 48%的患者发生 CPK 升高。90 mg 组 3-4 级 CPK 升高的发生率为 2.8%,90→180 mg 组为 12%。
90 mg 组 1.8%的患者和 90→180 mg 组 4.5%的患者因 CPK 升高而降低剂量。
建议患者报告任何原因不明的肌肉疼痛、压痛或无力。在布格替尼治疗期间应监测CPK 水平。如果发生 3 级或 4 级 CPK 升高伴 2 级或以上肌肉疼痛或无力,应暂停服用布格替尼。在缓解或恢复至 1 级 CPK 升高或基线后,以与表 2 所述相同的剂量或降低的剂量继续布格替尼治疗(见【用法用量】【不良反应】)。
胰酶升高
在 ALTA 1L 研究中,52%的患者发生淀粉酶升高,6.8% 的患者发生 3 级或 4 级淀粉酶升高。59% 的患者发生脂肪酶升高,17%的患者发生 3 级或 4 级脂肪酶升高。
在 ALTA 研究中,90 mg 组 27%的患者和 90→180 mg 组 39%的患者发生淀粉酶升高。90 mg 组 21%的患者和 90→180 mg 组 45%的患者发生脂肪酶升高。90 mg 组 3.7% 的患者和 90→180 mg 组 2.7%的患者发生了 3 级或 4 级淀粉酶升高。90 mg 组 4.6%的患者和 90→180 mg 组 5.5%的患者发生了 3 级或 4 级脂肪酶升高。
在布格替尼治疗期间监测脂肪酶和淀粉酶。如果发生 3 级或 4 级胰酶升高,应暂停布格替尼治疗。在消退或恢复至 1 级或基线时,以表 2 所述的相同剂量或降低剂量继续布格替尼治疗(见【用法用量】【不良反应】)。
高血糖症
在 ALTA 1L 研究中,56% 接受 布格替尼 的患者出现新发高血糖或高血糖恶化。基于血清空腹血糖水平的实验室评估,7.5% 的患者发生了 3 级高血糖。
在 ALTA 研究中,43%接受布格替尼的患者出现新的高血糖或恶化的高血糖。基于血清空腹血糖水平的实验室评估,3.7%的患者发生了 3 级高血糖。基线时 20 例患有糖尿病或葡萄糖不耐受患者中,2 例 (10%) 在接受布格替尼期间需要开始胰岛素治疗。
开始使用布格替尼前评应估空腹血清葡萄糖,此后定期监测。根据需要开始或优化降糖药物治疗。如果通过最佳医疗管理仍无法充分控制高血糖,则应暂停服用布格替尼直至充分控制高血糖,并考虑按照表 1 所述降低布格替尼的剂量或永久停用布格替尼(见【用法用量】【不良反应】)。
胚胎-胎儿毒性
基于其作用机制和在动物中的发现,当对妊娠女性给药时,布格替尼可能会对胎儿造成危害。尚无孕妇使用布格替尼的临床数据。妊娠大鼠在器官形成期接受布格替尼给药,在剂量低至 12.5 mg/kg/天时(按 AUC 计算,约为 180 mg 每日一次剂量下人体暴露量的0.7 倍)发生剂量相关的骨骼异常,在剂量为 25 mg/kg/天时(按 AUC 计算,约为 180 mg 每日一次剂量下人体暴露量的 1.26 倍)或更高剂量时,导致着床后丢失增加、畸形和胎仔体重下降。
应告知育龄期女性对胎儿的潜在风险。应建议育龄期女性在布格替尼治疗期间和末次给药后至少 4 个月内使用有效的非激素避孕措施。建议有生育能力女性伴侣的男性在治疗期间和布格替尼末次给药后至少 3 个月内采取有效的避孕措施(见【孕妇及哺乳期妇女用药】)。
目前尚无本品药物过量的特异性解毒剂,应对发生药物过量的患者进行密切监测并对其进行支持治疗。
风险概述 基于布格替尼的作用机制及对动物的研究结果,妊娠妇女服用会给胎儿带来伤害(见 【药理毒理】)。尚无妊娠妇女服用布格替尼的临床数据。妊娠大鼠在器官形成期间口服布格替尼,剂量低至 12.5mg / kg /天(约为 180 mg 每日一次人类暴露 AUC 的 0.7 倍)时导致剂量相关的骨骼异常,以及剂量为 25mg / kg /天(约为 180 mg 每日一次人体暴露量的 1.26倍)或更高时,导致着床后流产、畸形和胎儿体重降低。如果妊娠期间服用本品,或者如果患者在服用本品时妊娠,应告知患者本品对胎儿的潜在风险。 数据 动物数据 在胚胎 - 胎儿发育研究中,对器官形成期间的妊娠大鼠给予每日剂量的布格替尼,在剂量低至 12.5mg/kg/天(约为 180 mg 每日一次人类暴露 AUC 的 0.7 倍)时观察到剂量相关的骨骼(不完全骨化,小切牙)和内脏异常。在 25mg / kg /天(约为 180 mg 每日一次人类 AUC 的 1.26 倍)观察到畸形,包括:全身性水肿(全身性皮下水肿)、无眼畸形(没有眼睛)、前肢过度屈曲、肢体小、短和/或弯曲、肋骨多处融合、肩胛骨弯曲、脐突出(肠道突出到脐)和腹裂(肠壁突出于腹壁缺损)以及双侧侧脑室中度扩张的内脏器官的研究结果。 具有生育能力的女性和男性 妊娠 开始布格替尼治疗前,应确认育龄期女性的妊娠状态。 避孕 布格替尼可导致胎儿危害 女性 应告知育龄期女性在接受布格替尼治疗期间及最后一个给药后至少 4 个月内进行有效的非激素避孕。建议患者使用非激素避孕措施,因为布格替尼可致使一些激素避孕药无效(见【药物相互作用】)。 男性 由于具有潜在遗传毒性,因此应告知有育龄期女性伴侣的男性患者在接受布格替尼治疗期间以及最后一次给药后至少 3 个月内使用有效避孕(见【药理毒理】)。 生育能力 根据雄性动物生殖器官研究结果,布格替尼可能会导致雄性生育能力减退(见【药理毒理】)风险概述 尚无关于布格替尼在人乳汁中分泌或其对母乳喂养婴儿或乳汁生成影响的数据。由于哺乳婴儿可能会出现不良反应,应建议哺乳期女性在布格替尼治疗期间以及最后一次给药后 1 周内不要进行母乳喂养。目前尚无儿科患者使用布格替尼的有效性和安全性数据在入组 ALTA 1L 研究中布格替尼组和 ALTA 研究的 359 例患者中,26.7% 为 65 岁及以上,7.5% 为 75 岁及以上。在≥65 岁患者和年轻患者之间未观察到安全性或有效性的总体差异。
其他药物对布格替尼的影响
强效或中效 CYP3A 抑制剂
布格替尼与强效或中效 CYP3A 抑制剂联合给药增加了布格替尼的血浆浓度,可能增加不良反应的发生率(见【药代动力学】)。应避免布格替尼与强效或中效 CYP3A 抑制剂联合给药。如果无法避免同时给予强效或中效 CYP3A 抑制剂,则应按照建议调整剂量(见【用法用量】)
强效或中效 CYP3A 诱导剂
同时给予布格替尼与强效或中效 CYP3A 诱导剂可降低布格替尼的血浆浓度,这可能会降低布格替尼的疗效(见【药代动力学】)。应避免布格替尼与强效或中效 CYP3A 诱导剂联合给药。如果无法避免与 CYP3A 中效诱导剂联合给药,则应根据建议调整剂量(见【用法用量】)。
布格替尼对其他药物的影响
CYP3A 底物
布格替尼可降低敏感 CYP3A 底物的浓度。布格替尼与 CYP3A 底物(包括激素避孕药)联合给药可导致敏感 CYP3A 底物的浓度降低和疗效丧失(见【孕妇及哺乳期妇女用药】)。
Penn Pharmaceutical Services Ltd
86979422000137,86979422000144,86979422000120
布格替尼为酪氨酸激酶抑制剂,在临床可达到的浓度下对包括 ALK、ROS1、胰岛素样生长因子-1 受体(IGF-1R)、FLT-3 以及 EGFR 缺失和点突变等多种激酶具有体外抑制作用。
在体外和体内试验中,布格替尼可抑制 ALK 的自身磷酸化和 ALK 介导的下游信号蛋白STAT3、AKT、ERK1 / 2 和 S6 的磷酸化。布格替尼还可抑制表达 EML4-ALK 和 NPM-ALK融合蛋白细胞株的体外增殖,剂量依赖性的抑制 EML4-ALK 阳性的非小细胞肺癌小鼠异种移植瘤的生长。
在临床可达到的浓度下(≤500 nM),布格替尼可体外抑制表达 EML4-ALK 的细胞以及与 ALK 抑制剂耐药相关的 17 种突变体(包括克唑替尼耐药、EGFR-Del(E746-A750)、ROS1-L2026M 、FLT3-F691L 和 FLT3-D835Y)细胞的活性。布格替尼对 4 种 EML4-ALK突变体可见体内抗肿瘤活性,包括在给予克唑替尼后进展的非小细胞肺癌患者中发现的G1202R 和 L1196M 突变体。布格替尼可减少颅内植入 ALK 驱动的肿瘤细胞株小鼠的肿瘤负荷并延长其生存期。
尚不清楚布格替尼的暴露量-反应关系和药效学反应的时间过程。
遗传毒性
布格替尼 Ames 和体外染色体畸变试验结果阴性,大鼠体内红细胞微核试验结果阳性。
生殖毒性
布格替尼尚未进行专门的生育力试验。在重复给药动物试验中,观察到睾丸毒性(暴露量相当于人用剂量 180 mg 暴露量的 0.2 倍),包括大鼠睾丸、精囊和前列腺重量降低,睾丸小管变性,2 个月的恢复期未见恢复;猴睾丸体积变小,伴随显微镜下可见精子生成不足,恢复期间可见恢复。
在胚胎-胎仔发育试验中,妊娠大鼠于器官发生期每日给予布格替尼,可见剂量相关性的骨骼异常(骨化不全、切牙小),12.5 mg/kg/日(以 AUC 计,约为人用剂量 180 mg Q.D.的 0.7 倍)剂量下可见内脏异常。25 mg/kg/日(以 AUC 计,约为人用剂量 180 mg Q.D.的1.26 倍)剂量下可见致畸性,包括全身水肿(全身皮下水肿)、无眼畸形、前肢过度屈曲、四肢小/短和/或弯曲、多处肋骨融合、肩胛骨弯曲、脐疝(肠突出入脐部)和腹裂(通过腹壁缺损的肠突出),伴随侧脑室中度双侧扩张。
致癌性
布格替尼尚未进行致癌性试验。
TKI 初治晚期 ALK 阳性 NSCLC(ALTA 1L 研究)
在既往未接受过 ALK 靶向治疗的晚期 ALK 阳性 NSCLC 成人患者中开展的一项随机(1:1)、开放性、多中心试验(ALTA 1L,NCT02737501)证实了布格替尼的疗效。该研究要求患者基于当地标准进行 ALK 重排检测。允许入组的局部晚期或转移性疾病患者既往至多接受过 1 种化疗方案,并要求 ECOG 体能状态为 0-2。伴有稳定的经治或未经治的中枢神经系统 (CNS) 转移(包括软脑膜转移)患者均可参加研究。排除了有间质性肺病、药物相关肺炎或放射性肺炎病史的患者。主要疗效结局指标为盲态独立审查委员会(BIRC)根据实体瘤疗效评价标准(RECIST v1.1)评价的无进展生存期(PFS)。BIRC 评价的其他疗效结局指标包括确认的总缓解率(ORR)、缓解持续时间(DOR)、颅内 ORR和颅内 DOR。
共有 275 例患者随机接受 布格替尼 180 mg 口服给药,每日一次,前 7 天导入期的剂量为 90 mg 每日一次(n = 137)或克唑替尼 250 mg 口服给药,每日两次(n = 138)。在275 例入组患者中,239 例使用伴随诊断(Vysis ALK 分离 FISH 探针试剂盒)检测的结果为阳性;20 例患者的中心检测结果为阴性,16 例患者的中心检测结果不可用。
随机化按 CNS 转移(存在 vs 不存在)和既往化疗用于治疗局部晚期或转移性疾病(是,否)分层。
总体研究人群的基线人口统计学特征为:中位年龄 59 岁(范围:27-89 岁,32%为65 岁及以上),59% 白人和 39% 亚裔,55% 女性,39% ECOG PS 为 0 和 56% ECOGPS 为 1,58% 为从不吸烟者。总研究人群的疾病特征为:93% 为 IV 期疾病;27% 针 对局部晚期或转移疾病接受过化疗;14% 接受过 CNS 放疗;31% 有骨转移;20% 有肝转移。35%(n = 96)的患者存在 CNS 转移;其中 41 例患者有可测量的 CNS 病灶。
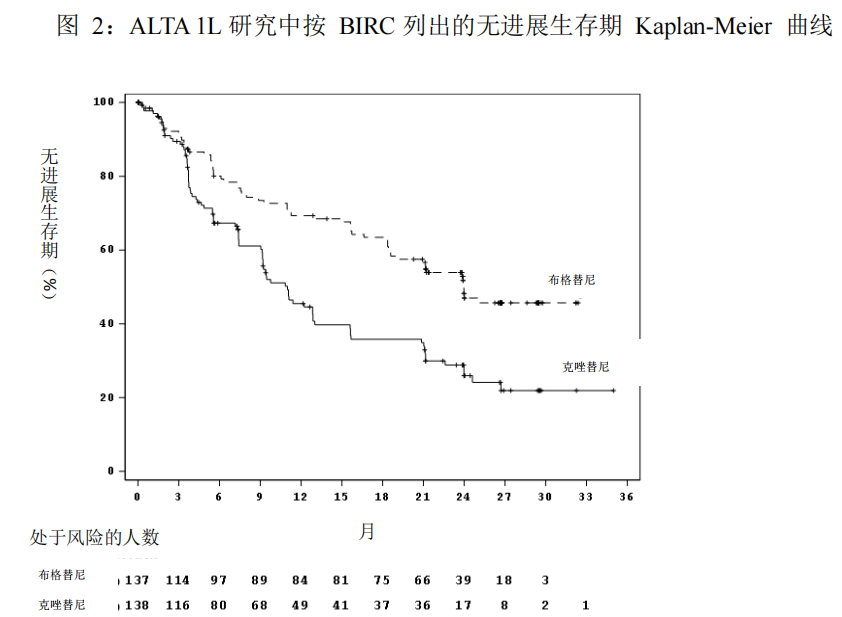
根据 BIRC,ALTA 1L 研究结果显示 PFS 统计学显著改善。本研究的疗效结果见表 7和图 2。
在数据截止点,总生存期数据尚不成熟。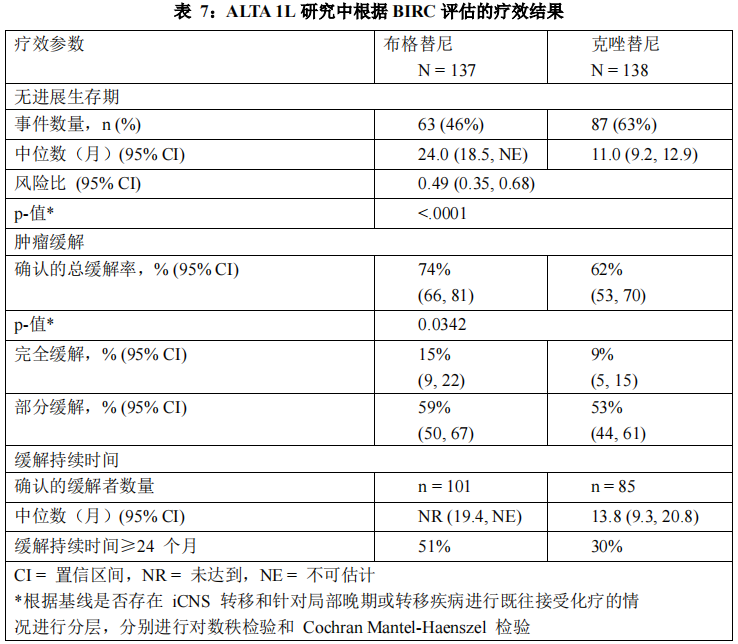
在 41 例基线时有可测量 CNS 转移(最长直径≥10 mm)的患者亚组中,根据RECIST v1.1,BIRC 对确认的颅内 ORR 和颅内 DOR 的评估汇总于表 8。测量了从首次颅内缓解日期至颅内疾病进展(新病灶、颅内靶病灶直径较最低值增长≥20%,或颅内非靶病灶明确进展)或死亡的颅内缓解持续时间。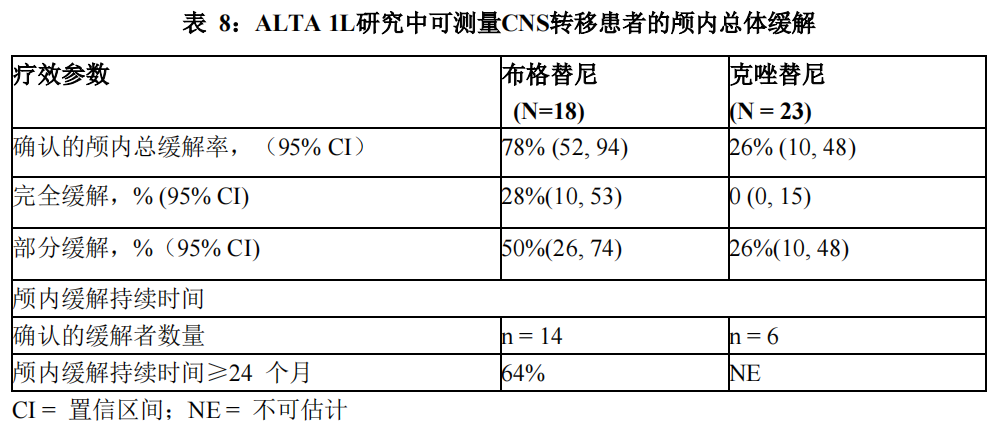
既往接受克唑替尼治疗的 ALK 阳性晚期或转移性 NSCLC
在克唑替尼治疗进展后的局部晚期或转移性 ALK 阳性非小细胞肺癌(NSCLC)成人患者中开展的一项两组、开放性、多中心试验(ALTA,NCT02094573)证实了 布格替尼的疗效。该研究要求患者有根据 FDA 批准的检测记录的 ALK 重排,或根据不同检测且具有足够存档组织并通过 Vysis®ALK 分离荧光原位杂交(FISH)探针试剂盒检测确认了ALK 排列。关键合格性标准包括 ECOG 体能状态为 0-2 和克唑替尼治疗期间疾病进展。允许伴有稳定中枢神经系统(CNS)转移的患者入组。有间质性肺病或药物相关肺炎
病史或在布格替尼首次给药前 3 天内接受过克唑替尼治疗的患者被排除。主要疗效结局指标是根据独立审查委员会(IRC)评价的实体瘤疗效评价标准(RECIST v1.1)确认的总缓解率(ORR)。其他疗效结局指标包括研究者评估的 ORR、缓解持续时间(DOR)、颅内ORR 和颅内 DOR。 共 222 例患者随机接受布格替尼 90 mg 每日一次(90 mg 组;n = 112)或 180 mg 每日一次,7 天导入期后接受 90 mg 每日一次(90→180 mg 组;n = 110)。随机化按CNS 转移(存在 vs 不存在)和克唑替尼既往最佳缓解(完全缓解或部分缓解 vs 任何其他缓解/不可评价)分层。
总体研究人群的基线人口统计学特征为:中位年龄 54 岁(范围 18-82 岁,23%为 65 岁及以上),67% 白人和 31% 亚裔,57% 女性,36% ECOG PS 为 0 和 57% ECOG PS 为 1,95% 从不吸烟者或既往吸烟者。总体研究人群的疾病特征为:98% 的患者为 IV 期疾病,97% 为组织学腺癌,74% 既往接受过全身化疗,69% 为 CNS 转移(61% 既往接受过 CNS 放疗),39% 为骨转移,26% 为肝转移。64% 的患者既往克唑替尼治疗的最佳疗效为客观缓解。
中位随访时间为 8 个月(范围:0.1-20.2)。ALTA 研究的疗效结果总结见表 9。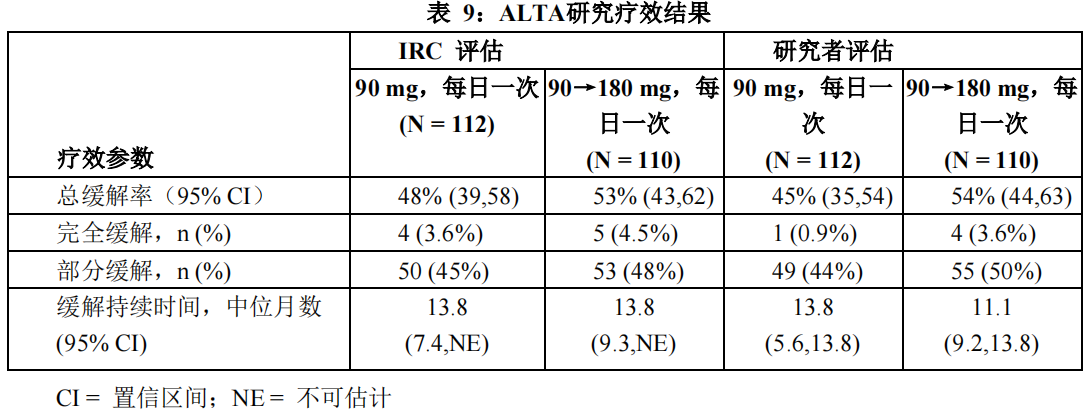
在 44 例基线时存在可测量 CNS 转移(最长直径≥10 mm)的患者亚组中,根据RECIST v1.1,IRC 对颅内 ORR 和颅内 DOR 的评估总结见表 10。测量了从首次颅内缓解日期至颅内疾病进展(新病灶、颅内靶病灶直径较最低值增长≥20%,或颅内非靶病灶明确进展)或死亡的颅内缓解持续时间。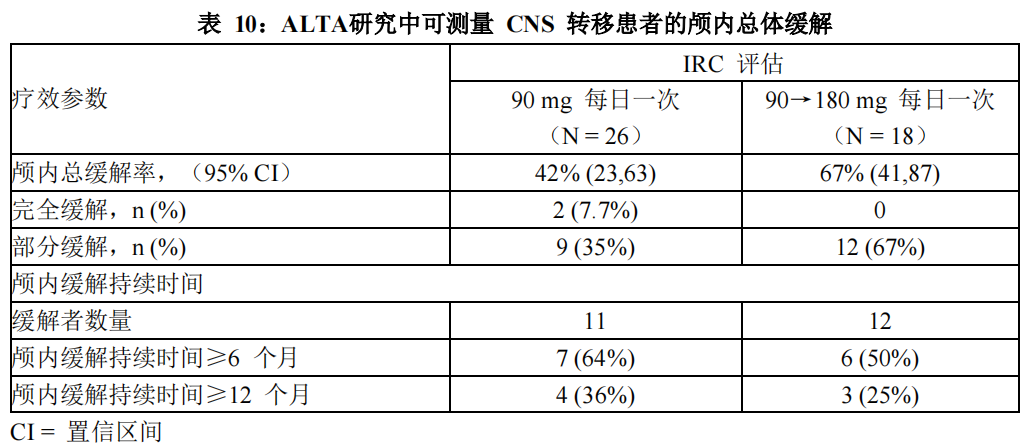
布格替尼在剂量为 90 mg 和 180 mg 每日一次时的几何平均(CV%)稳态最大浓度(Cmax)分别为 552(65%)ng / mL 和 1452(60%)ng / mL,相应的浓度-时间曲线下面积(AUC0-Tau)为 8165(57%)ng·h / mL 和 20276(56%)ng·h / mL。在布格替尼的单剂量和多剂量给药后,在 60 mg(批准剂量 180 mg 的 0.3 倍)每日一次至 240 mg(批准剂量180 mg 的 1.3 倍)每日一次的剂量范围内,布格替尼的全身暴露量与剂量成比例。重复给药后的平均累积比为 1.9-2.4。
吸收
单次口服 30-240 mg 剂量的布格替尼后,达峰浓度的中位时间(Tmax)为 1-4 小时。
食物的影响
与禁食过夜后的 Cmax和 AUC 相比,健康受试者进食在高脂肪餐(约 920 卡路里,58克碳水化合物,59 克脂肪和 40 克蛋白质)后口服布格替尼,布格替尼的 Cmax降低了13%,对 AUC 没有影响。
分布
布格替尼与人血浆蛋白的结合率为 91%,且结合不具有浓度依赖性。血液-血浆浓度比为 0.69。布格替尼 180 mg 每日一次口服给药后,布格替尼稳态时的平均表观分布容积(Vz/F) 为 307 L。
消除
布格替尼 180 mg 每日一次口服给药后,稳态时布格替尼的平均表观口服清除率(CL/F)为 8.9 L/h,平均血浆消除半衰期为 25 小时。
代谢
布格替尼在体外主要通过 CYP2 C8 和 CYP3A4 代谢。健康受试者单次口服 180 mg 放射标记的布格替尼后,N-去甲基化和半胱氨酸结合是两种主要的代谢途径。原型布格替尼(92%)是循环中的主要放射性成分。
排泄
健康受试者口服单剂量 180 mg 的放射物标记布格替尼后,给药剂量的 65%在粪便中回收,给药剂量的 25%在尿液中回收。粪便和尿液中原型布格替尼分别占总放射性标记物的 41% 和 86%。
特殊人群
年龄、种族、性别、体重和白蛋白浓度不会对布格替尼的药代动力学产生任何有临床意义的影响。
肝损害患者
布格替尼 90 mg 单次给药后,对于未结合的布格替尼全身暴露量(AUC0-INF),重度肝损害(Child-Pugh C)受试者比肝功能正常受试者高 37%。对于未结合的布格替尼全身暴露(AUC0-INF),轻度(Child-Pugh A)至中度(Child-Pugh B)肝损害受试者和肝功能正常受试者之间相似 (见【用法用量】)。
肾损害
布格替尼 90 mg 单次给药后,对于未结合的布格替尼全身暴露量(AUC0-INF),与肾功能正常的受试者相比,重度肾损害受试者 [肌酐清除率 (CLcr) 15-29 mL/min] 高 86%。基于群体药代动力学分析,125 例轻度肾损害受试者 (CLcr 60-89 mL/min)、34 例中度肾损害受试者 (CLcr 30-59 mL/min) 和 270 例肾功能正常受试者 (CLcr≥90 mL/min) 的布格替尼暴露相似(见【用法用量】)。
药物相互作用
临床研究
强效和中效 CYP3A 抑制剂对布格替尼的影响:
与布格替尼 90 mg 单独给药相比,伊曲康唑(强效 CYP3A 抑制剂)200 mg 每日两次与布格替尼 90 mg 单次联合给药使布格替尼的 Cmax 增加了 21%,AUC0-INF 增加了101%(见【用法用量】【药物相互作用】)。预计 CYP3A 中效抑制剂可使布格替尼的 AUC 增加约 40%。
强效 CYP2 C8 抑制剂对布格替尼的影响:
与单独给予 90 mg 剂量的布格替尼相比,同时给予 600 mg 每日两次剂量的吉非罗齐(一种强效 CYP2 C8 抑制剂)和单次 90 mg 剂量的布格替尼使布格替尼的 Cmax 降低了 41%,AUC0-INF 降低了 12%。吉非罗齐对布格替尼药代动力学的影响无临床意义,布格替尼暴露量降低的潜在机制尚不清楚。
强效和中效 CYP3A 诱导剂对布格替尼的影响:
与单独给予 180 mg 剂量的布格替尼相比,每日给予 600 mg 剂量的利福平(一种强效 CYP3A 诱导剂)与单次给予 180 mg 剂量的布格替尼可使布格替尼的 Cmax 降低60%,AUC0-INF 降低 80% (见【用法用量】【药物相互作用】)。预计 CYP3A 中效诱导剂可使布格替尼的 AUC 降低约 50%。
体外研究
布格替尼对 CYP 酶的影响:
布格替尼在临床相关血浆浓度下通过激活孕烷 X 受体 (PXR) 诱导 CYP3A。在有临床意义的浓度下,布格替尼也可能通过相同的机制诱导 CYP2C 酶。
在有临床意义的浓度下,布格替尼不抑制 CYP1A2、2B6、2 C8、2 C9、2 C19、2D6 或 3A4/5。 P-糖蛋白和 BCRP 抑制剂对布格替尼的影响:
布格替尼是外排转运蛋白 P-糖蛋白(P-gp)和乳腺癌耐药蛋白(BCRP)的底物。鉴于布格替尼 在体外表现出高溶解度和高渗透性,P-gp 和 BCRP 抑制剂不太可能增加布格替尼的血浆浓度。
其他转运蛋白对布格替尼的影响:
布格替尼不是有机阴离子转运多肽(OATP1B1、OATP1B3)、有机阴离子转运蛋白(OAT1、OAT3)、有机阳离子转运蛋白(OCT1、OCT2)、多药及毒素外排转运蛋白(MATE1、MATE2K)或胆盐输出泵(BSEP)的底物。
布格替尼对转运蛋白的影响:
布格替尼在体外是 P-gp、BCRP、OCT1、MATE1 和 MATE2K 的抑制剂。因此,布格替尼可能增加同时给予这些转运蛋白底物的浓度。在临床相关浓度下,布格替尼不会抑 制 OATP1B1、OATP1B3、OAT1、OAT3、OCT2 或 BSEP。
片剂
(1) 30mg;(2) 90mg;(3) 180mg
铝塑泡罩包装 30mg:28 片/盒(14 片/板,2 板/盒) 90mg:7 片/盒(7 片/板,1 板/盒),28 片/盒(7 片/板,4 板/盒) 180mg:28 片/盒(7 片/板,4 板/盒)
不超过 30℃保存
36 个月
国药准字HJ20220019,国药准字HJ20220020,国药准字HJ20220021

