长春海伯尔 人干扰素α2b 注射液说明书
Human Interferon α2b Injection
人干扰素α2b
人干扰素α2b ,辅料为:聚山梨醇酯80和苯甲醇。
无色澄明液体
1、用于治疗某些病毒性疾病,如慢性病毒性肝炎(丙型和乙型)。
2、用于治疗某些肿瘤,如毛细胞白血病、慢性粒细胞白血病、多发性骨髓瘤,喉乳头状瘤、低中度非何杰金氏淋巴瘤、肾癌,恶性黑色素瘤。
本品首选皮下注射,也可肌肉注射:
1、慢性丙型肝炎:推荐剂量为每次300~500万IU,每周3次(隔日注射),3~6个月为一疗程,医生也可根据患者的具体情况而调整剂量。
2、毛细胞白血病:推荐剂量为每次300万IU,每周3次(隔日注射)。医生可根据患者的具体情况而调整剂量。通常经过1-2个月的治疗后表现出疗效,其后可进行间歇治疗,使病情长期缓解。
3、慢性粒细胞白血病:推荐剂量按体表面积每日300万IU/㎡,血象缓解后可进行维持治疗,隔日注射1次,医生可根据患者的具体情况而调整剂量。
4、慢性乙型肝炎:推荐剂量为300~500万IU,每日或者隔日皮下注射1次,3~6个月为一个疗程,医生可以根据患者的具体情况而调整剂量。
5、多发性骨髓瘤:在化疗部分或完全缓解后,300万IU每周3次,直至好转。
6、喉乳头状瘤:推荐剂量按体表面积每日300万IU/㎡,皮下注射,每周3次(隔日1次),于外科(激光)切除瘤体组织后开始给药。可根据患者对本品的耐受程度调整剂量。治疗应答需要6个月以上的治疗。
7、低中度非何杰金氏淋巴瘤:作为诱导或维持治疗,推荐剂量为300~500万IU/㎡,隔日皮下或肌肉注射,每周3次。根据患者的耐受性,酌情将剂量逐周增加至最大耐受量,8~12周为一个疗程。若未出现病情加剧或严重的不耐受反应,这一剂量应持续治疗至少12个月。医生可根据患者具体情况而调整剂量。
8、肾细胞癌:推荐剂量皮下或肌肉注射300~1000万IU,每周3次,与化疗药物合用。
9、恶性黑色素瘤:推荐剂量每次600万IU肌肉注射,每周3次,与化疗药物合用。
1、使用本品最常见的不良反应有发热、寒战、乏力、头痛、肌肉酸痛、关节痛、厌食等类似流感样症状,加服解热镇痛药(扑热息痛等)可以减轻或消除这些症状,这些症状也可以随着继续用药或调整剂量而减缓。
2、使用本品常见的血液学指标异常有白细胞、血小板减少和转氨酶增高。
的见JIrong射 20123、使用本品一旦发生过敏反应,应立即停止用药,并给予适当的治疗。
4、本品给药剂量在≥600万IU的患者可能会出现重度不良反应,需加强监测。下表为国外(古巴)1169例患者临床试验观察的不良反应结果: 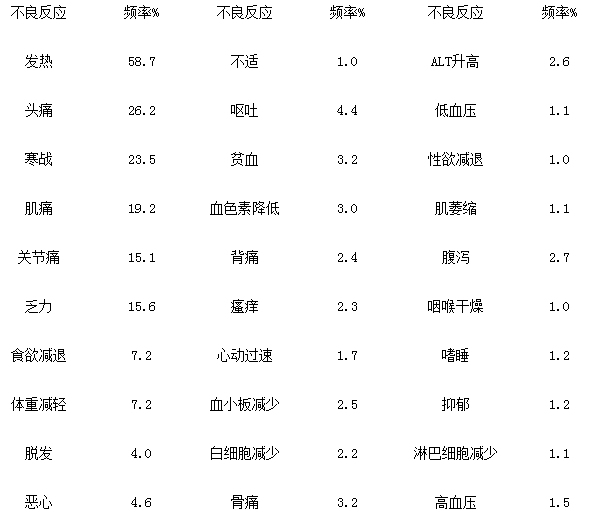
5、文献报道,α型干扰素的其它不良反应包括:知觉损害、精神错乱、眩晕、运动失调、感觉异常、焦虑、紧张、一过性皮疹;以及少见的大腿痉挛、便秘、失眠、疱疹、皮疹、荨麻疹、潮热、鼻衄、口炎、麻痹性肠绞痛、凝血性疾病(凝血酶原时间和部分凝血酶致活酶时间的延长)、易激惹、咳嗽、疖肿和视觉异常;还有罕见的体位性低血压、皮肤红斑、消化不良、紫癜、呼吸困难、注射部位反应和发炎,眼球运动麻痹、鼻塞、腹胀,唾液增多、高血糖和溃疡性口炎。
1、对人干扰素α2b或本制剂的任何成份有过敏史者禁用。
2、严重的心、肝、肾及骨髓功能不正常的患者、中枢神经系统功能紊乱患者忌用本品。
1、患者发生的不良反应常出现在用药初期,多为一过性和可逆性反应:如发生中等程度至严重的不良反应,可考虑调整患者的用药剂量或对某些病例停止使用本品。在使用本品的全过程中注意监测不良反应。
2、心血管病患者、原有精神障碍的患者需要使用本品时,应密切注意患者反应。
3、对于支气管狭窄、红斑狼疮、牛皮癣、遗传性过敏皮炎、重症肌无力或者甲状腺炎等病史患者慎用本品。
4、为避免可能的污染,对于任何已开启的药瓶,在抽取所需剂量药液后应弃去。如遇药瓶有裂缝或药液有浑浊现象时,不得使用。
本品的不良反应与使用剂量有关。当使用剂量大于1000万IU/㎡时会出现重度不良反应,对这类出现嗜睡、低血压、虚脱和昏迷等症状的患者必须停药并给予适当的支持治疗。
尚无资料表明给妊娠期妇女使用本品是否会对胎儿造成影响,只有当用药对母体的益处大于对胎儿的潜在危险时方可使用本品。尚无资料显示使用本品后干扰素是否经母乳分泌。哺乳期妇女需要用药时应考虑本品对母亲的重要程度,来决定是否终止哺乳或终止用药。由于对18岁以下的患者使用本品的经验有限,需要使用本品时应慎重权衡利弊。 本品含苯甲醇,禁止用于儿童肌肉注射。本品未进行该项实验且无可靠参考文献。
本品未进行该项研究且无可靠参考文献,尚未有充分数据可评价本品与其他药物之间的相互作用。
本品与其他潜在的骨髓抑制药物联合应用时应谨慎;本品与麻醉药、催眠或镇静药物合用时应谨慎。
长春海伯尔生物技术有限责任公司
86903311000038,86903311000045,86903311000014,86903311000021
本品具有广谱抗病毒、抗肿瘤及免疫调节作用。临床前细胞培养系统和动物异种肿瘤移植试验结果显示,重组人干扰素a2b具有抗肿瘤增殖作用,在体外有明显的免疫调节作用。体外研究还表明,重组人干扰素a2b可抑制病毒复制。
干扰素通过与细胞表面的特异性膜受体相结合而产生上述作用。多项研究提示,干扰素一旦与细胞受体结合,便可以启动一系列复杂的细胞内过程,其中包括对某些酶的诱导。据认为,这一过程至少在某种程度上导致了干扰素的各种细胞反应,包括抑制病毒感染细胞中病毒的复制、抑制细胞增殖及一系列免疫调节作用,如增强巨噬细胞和淋巴细胞对靶细胞的特异性细胞毒作用。干扰素的治疗作用涉及以上某种或全部作用机制。
在体外抗病毒试验中,α干扰素可抑制人肝胚细胞瘤细胞系(HB611)的乙肝病毒DNA,并能消除持续存在于人胚(肺)成纤维细胞中的甲肝病毒感染。
已知干扰素具有种属特异性。
生殖毒性:
干扰素可能损伤生育力。在灵长类动物研究中观察到,使用干扰素的动物月经周期出现异常。据报道,使用人白细胞干扰素进行治疗的妇女体内血清雌二醇和黄体酮的浓度降低。因此除非在用药期间采取有效的避孕措施,育龄妇女不应使用本品。育龄男性应慎用本品。
在恒河猴中的研究表明,本品剂量为人用肌肉或皮下注射推荐剂量(200万国际单位(IU)/m2)的90-180倍时有堕胎作用。虽然各剂量组(750万国际单位(IU)、1500万国际单位(IU)和3000万国际单位(IU)/kg)均出现流产,但与对照组相比,仅在中剂量和高剂量组(相当于人用肌肉或皮下注射推荐剂量200万国际单位(IU)/m2的90-180倍)具有统计学意义。已知高剂量的其它类型的干扰素α或β可使恒河猴产生剂量相关的排卵停止和流产。目前尚无在孕妇进行的充分及严格对照的临床研究,只有确实认为本品潜在临床利益大于对胎儿潜在危险性,孕妇才可以使用本品。孕妇不能进行本品膀胱内给药。
目前尚不清楚本品是否可以从人乳汁中分泌。由于本品可能对哺乳期婴儿产生不良反应,因此,应考虑本品对授乳母亲的重要性,决定停止哺乳或停止用药。
尚未进行本品的药代动力学研究。
注射剂
600万IU/0.6ml;1000万IU/1.0ml;300万IU/0.3ml/支;500万IU/0.5ml/支
药液装在管制抗生素瓶内,丁基橡胶塞加带有聚丙烯罩的铝制易拉盖密封包装。1支/盒。
2~8℃避光保存和运输。
自生产之日起,有效期为 24 个月。
国药准字S20113009,国药准字S20113008,国药准字S20060089,国药准字S20070003

