艾可宁说明书
Albuvirtide for Injection
艾博韦泰
本品主要成分:艾博韦泰
化学名称:乙酰-色-谷-谷-色-天-精-谷-异亮-天胺-天胺-酪-苏-(N-{2-[2-(N-(3-顺丁烯二酰亚胺丙酰)氨基)乙氧]乙氧}乙酰)赖-亮-异亮-组-谷-亮-异亮-谷-谷-丝-谷胺-天胺-谷胺-谷胺-谷-赖-天胺-谷-谷胺-谷-亮-亮酰胺
化学结构式: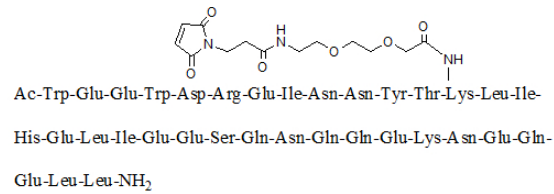
分子式:C204H306N54O72
分子量:4666.93
本品无药用辅料。
本品为类白色或淡黄色疏松块状物或粉末。
艾博韦泰是一种人类免疫缺陷病毒(HIV-1)融合抑制剂。
1.给药方案
成人及16岁以上青少年患者:本品配制后静脉滴注,320mg/次,第1、2、3、8天每天一次,此后每周一次。
2.配制方法
1)取100ml0.9%氯化钠注射液1瓶(袋),用一次性注射器抽取12ml氯化钠注射液弃去,其余备用。
2)取本品2瓶,用2ml(或2.5ml)一次性注射器分别抽取5%碳酸氢钠注射液加入注射用艾博韦泰瓶中,每瓶1.2ml,立即轻轻振摇直到溶解。溶解过程约需要几分钟。如果振摇过程中发生固体黏附瓶壁现象,则需要倾斜瓶子振摇,让溶液充分与附壁固体接触,如20分钟后仍有不溶颗粒物,则弃去该瓶药物,另取一瓶配制。
3)药品完全溶解后,向每瓶注射用艾博韦泰瓶中加入约6ml备用的0.9%氯化钠注射液,摇匀。然后抽出该溶液加入备用的0.9%氯化钠注射液瓶(袋)中,混合均匀即可。
4)配制的注射用艾博韦泰溶液需立即静脉滴注,不得冷藏、冷冻,如果配制完成后30分钟内未开始使用,应丢弃不用。
注:配药时要严格遵守无菌操作规程。
3.静脉滴注给药速度及注意事项
1)配制的注射用艾博韦泰溶液总量约90ml,以约2ml/分钟的速度静脉滴注,45±8分钟内完成给药。
2)配制的注射用艾博韦泰溶液应该是无色或淡黄色、澄清、透明、无颗粒物。如果在给药前或给药过程中观察到颗粒物析出,应丢弃不用。
艾博韦泰共完成2项I期,1项II期临床试验及1项III期临床试验(中期分析结果),试验共入选294例HIV感染受试者,其中170例使用了艾博韦泰。主要安全性数据基于一项进行中的随机、对照Ⅲ期临床试验(TALENTstudy),试验组为艾博韦泰(每周一次静脉给药)和洛匹那韦/利托那韦(LPV/r)两药组合,对照组为三药组合(LPV/r+替诺福韦(TDF)或齐多夫定(AZT)+拉米夫定(3TC)),治疗已接受抗病毒治疗的HIV-1感染者。中期数据分析总结了试验组93例和对照组99例治疗24~48周的安全性数据。
不良反应
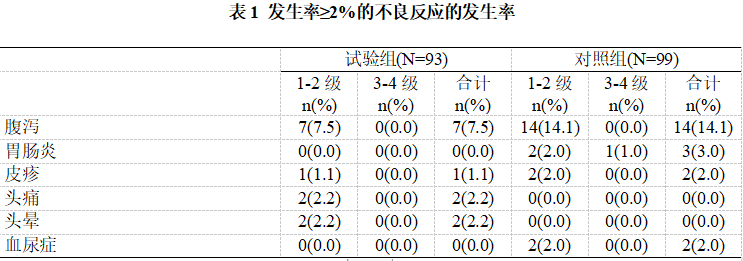
表1总结了发生率≥2%的临床不良反应,其中试验组常见的不良反应为腹泻、头痛、头晕和皮疹。
实验室检查及辅助检查异常结果
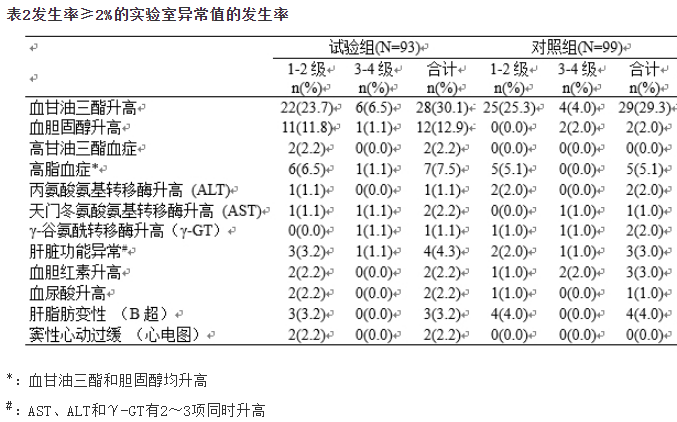
表2总结了发生率≥2%的与研究药物相关的实验室异常值。很常见的为血甘油三酯升高和血胆固醇升高;常见为高脂血症、高甘油三酯血症、丙氨酸氨基转移酶升高、天门冬氨酸氨基转移酶升高、γ-谷氨酰转移酶升高、高胆红素血症和血尿酸升高等。以上异常以轻、中度升高(1~2级)为主,其中血总胆固醇升高的发生率试验组高于对照组,其他异常组间差异无统计学意义。
对本品过敏者禁用。
1、本品溶解后应为澄清透明溶液,如有混浊、沉淀、异物,均不可使用。
2、本品溶解配制后的溶液应一次滴注完毕,不得分次使用。
目前尚无艾博韦泰在人体过量使用的信息。临床试验中6位HIV感染者接受过最高单次640 mg静脉滴注给药,未发生药物相关不良反应。目前尚无针对艾博韦泰过量的特异性解毒剂。
在大鼠和家兔生殖毒性试验中,静脉注射艾博韦泰剂量分别达成人剂量的4倍和2倍,未发现对亲代生育力和胚胎发育的毒性。尚无艾博韦泰用于孕妇的临床研究数据,不建议本品用于孕妇。艾博韦泰是否通过人类乳汁分泌尚不清楚。感染HIV的产妇不应哺乳婴儿,以避免HIV传播。哺乳期妇女在接受本品治疗时不应哺乳。目前尚未明确本品在儿童患者中的安全性和有效性。 尚未确立本品用于16岁以下未成年人的安全性和有效性。本品的临床研究未包括足够数量的65岁及以上的受试者,不能确认他们使用本品后的效应是否较年轻受试者有所不同。
体外人肝微粒体试验显示,艾博韦泰不是CYP450酶抑制剂,对人肝微粒体酶CYP1A2、2C8、2C9、2C19、2D6 和3A4活性没有明显的抑制作用。
在体外联合用药抗HIV-1病毒试验中,本品与齐多夫定(AZT)和沙奎那韦(SQV)具有协同作用,与依非韦仑(EFV)和恩夫韦肽(T20)表现为相加作用。
艾博韦泰与洛匹那韦/利托那韦(Lopinavir/Ritonavir,LPV/r)联合用药没有改变艾博韦泰的药代动力学特征,LPV/r体内暴露量降低但不需要调整剂量。
前沿生物药业(南京)股份有限公司
86982358000010
作用机制:
艾博韦泰为 HIV-1 融合抑制剂,以 gp41 病毒膜蛋白为靶点,抑制病毒包膜与人体细胞膜的融合。
抗病毒活性:
在体外试验中评价了艾博韦泰-白蛋白结合物的抗病毒活性。艾博韦泰在 PBMCs 中对 8 种 HIV-1 亚型病毒(A、B、C、EA 和 G 重组子)的 IC50 为 0.5~4.8 nM。艾博韦泰对中国 28 个流行株 CRF07-BC、CRF01-AE、和 B’亚型的平均 IC50 值为 5.2 nM、6.9 nM 和 9.5 nM。
采用免疫缺陷小鼠移植人体胚胎胸腺与肝细胞后再感染 HIV-1 病毒的体内药效学模型(SCID-hu Thy/Liv 小鼠)评价了艾博韦泰皮下注射给药的体内抗病毒活性,10 mg/kg 艾博韦泰每日和隔日皮下给药 1 次(大致相当于小鼠白蛋白的 2 个和 4 个半衰期间隔),均显示了明显的抗病毒活性。
耐药性:
体外诱导耐药试验显示艾博韦泰的耐药障碍较高,病毒传代至第 9 代产生了对艾博韦泰的耐药性,敏感性降低 159 倍,并与恩夫韦肽有交叉耐药,主要突变位点是 Q40K、N126K 和 K144I
艾博韦泰Ⅲ期临床试验中期数据显示,5 例 HIV-1 感染者接受艾博韦泰和 LPV/r 联合治疗 24~48 周后 HIV-RNA>400 copies/ml,其 HIV 病毒的 gp41 序列未发现与融合抑制剂相关的耐药突变。
交叉耐药:
体外试验显示,7 株在第 36、38、42、43 蛋白位点有基因突变的对恩夫韦肽耐药的实验室 HIV-1 病毒株均对艾博韦泰敏感。
遗传毒性:
艾博韦泰的Ames试验、体外CHL细胞染色体畸变试验和小鼠骨髓微核试验结果均为阴性。
生殖毒性:
在大鼠生育力和早期胚胎发育毒性试验中,Wistar大鼠分别静脉给予艾博韦泰30、60、120mg/kg,各组雄鼠从交配前4周至解剖给药,雌鼠从交配前2周至妊娠第8天给药,每2天1次。结果未见艾博韦泰对雌、雄大鼠生育力及胚胎形成发育有干扰或毒性作用,对亲代大鼠的生殖功能毒性、胚胎形成及发育的未见明显毒性剂量(NOAEL)均为120mg/kg,以体表面积计,为成人剂量的4倍。
在大鼠胚胎-胎仔发育毒性试验中,妊娠Wistar大鼠于妊娠第6~16天每2天1次经静脉给予艾博韦泰30、60、120mg/kg,艾博韦泰对孕鼠、胚胎及胎仔外观、骨骼及内脏指标均未见明显异常改变,对亲代孕鼠、胚胎及胎仔发育的未见明显毒性剂量(NOAEL)均为120mg/kg,以体表面积计,为成人剂量的4倍。毒代动力学显示,艾博韦泰在孕鼠体内未见明显蓄积。
在兔胚胎-胎仔发育毒性试验中,妊娠兔于妊娠第6~18天每3天1次经静脉给予艾博韦泰15、30、60mg/kg,除60mg/kg组孕兔有1只(1/13)动物早产,舌骨骨化不全百分率较对照组有升高趋势之外,其余孕兔及胎兔的外观、骨骼及内脏指标均未见明显异常改变。艾博韦泰对亲代孕兔、胚胎及胎仔发育的未见明显毒性剂量(NOAEL)均为30mg/kg,以暴露量计,为成人剂量的3.9倍。毒代动力学显示,艾博韦泰在孕兔体内未见明显蓄积。
艾博韦泰的有效性评价主要基于一项剂量探索研究和一项进行中的疗效确证性研究(TALENTstudy)。
剂量探索研究采用开放、平行研究设计,评价不同剂量艾博韦泰联合洛匹那韦/利托那韦(LPV/r)治疗HIV-1感染者的有效性和安全性。入组20例HIV-1感染者,在LPV/r基础上,分别使用160mg和320mg两个剂量的艾博韦泰,以病毒载量变化作为主要指标评价有效性。结果显示,艾博韦泰联合LPV/r治疗后,所有20名受试者HIV-RNA均有明显下降,CD4水平有不同程度的升高,且320mg组抗病毒效果明显优于160mg组。
确证性研究(TALENTstudy)采用多中心、开放、随机对照、非劣性设计,评价注射用艾博韦泰联合洛匹那韦/利托那韦(LPV/r)治疗一线失败的HIV-1感染者的安全性和有效性。受试者为已经接受了抗HIV一线药物治疗并失败的HIV-1感染者和艾滋病患者,计划入组420例,治疗周期为48周,期间接受7次访视。给药方案为:试验组为艾博韦泰注射剂+LVP/r,第1、2、3、8天每天一次及其后的每周一次,连续治疗48周;对照组使用三药组合即洛匹那韦/利托那韦+替诺福韦或齐多夫定+拉米夫定(LPV/r+TDF或AZT+3TC)。主要疗效指标:研究终点48周HIV-RNA水平<50copies/ml的受试者百分比,采用SnapshotApproach方法评价;次要疗效指标:治疗后HIV-RNA对数值的变化、治疗后HIV-RNA水平<400copies/mL的百分率、治疗后CD4细胞计数的变化。
中期数据分析总结了试验组83例和对照组92例治疗24~48周的有效性数据。
在治疗48周时,FAS集试验组和对照组主要疗效指标HIV-RNA<50copies/ml受试者百分率分别为80.4%和66.0%,组间差值的双侧95%CI为-3.0~31.9%,以预设的非劣性界值12%为标准,非劣性检验合格,试验组疗效不劣于对照组,见表3。PPS集试验组和对照组HIV-RNA<50copies/ml受试者百分率分别为94.9%和74.4%,有统计学差异(P<0.05),表明试验组疗效优于对照组。
回归分析(logistic)显示,受试者性别、基线病毒载量和CD4计数水平对48周HIV-RNA<50copies/ml百分率均无显著影响,不影响治疗效果。艾博韦泰能有效控制100,000copies/ml以上高病毒载量感染者和CD4细胞计数低于100个/μl的感染者的病毒复制,见表3。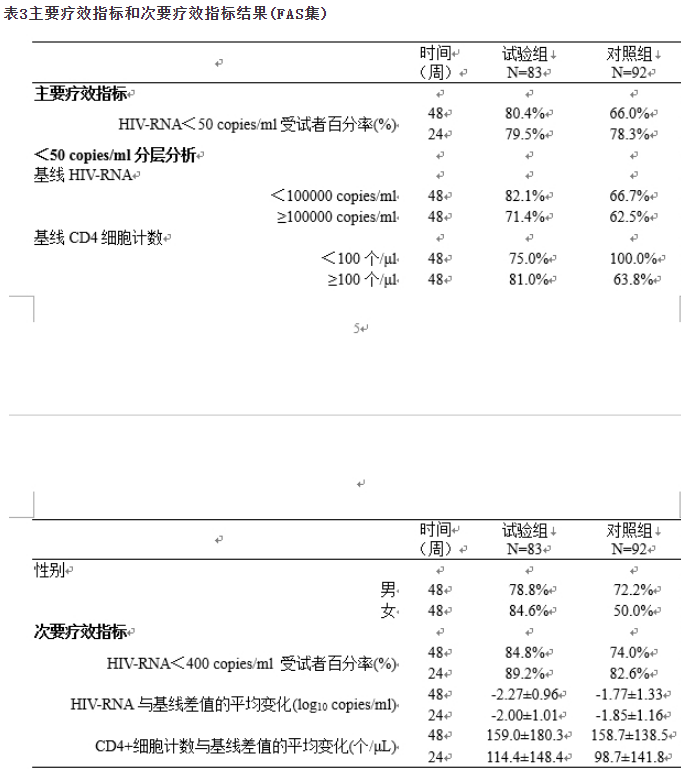
治疗24周时,FAS集试验组和对照组主要疗效指标HIV-RNA<50copies/ml受试者百分率分别为79.5%和78.3%,组间差值的双侧95%CI为-10.8~13.4%,以预设的非劣性界值12%为标准,非劣性检验合格,试验组疗效不劣于对照组,组间差异无统计学意义,P>0.05。PPS集与FAS集结果一致。
其他次要指标包括治疗前后HIV-RNA对数值的变化、治疗后HIV-RNA水平<400copies/mL的百分率、治疗前后CD4细胞计数的变化与主要疗效指标的结果基本一致。
已在成人 HIV-1 感染者中进行单次和多次静脉给药的艾博韦泰药代动力学研究。受试者单次静脉滴注 320 mg 艾博韦泰,药代动力学参数 AUC0-∞为 3012.6±373.0 mg•h/L、Cmax 61.9±5.6 mg/L。AUC0-∞与剂量之间呈良好的线性关系,艾博韦泰符合线性消除规律。
HIV-1 感染者每周一次静脉滴注 320 mg 艾博韦泰,稳态药代动力学参数 AUC0-∞为 4946.3±407.1 mg•h/L、Cmax为 57.0±7.9 mg/L、谷浓度 Ctrough为 6.9 mg/L。
大鼠分布、排泄试验表明,艾博韦泰可较好的分布到体内各个组织器官,在全血中的含量最高,其次是肾和卵巢组织,其余组织药物含量较少,以脑、体脂和睾丸最少。其体内主要消除途径为经肾脏排泄。
体外试验显示,艾博韦泰对人肝微粒体中六种主要 P450 代谢酶(CYP1A2、2C8、2C9、2C19、2D6 和 3A4)的体外活性没有明显影响。
特殊人群
性别和种族:
艾博韦泰药代动力学无性别差异,药代动力学的种族差异尚未确定。
儿童和老年患者:
尚未在 16 岁以下儿童和 65 岁以上老年人中进行药代动力学研究。
肝和肾功能不全:
尚未在肝、肾功能不全患者中进行药代动力学研究。
注射剂
160mg(以C204H306N54O72计)
20ml棕色低硼硅玻璃管制注射剂瓶装,1瓶/盒。
避光,密封,冷冻(-20±5℃)保存。
1984元起
24个月
国药准字H20180006
国家基本医疗保险和工伤保险药品


