曼海欣说明书
Group ACYW135 Menningococcal Conjugate Vaccine (CRM197)
脑膜炎球菌多糖
A群C群脑膜炎球菌多糖结合疫苗(CRM197载体),系用A群和C群脑膜炎奈瑟球菌英膜多糖抗原,经衍生或活化后与白喉毒素无毒突变体CRM197蛋白共价结合为多糖蛋白结合物,加入蔗糖、甘露醇后冻干制成,为白色疏松体。不含佐剂。有效成分: A群和C群脑膜炎球菌荚膜多糖。辅料:蔗糖、甘露醇。
Y群W135群脑膜炎球菌多糖结合疫苗(CRM197载体),系用Y群和W135群脑膜炎奈瑟球菌荚膜多糖抗原,经活化后与白喉毒素无毒突变体CRM197蛋白共价结合为多糖蛋白结合物,加入氯化钠、磷酸氢二钾三水合物、磷酸二氢钾溶液制成,为澄明液体。不含佐剂。有效成分: Y群和W135群脑膜炎球菌荚膜多糖。辅料:氯化钠、磷酸氢二钾三水合物、磷酸二氢钾。
A群C群脑膜炎球菌多糖结合疫苗(CRM197载体)按标示量加入Y群W135群脑膜炎球菌多糖结合疫苗(CRM197 载体)后迅速复溶为澄明液体,无异物。
本品为白色疏松体,加入所附稀释液复溶后为无色澄明液体。
[接种对象]
3月龄~3周岁(47月龄)儿童。
[作用与用途]
接种本品可刺激机体产生抗A群、C群、Y群和W135群脑膜炎奈瑟球菌的免疫力,用于预防A群、C群、Y群和W135群脑膜炎奈瑟球菌引起的流行性脑脊髓膜炎。
(1)接种前应将Y群W135群脑膜炎球菌多糖结合疫苗(CRM197载体)澄明液体注入装有A群C群脑膜炎球菌多糖结合疫苗(CRM197载体)的西林瓶内进行复溶,充分摇匀后立即使用。
(2)于上臂三角肌肌肉注射0.5ml,婴儿可在大腿前外侧区肌肉注射。
(3)推荐以下免疫程序:
3~5月龄:基础免疫3剂次,建议自3月龄开始,每剂次间隔1个月,可在12月龄时加强注射1 剂次;
6~23月龄:免疫2剂次,每剂次间隔1~3个月;
2~3周岁(47月龄):免疫1剂次。
6~23月龄是否需要进行加强免疫尚未确定。
1.本品境内临床不良反应
在境内开展的临床试验对本品的安全性进行了评价,其中试验组1377名3月龄~3周岁受试者至少接种了1剂本品,对照组1133名受试者至少接种了1 剂已.上市同类疫苗。
本研究系统的安全性观察自首剂疫苗接种开始至全部剂次接种后30天,长期安全性观察自接种后30天至不低于6个月。
本品不良反应按照国际医学科学组织委员会(CIOMS)推荐的下列标准进行分类:“十分常见”是指发生率≥10%;“常见” 是指发生率1~10% (含1%) ;“偶见” 是指发生率0.1~1% (含0.1%)。
接种部位不良反应:
常见:红斑、肿胀、疼痛;
偶见:硬结、瘙痒、疹(注射部位)。
全身不良反应:
十分常见:发热;
常见:腹泻、咳嗽、易激惹(哭闹)、呕吐、嗜睡(疲劳、乏力);
偶见:恶心、惊厥、哺乳或进食障碍、斑疹、红斑、皮疹、丘疹、瘙痒症、斑丘疹、湿疹、水泡疹、剥脱性皮炎。
2.同类疫苗的其他不良反应
国内外同类多糖疫苗或结合疫苗的临床研究中还发现头疼、肌痛、不适、关节痛、寒颤、厌食等症状。极罕见过敏性皮疹、过敏性休克和过敏性紫癜等。
3.除上述不良反应外,其它同类产品在上市使用后还报告了接种部位蜂窝组织炎、低血压、上呼吸道肿胀、眩晕、口咽痛、面部神经麻痹、平衡障碍、眼睑下垂等不良事件。
这些不良事件来源于接种其它产品后的自发报告,实际发生频率及与其他同类产品的关系无法确定。
有下列情况者,不得使用本品:
1.已知对疫苗的某种成分过敏,尤其是对白喉类毒素过敏者,或者先前接种本品过敏者。
2.患癫痫、脑部疾病者及有惊厥史者。
3.患严重慢性疾病、慢性疾病的急性发作期、急性传染病及发热者。
1.使用前检查包装容器、标签、外观、有效期是否符合要求,如包装容器有裂缝、瓶塞有松动、标签有脱落、瓶内有异物颗粒或变色者以及超过有效期等情况均不得使用。
2.疫苗一经开启,应立即使用。每1人份制品溶解后,应一次用完,不得分多次使用。
3.注射器针头不可刺破血管,严禁静脉或动脉内注射。
4.接受本品注射者在注射后应在现场观察至少30分钟。接种现场应备有肾上腺素等药物,以备偶有发生严重过敏反应时急救用。
5.接受免疫抑制治疗者、免疫缺陷患者或HIV感染者注射本品可能影响疫苗的免疫效果。
本品尚未进行与其它疫苗同时接种的临床试验,暂无相关数据。
康希诺生物股份公司
86981576000055
本疫苗系用A、C、 Y、W135群奈瑟氏脑膜炎球菌培养液,经提纯获得的英膜多糖抗原,纯化后加入适宜稳定剂(乳糖)冻干制成。目前在国内仅推荐本品在以下范围内2周岁以上儿童及成人的高危人群使用。
在境内开展的II期临床试验采用随机、盲法、同类疫苗对照的非劣效研究设计。其中,3~5月龄组720人,按照1:1 比例接种3剂本品或对照疫苗; 6~23 月龄组(间隔1个月接种2剂程序) 720 人,按照1:1比例接种2剂本品或对照疫苗; 6~23 月龄组(间隔3个月接种2剂程序) 480人,按照3:1比例接种2剂本品或对照疫苗; 2~3 周岁组590人,按照1:1比例接种1剂本品或对照疫苗。完成免疫程序后30天,通过TTC法(triphenyltetrazoliumchloride)采用兔补体进行杀菌力试验(Serum Bactericidal Assay, SBA)测定受试者血清中A群、C群、Y群和W135群脑膜炎球菌抗体,主要评价各年龄组相应群的脑膜炎球菌杀菌抗体阳转率、抗体几何平均滴度(GMT),同时评价抗体滴度21:128的比例。评价标准包括3~5月龄、6~23月龄(间隔1个月接种2剂程序)人群的A、C群, 2~3周岁人群A、C、Y、W135群抗体的阳转率非劣效于对照组(试验组与对照组率差95%可信区间下限≥-10%)、GMT非劣效于对照组(试验组与对照组GMT比值95%可信区间下限≥2/3) ;3~5月龄、6~23 月龄人群Y、W135群抗体阳转率95%可信区间下限≥85%。
3~5月龄试验组部分受试者在12月龄接种1剂本品进行加强免疫研究。6~23 月龄组开展了间隔1或3个月接种2剂两种免疫程序的研究,并探索基础免疫后第6和第12个月的免疫持久性;同时分为6~11 月龄和12~23月龄两组进一步分析。
使用的主要免疫原性评价数据集为mPPS,定义为所有随机化入组并按方案要求在接种时间窗内完成了疫苗接种及采血的易感受试者(免前抗体滴度<1:8)构成的数据集。
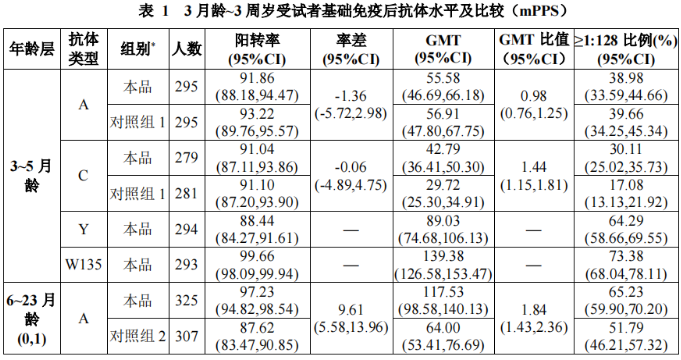
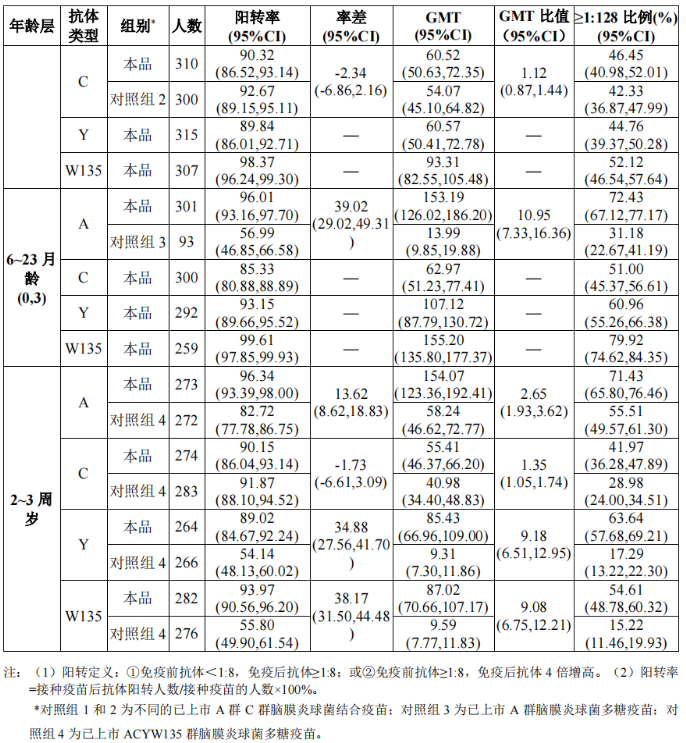
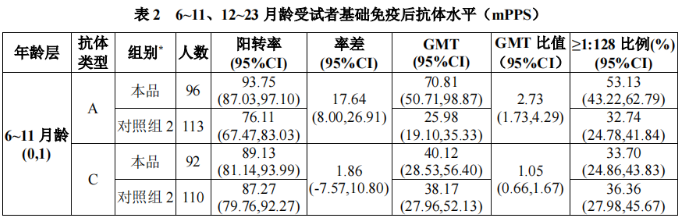
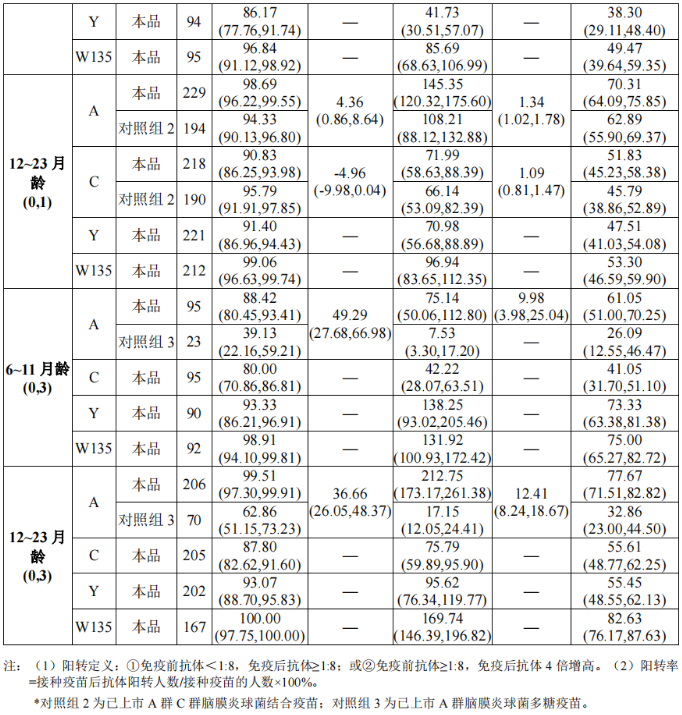
6~23月龄人群中,6~11月龄和12~23月龄组受试者的免疫原性结果如表2:
本品3~5月龄组受试者在12个月龄时加强免疫1剂,以及免疫持久性结果如表3所示:
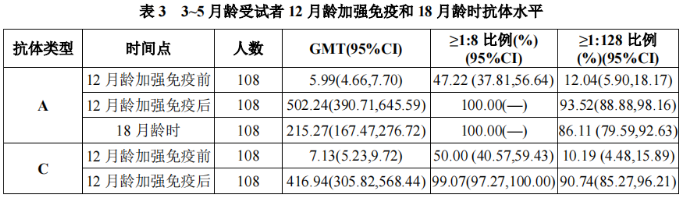
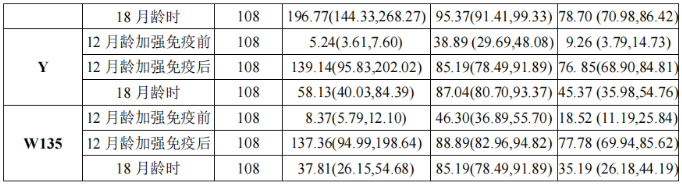
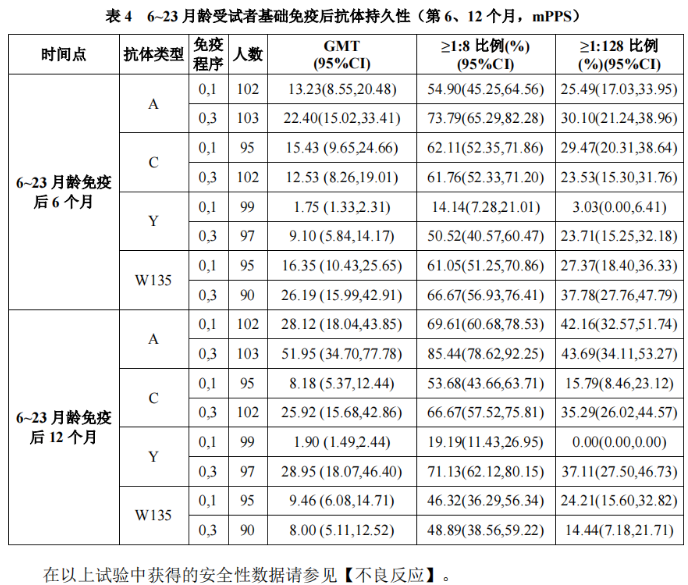
本品6~23月龄组,按照间隔1个月接种2剂程序和按照间隔3个月接种2剂程序,免疫后6个月和12个月免疫持久性结果如表4所示:
注射剂
按标示量复溶后每瓶0.5ml,每1次人用剂量0.5ml,含A群、C群结合多糖各10μg,含Y群、W135群结合多糖各5μg。
本产品为西林瓶包装,每盒内装1瓶冻干粉剂A群C群脑膜炎球菌多糖结 合疫苗(CRM197载体)和1瓶液体制剂Y群W 135群脑膜炎球菌多糖结合疫苗(CRM197 载体) 。
于2~8C避光保存和运输。
24个月
国药准字S20210054

