希维奥(XPOVIO)说明书
Selinexor Tablets
塞利尼索
本品主要成份为塞利尼索。
化学名称:(2Z)-3-{3-[3,5-二(三氟甲基)苯基]-1H-1,2,4-三唑-1-基}-N’-(吡嗪- 2-基)丙基-2-烯酰肼
化学结构式: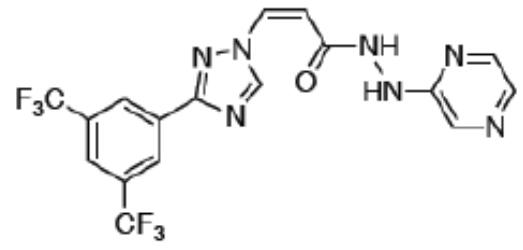
分子式:C17H11F6N7O
分子量:443.31
辅料:微晶纤维素,交联羧甲基纤维素钠,聚维酮 K30,胶态二氧化硅,硬
脂酸镁,十二烷基硫酸钠,薄膜包衣预混剂。
本品为蓝色双凸圆形薄膜衣片,一面刻有“K20”字样,另一面无刻字。
本品与地塞米松联用,适用于既往接受过治疗且对至少一种蛋白酶体抑制剂,一种免疫调节剂以及一种抗 CD38 单抗难治的复发或难治性多发性骨髓瘤成人患者
本品基于境外数据以及在中国开展的一项单臂临床试验期中数据获得附条件批准上市,治疗中国患者的有效性和安全性尚待上市后进一步确证。
须在具有多发性骨髓瘤治疗丰富经验的医师监督下开始治疗并进行监测。
推荐剂量
本品推荐剂量为每次80 mg,每周第1和第3天口服。
地塞米松的推荐剂量为20 mg,每周第1和第3天与本品一起口服。
持续治疗直至疾病进展或出现不可耐受的毒性。
本品应在每个服药日大致相同时间服用,片剂应整片用水送服。不应破坏、咀嚼、压碎或切分片剂。可以餐后或空腹服用。
如果患者漏服或错过规定服药时间,应在下一个常规服药时间服用下一次剂量。
如果患者服药后发生呕吐,无需补服,应在下一个常规服药时间服用下一次剂量。
使用注意事项
在首次服药前和治疗期间,根据临床指征,监测患者的全血细胞计数、标准血清生化、体重、营养状况和液体容量状况。在治疗期前 3 个月适当增加监测频率(见【注意事项】)。根据不良反应,评估本品剂量调整的必要性。
建议患者在治疗期间维持摄取充分的液体和热量。存在脱水风险的患者可考虑静脉补液治疗(见【注意事项】)。
在首次服用本品前和治疗期间,给予 5-HT3 受体拮抗剂和/或其他止吐药物(见【注意事项】)。
剂量调整
本品针对不良反应的剂量调整见表1。

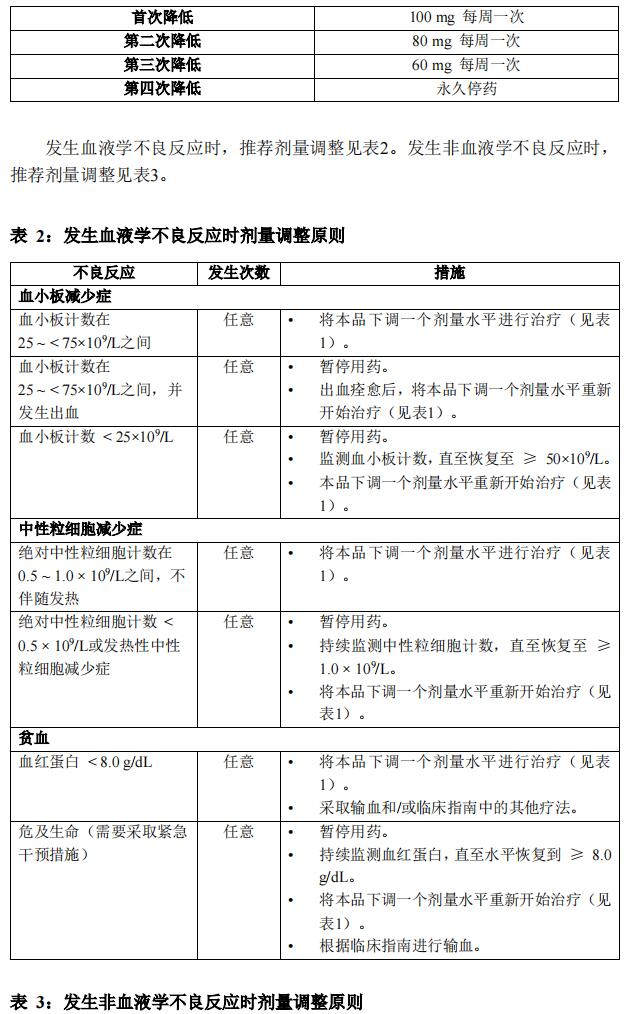
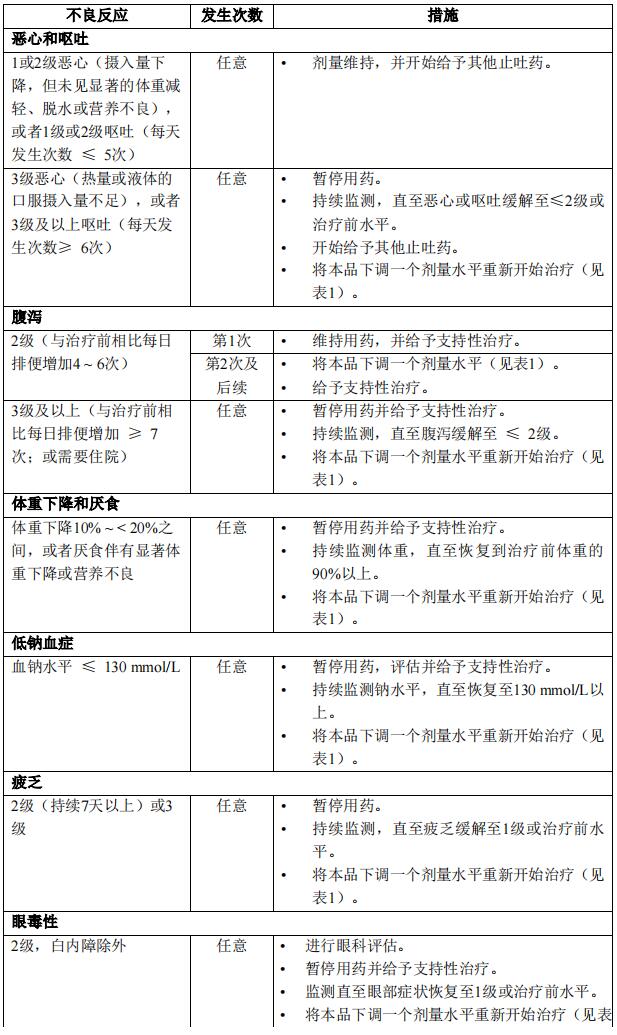
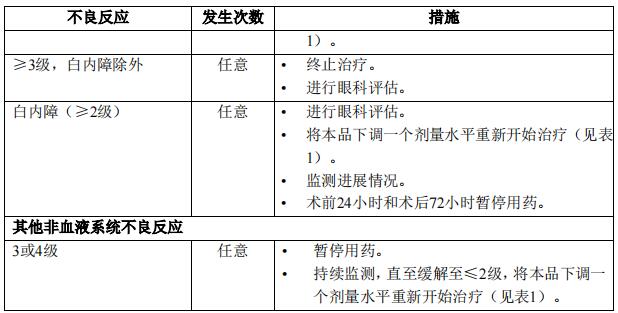
特殊人群
肾功能损伤
轻度、中度或重度肾功能损伤患者无需调整本品剂量。
尚无本品在终末期肾病或血液透析患者的研究数据。
肝功能损伤
轻度肝功能损伤患者无需调整本品剂量。
尚无本品在中度或重度肝功能损伤患者的研究数据。
老年人
老年患者无需调整本品剂量(见【老年用药】)。
儿童
尚无本品用于18岁以下患者的临床研究资料。
安全性特征概述
已经在214例多发性骨髓瘤患者(包括83例五药难治疾病患者)中评估了本品联合地塞米松的安全性。最常见的不良反应(≥30%)为恶心(75%)、血小板减少症(75%)、疲乏(66%)、贫血(60%)、食欲下降(56%)、体重下降(49%)、腹泻(47%)、呕吐(43%)、低钠血症(40%)、中性粒细胞减少症(36%)和白细胞减少症(30%)。
最常报告的严重不良反应(≥3%)为感染性肺炎(7.5%)、脓毒症(6.1%)、血小板减少症(4.7%)、急性肾损伤(3.7%)和贫血(3.3%)。
临床试验经验
由于临床研究是在不同条件下开展的,某种药物临床研究中观察到的不良反应发生率不能与在另一种药物临床研究中观察到的不良反应发生率直接比较,且可能无法反映临床实践中观察到的发生率。
STORM研究
在STORM研究中评估了本品联合地塞米松的安全性(见【临床试验】)。
患者在每周第1和第3天口服本品80 mg和地塞米松20 mg(n=202)。本品治疗的中位持续时间为8周(范围:1~ 60周)。中位剂量为115 mg(范围:36~ 200 mg)/周。
致命性不良反应的发生率为9%。58%的患者发生了严重不良反应。
27%的患者因不良反应而终止治疗;53%的患者因不良反应而降低剂量,65%的患者因不良反应而暂停用药。血小板减少症是导致剂量调整的主要原因,>25%的患者因此降低剂量和/或暂停给药。在接受本品治疗的患者中,最常见的导致≥4%的患者永久停药的不良反应包括疲乏、恶心和血小板减少症。
表4汇总了STORM研究中的不良反应。
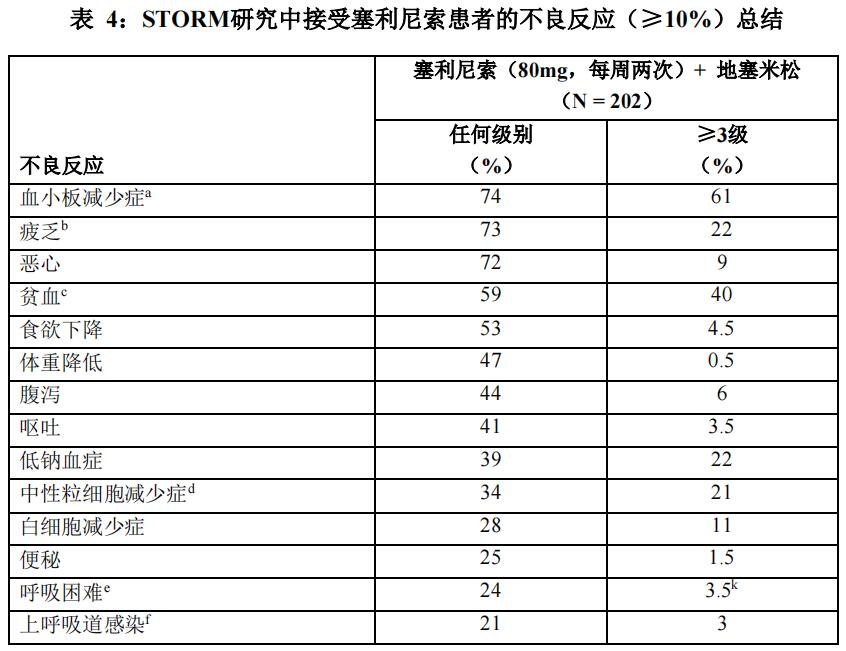
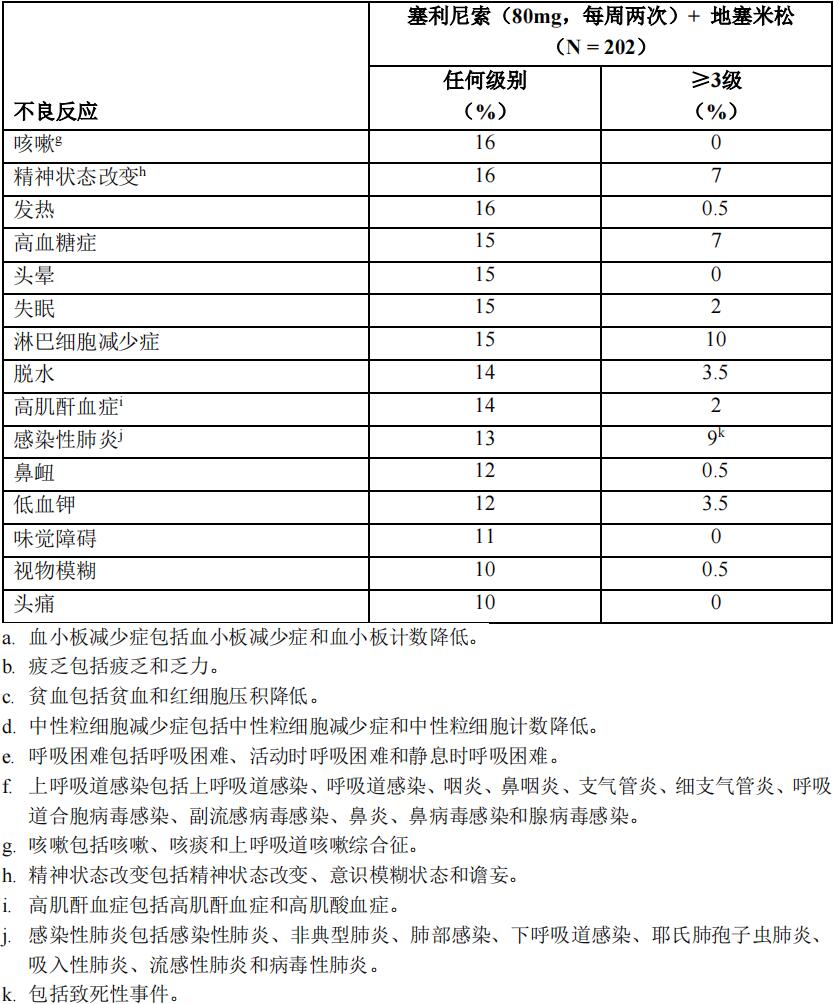
在接受本品治疗的患者中,<10%患者发生的有临床意义的不良反应包括:
损伤:跌倒(8%)
代谢及营养类疾病:脱水(7%)
神经疾病:头痛(4.5%)、晕厥(2.2%)
感染:脓毒症(6%)、疱疹病毒感染(3%)
眼器官疾病:白内障(3.7%)
血液和淋巴系统疾病:发热性中性粒细胞减少症(3%)
心脏器官疾病:心力衰竭(3%)
特定不良事件描述
感染
感染是最常见的非血液系统毒性;53%的患者发生感染,其中22%为3级或4级。最常报告的感染是上呼吸道感染和感染性肺炎(分别有15%和13%的患者)。25%的患者发生严重感染,仅3%的患者发生致命性感染。
感染导致7%的患者终止给药,19%的患者暂停给药,1%的患者降低剂量。
血小板减少症
75%的患者发生血小板减少症,5%的患者发生严重血小板减少症。65%的患者发生3级或4级的血小板减少症,这些患者中5%报告并发严重和/或3级及以上的出血事件(并发被定义为±5天)。
血小板减少症导致3%的患者终止给药,22%的患者暂停给药,32%的患者降低剂量。
可以通过剂量调整、支持性治疗和血小板输注控制血小板减少症。应监测患者的出血症状和体征,并及时进行评价(见【用法用量】)。
中性粒细胞减少症
36%的患者发生中性粒细胞减少症,其中25%为3级或4级。1%的患者发生严重中性粒细胞减少症。无患者因中性粒细胞减少症而终止治疗,中性粒细胞减少症导致2%的患者中断治疗,6%的患者减少剂量。
3%的患者发生发热性中性粒细胞减少症,均为3级或4级。据报告,2%的患者发生严重的发热性中性粒细胞减少症,分别有不到1%的患者终止治疗、中断治疗或减少剂量。发生3级及以上中性粒细胞减少症的53例患者中,6例(11%)患者报告并发严重和/或3级及以上感染(并发被定义为±5天)。最常报告的3级及以上并发感染包括尿路感染(3例患者)和脓毒症(2例患者)。
贫血
61%的患者出现贫血,其中44%为3级或4级。3%的患者发生严重贫血。贫血导致少于1%的患者终止治疗,4%的患者暂停用药,1%的患者减少剂量。
可以根据医学指南,通过调整剂量和输血和/或促红细胞生成素给药来控制贫血。关于剂量调整原则,见【用法用量】。
胃肠道毒性
79%的患者出现恶心/呕吐,其中10%为3级或4级,3%的患者出现严重恶心/呕吐。当给予止吐治疗时,恶心或呕吐的中位持续时间缩短了3天。恶心/呕吐导致5%的患者终止治疗,8%的患者暂停用药,5%的患者减少剂量。
47%的患者出现腹泻,其中7%为3级或4级,2%的患者出现严重腹泻。腹泻导致1%的患者终止治疗,2%的患者暂停用药,1%的患者减少剂量。
低钠血症
40%的患者出现低钠血症,其中24%为3级或4级。3%的患者发生严重低钠血症。大部分低钠血症病例未伴有任何症状。未见并发癫痫发作的报告。低钠血症未导致任何治疗终止,导致6%的患者中断治疗,1%的患者降低剂量。
肿瘤溶解综合征
1例(<1%)患者发生3级严重的肿瘤溶解综合征(TLS)。应对有TLS高风险的患者进行密切监测。根据机构指南及时对TLS进行治疗(见【注意事项】)。
对本品主要成份或任何辅料过敏者禁用。
血液学毒性
血小板减少症
本品可引起危及生命的血小板减少症,可能导致出血。血小板减少症是导致剂量调整的主要原因(见【不良反应】)。
接受本品治疗的患者常见报告血小板减少事件(血小板减少症和血小板计数下降),有时是重度的(3/4 级)。3/4 级血小板减少症有时会导致具有临床意义的出血,在极少数情况下可能会导致潜在致命性出血。
血小板减少症可以通过暂停用药、剂量调整、血小板输注和/或根据临床指征的其他疗法来控制。监测患者的出血症状和体征并及时进行评价。关于剂量调整原则,见【用法用量】。
中性粒细胞减少症
本品可引起危及生命的中性粒细胞减少症,可能增加感染风险。已有报告本品引起中性粒细胞减少症,包括重度中性粒细胞减少症(3/4 级)。在少数情况下,发生 3/4 级中性粒细胞减少症的患者会并发感染(见【不良反应】)。
应监测发生中性粒细胞减少症的患者的感染体征,并及时进行评价。可根据医学指南,通过暂停用药、剂量调整和集落刺激因子来控制中性粒细胞减少症。关于剂量调整原则,见【用法用量】。
胃肠道毒性
本品可引起严重胃肠道毒性。恶心、呕吐、腹泻,有时可能是重度的,并且需要使用止吐药和止泻药(见【不良反应】)。
在使用本品治疗前和治疗期间,应给予5HT3受体拮抗剂和/或其他止吐药进行预防。给予含电解质的液体,以防止有风险的患者发生脱水。
可以通过暂停给药、降低剂量和/或停药和/或根据临床指征开始其他止吐药物来控制恶心/呕吐。可以通过剂量调整或给予止泻药物来控制腹泻。
关于剂量调整原则,见【用法用量】。
体重下降/厌食
接受本品治疗的患者常见报告体重下降和厌食事件,少数情况下发生重度(3级)。应在治疗前、治疗期间以及有临床指征时检查患者的体重、营养状态和食量。在治疗的前2个月内应增加监测频率。新发或加重的食欲下降和体重下降的患者可能需要进行剂量调整、食欲刺激和营养咨询。关
于剂量调整原则,见【用法用量】。
严重感染
本品可引起严重和致命性感染。多数感染与3级或3级以上中性粒细胞减少症无关(见【不良反应】)。
本品治疗后报告的非典型性感染包括但不限于真菌性肺炎和疱疹病毒感染。
治疗期间监测感染的体征和症状,及时评估和治疗。
意识模糊状态和头晕
本品可引起危及生命的神经系统毒性。
本品可引起意识模糊状态和头晕。应指导患者避免头晕或意识模糊状态可能引发问题的场合,并指示患者在未得到充分医学建议的情况下,不可服用可能导致头晕或意识模糊状态的其他药物。应建议患者在症状缓解前不要驾驶或操作重型机械。
低钠血症
本品可引起重度或危及生命的低钠血症(见【不良反应】)。应在治疗前、治疗期间以及有临床指征时监测患者的血钠水平。在治疗的前2个月内应增加监测频率。在并发高血糖症(血清葡萄糖> 150mg/dL)和高血清M蛋白水平时,校正血钠水平。应根据医学指南对低钠血症进行治疗(静脉注射氯化钠溶液和/或盐片),包括饮食检查。
患者可能需要暂停给药和/或调整剂量。关于剂量调整原则,见【用法用量】。
肿瘤溶解综合征
已有报告接受本品治疗的患者出现肿瘤溶解综合征(TLS)。应对有TLS高风险的患者进行密切监测。根据机构指南及时治疗TLS。
胚胎-胎儿毒性
基于动物实验获得的数据以及本品的作用机制,孕妇服用本品后可能会对胎儿造成危害。在器官形成期对妊娠动物进行给药,当暴露水平低于临床试验的推荐剂量时,会导致器官结构异常和生长发育改变。
告知孕妇本品对于胎儿的潜在风险。告知育龄女性患者和有生育能力女性伴侣的男性患者,在接受本品治疗期间以及最后一次给药后1周内使用有效的避孕措施(见【孕妇及哺乳期妇女用药】)。
白内障
部分患者在接受本品治疗期间发生了新发白内障或白内障恶化。白内障的治疗通常需手术摘除白内障。
对驾驶和操纵机械能力的影响
本品可能会对驾驶和操纵机械的能力产生重大影响。本品可引起疲乏、意识模糊状态和头晕。应指示患者避免任何头晕或意识模糊状态可能造成安全隐患的场合,并指示患者在未得到充分医学建议的情况下,不要服用可能导致头晕或意识模糊状态的其他药物。应建议患者在出现任何以上症状时避免驾驶或操作机械。
对QTc间期的影响
在既往接受多种治疗的血液肿瘤患者中,评价了本品每周两次且每次最高达 175 mg(获批推荐剂量的 2.2 倍)的多次给药对 QTc 间期的影响。在治疗剂量水平下,本品对 QTc 间期无明显影响(不超过 20 ms)。
一般来说,用药过量与标准给药报告的不良反应相似,通常在 1 周内可逆。
症状
潜在的急性症状包括恶心、呕吐、腹泻、脱水和意识模糊。潜在的其他不良反应还包括血钠水平降低、肝酶升高和血细胞计数下降。应对患者进行密切监测,并酌情提供支持性治疗。迄今为止,没有因用药过量而死亡的报告。
管理
如果用药过量,应监测患者的任何不良反应,并立即提供适当的对症治疗。
避孕 应建议有生育能力的女性在使用本品治疗期间以及末次服药后至少1周内避免怀孕或性生活。建议有生育能力的女性在开始使用本品治疗前进 行妊娠检测。 应建议有生育能力的女性和有生育能力的男性患者在使用本品治疗期间以及末次服药后至少1周内,使用有效的避孕措施或避免性生活,以避免怀孕。 孕妇 首次使用本品进行治疗前,须确认育龄女性的妊娠状态。 目前尚无孕妇使用本品的数据。在动物中进行的研究显示本品会对胎儿造成伤害(见【药理毒理】)。不建议孕妇以及未采取避孕措施的育龄女性使用本品。 如果患者在本品服药期间怀孕,应立即停用本品,并告知患者该药品对胎儿的潜在危害。 生育力 基于动物研究结果,本品可能会损害育龄男性和女性的生育力(见【药理毒理】)。尚不明确本品或其代谢产物是否通过人的乳汁分泌。无法排除对母乳喂养婴儿的风险。在使用本品治疗期间以及末次服药后1周内应停止哺乳。尚未确定本品在 18 岁以下患者中的安全性和有效性。在接受本品治疗的多发性骨髓瘤患者中,47%为 65 岁及以上,11%为 75岁及以上。≥75 岁的患者与<75 岁患者相比,年长患者因不良反应导致治疗终止的发生率更高(52% vs 25%)、严重不良反应的发生率更高(74% vs 59%)、致命不良反应的发生率更高(22% vs 8%)
临床研究
对乙酰氨基酚:与对乙酰氨基酚(日剂量最高 1000 mg)联用时,未观察到本品药代动力学存在有临床意义的差异。
体外研究
CYP酶:塞利尼索不会抑制CYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19或CYP3A4/5。塞利尼索不是CYP3A4、CYP1A2或CYP2B6的诱导剂。
非 CYP 酶系统:塞利尼索是 UDP-葡糖苷酸转移酶(UGTs)和谷胱甘肽 S-转移酶(GSTs)的底物。
转运体系统:塞利尼索抑制OATP1B3,但不抑制其他溶质载体(SLC)转运蛋白。塞利尼索不是P-gp、BCRP、OATP1B1、OATP1B3、OAT1、OAT3、OCT1、OCT2、MATE1或MATE2-K的底物。
Karyopharm Therapeutics Inc.
86983951000018
塞利尼索通过阻滞核输出蛋白 1(XPO1),可逆性抑制肿瘤抑制蛋白(TSPs)、生长调节蛋白和致癌蛋白 mRNA 的核输出。塞利尼索对 XPO1 的抑制作用导致TSPs 在细胞核内积聚,c-myc、细胞周期蛋白 D1(cyclin D1)等癌蛋白减少,细胞周期阻滞和癌细胞凋亡。塞利尼索对多发性骨髓瘤细胞可见体外促凋亡活性,并在多发性骨髓瘤和弥漫性大 B 细胞淋巴瘤的小鼠异种移植模型中可见抗肿瘤活性。塞利尼索联合地塞米松或硼替佐米在体外对多发性骨髓瘤具有协同的细胞毒作用,并增强了对包括蛋白酶体抑制剂耐药在内的小鼠多发性骨髓瘤移植瘤体内模型的抗肿瘤活性。
遗传毒性
塞利尼索在体外细菌回复突变(Ames)试验中显示无致突变性;在人淋巴细胞体外细胞遗传学试验和大鼠体内微核试验中均未导致染色体断裂。
生殖毒性
塞利尼索尚未开展生育力毒性试验。大鼠和猴连续 13 周经口给予塞利尼索重复给药毒性试验中,在≥1 mg/kg 剂量水平下,观察到大鼠附睾和睾丸中的精子、精子细胞和生精细胞减少;在≥2 mg/kg 剂量水平下,观察到大鼠卵巢卵泡减少;在≥1.5 mg/kg 剂量水平下,观察到猴睾丸出现单细胞坏死。这些剂量的系统暴露量分别约为人推荐剂量 80 mg 下暴露量(AUC)的 0.11、0.28 和 0.53倍。
胚胎-胎儿发育试验中,妊娠大鼠于器官发生期间每天经口给予塞利尼索 0、0.25、0.75 或 2 mg/kg,可引起不完整骨化或延迟骨化、骨骼变异。与对照组相比,0.75mg/kg 组(约为推荐剂量下人体曲线下面积[AUC]的 0.08 倍)可见胎儿体重下降,2 mg/kg 剂量下可见畸形,包括小眼症、胎儿水肿、肾异位和永存动脉干。
致癌性
塞利尼索尚未开展致癌性试验。
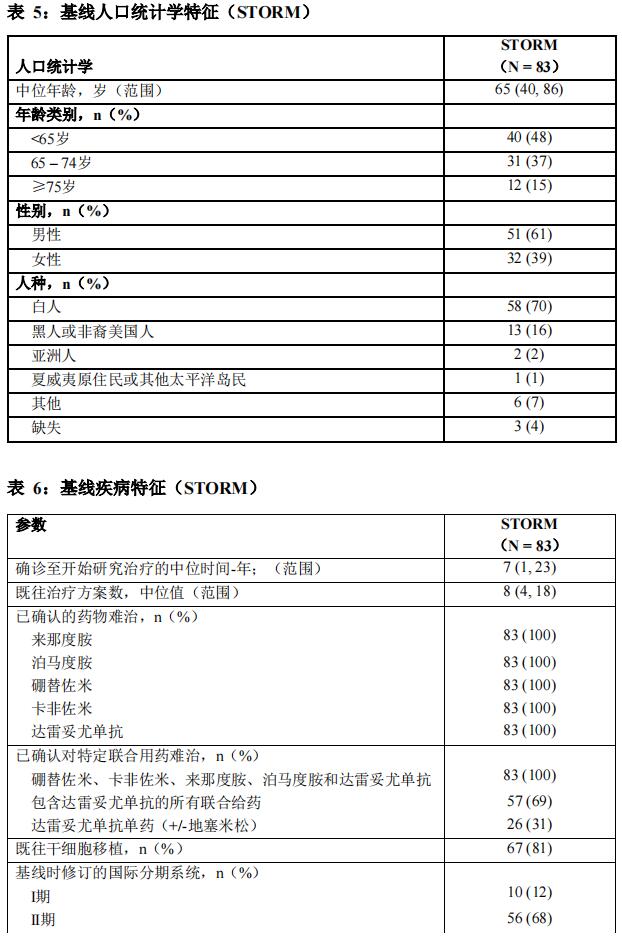
在STORM研究(KCP-330-012;NCT02336815)中评价了本品联合地塞米松的疗效。STORM是一项在复发/难治多发性骨髓瘤患者中开展的多中心、单臂、开放性研究。STORM的第2部分纳入了122例既往接受过3种或以上抗骨髓瘤治疗方案,包括烷化剂、糖皮质激素、硼替佐米、卡非佐米、来那度胺、泊马度胺和抗CD38单克隆抗体;已确认为对糖皮质激素、蛋白酶体抑制剂、免疫调节剂、抗CD38单克隆抗体难治和末线治疗方案难治的复发或难治性患者。
在STORM第2部分中,共有122例患者在每周第1和第3天接受了本品(80 mg)与地塞米松(20 mg)联合给药,持续治疗直至疾病进展、死亡或不可耐受的毒性。83例复发或难治患者为硼替佐米、卡非佐米、来那度胺、泊马度胺和达雷妥尤单抗难治性患者。这83例患者的基线人口统计学
和疾病特征汇总分别见表5和表6。
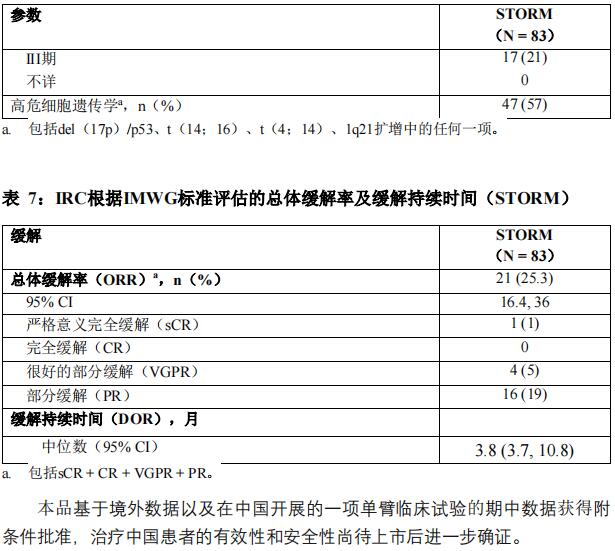
主要疗效评价指标为总体缓解率(ORR),由独立审查委员会(IRC)基于国际骨髓瘤工作组(IMWG)多发性骨髓瘤疗效评估标准进行评估。
本品的批准上市是基于预先设定的83例亚组人群的疗效和安全性数据,此亚组患者对硼替佐米、卡非佐米、来那度胺、泊马度胺和达雷妥尤单抗难治。总体缓解率结果见表7。至首次缓解的中位时间为4周(范围:1~10周)。
缓解的中位持续时间为3.8个月(95% CI:2.3,不可估计)。
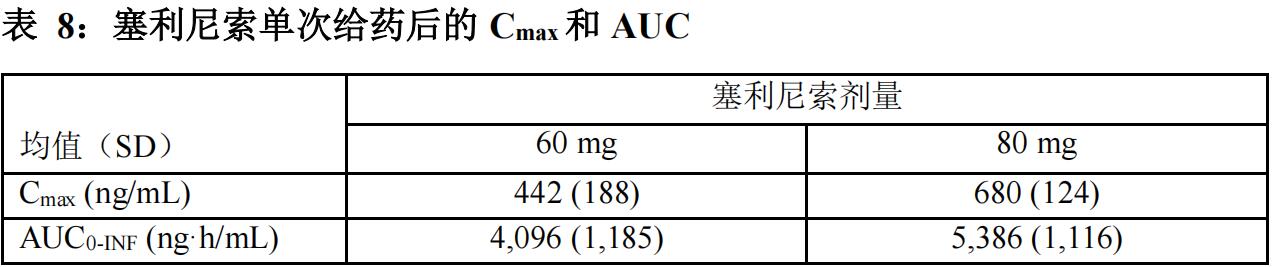
本品在3 mg/m2~85 mg/m2的剂量范围内(基于体表面积1.7 m2,是推荐剂量的0.05至1.44倍)Cmax和AUC随剂量成比例增加。稳态时,未观察到有临床意义的蓄积。表8列出了恶性血液肿瘤患者接受本品单次给药后的Cmax和AUC0-INF。
吸收
本品口服给药后4小时内达到Cmax。同时给予的高脂餐(800~1,000卡路里,饮食中来自脂肪的总卡路里含量约为50%),对于塞利尼索药代动力学的影响不具有临床意义。
分布
癌症患者中塞利尼索的表观分布容积为133 L,蛋白结合率为95%。
消除
本品单次给药后,平均半衰期为6~8小时。癌症患者中塞利尼索的表观总清除率为18.6 L/h。
代谢
塞利尼索通过CYP3A4、多种UDP-葡糖苷酸转移酶(UGTs)和谷胱甘肽S-转移酶(GSTs)代谢。
特殊人群
根据年龄(18~94岁)、性别、体重(36~168kg)、种族、轻度至重度肾功能损害(基于Cockcroft Gault公式估算,CLCR:15~89 mL/min)和疾病类型(血液学非弥漫性大B细胞淋巴瘤、实体瘤和弥漫性大B细胞淋巴瘤),未观察到塞利尼索的药代动力学存在有临床意义的差异。尚不清楚终末期肾病(CLCR <15 mL/min)或血液透析对塞利尼索的药代动力学的影响。轻度肝损害对塞利尼索药代动力学的影响不具有临床意义。尚不清楚中重度肝损害对塞利尼索药代动力学的影响。
片剂
20 mg
聚氯乙烯/聚三氟氯乙烯/聚氯乙烯固体药用复合硬片和药用铝箔包装: 12 片/盒;16 片/盒;20 片/盒;32 片/盒。
不超过 30℃保存。
48 个月。
国药准字HJ20210083

