Kovaltry (科跃奇)说明书
Recombinant Coagulation Factor Ⅷ for Injection
人凝血因子
本品为无菌、稳定、经纯化的无热原的重组人凝血因子Ⅷ。由经遗传学构建的幼年 仓鼠肾(BHK)细胞系产生,该细胞系同时导入人凝血因子VIII基因和人热休克蛋白 70(HSP 70)基因。
活性成份:重组人凝血因子VIII。
辅料:甘氨酸、蔗糖、氯化钠、氯化钙、组氨酸以及聚山梨酯80。
本品为白色至浅黄色粉末。按标示量加入灭菌注射用水,复溶后溶液应为无色澄明液体。
本品适用于成人和儿童 A 型血友病(先天性凝血因子Ⅷ缺乏)患者治疗下列情况:
• 用于常规预防,以降低出血频率
• 出血事件的按需治疗和控制
• 围手术期出血的管理
本品不适用于治疗血管性血友病(von Willebrand)。
本品仅能在复溶后用于静脉注射。
本品儿童患者(<12岁)使用剂量均依据国外临床试验结果而定,尚未积累中国儿童(<12岁)的临床数据。
给药剂量
剂量和治疗持续时间取决于凝血因子VIII缺乏的严重程度、出血部位和程度以及患者的临床状况。实施大手术或发生危及生命的出血事件时,替代疗法的谨慎控制尤为重要。
每瓶本品的标签中均使用国际单位(IU)标定凝血因子VIII效价。依据最新WHO(世界卫生组织)国际标准(IS)定义一个IU的凝血因子VIII浓缩物。
使用显色底物法测定并标定本品的效价。一项在全球41家临床检测实验室进行的研究测定了本品加至血友病患者血浆中的回收率。研究结果表明,依据检测实验室采用的常规方法,无论使用一期凝固法或显色底物法均能够准确测定血浆中本品的凝血因子VIII活性。
可以使用如下所列公式估算实现以IU/dL表示(或正常水平的%)的理想凝血因子VIII水平所需的剂量:
所需剂量(IU)=体重(kg)×期望的凝血因子VIII升幅(正常水平的%或IU/dL)x预计/实测回收率的倒数(例如:每1IU/kg回收2IU/dL,所需剂量为0.5)
可使用如下所列公式估算以IU/dL表示(或正常水平的%)的预测体内凝血因子VIII水平的升幅峰值:
预测凝血因子VIII的升幅(IU/dL或正常水平的%)=[总剂量(IU)/体重(kg)]×2(每1IU/kg回收的凝血因子VIII的IU/dL)
例如(假设患者的基线凝血因子VIII水平<1%):
(1)体重为20kg的儿童所需峰值为50%。在这种情况下,所需的本品剂量为20kgx50IU/dL×0.5(每1IU/kg回收2IU/dL)=500IU
(2)体重50kg的患者中,给予剂量为2000IU的本品,预计注射后凝血因子VIII水平升幅为2000IU/50kg(体重)×2IU/dL每IU/kg=80IU/dL(正常水平的80%)
依据患者的临床应答调整剂量。在不同患者中,药代动力学参数(例如:半衰期、增量回收率)以及对本品的临床应答可能不同。
出血事件的按需治疗和控制
表1中提供了对出血事件进行按需治疗和控制时,本品给药的指导原则。治疗的目的是维持血浆凝血因子VIII活性水平等于或高于表1中所列的血浆水平(正常水平的%或以IU/dL表示)。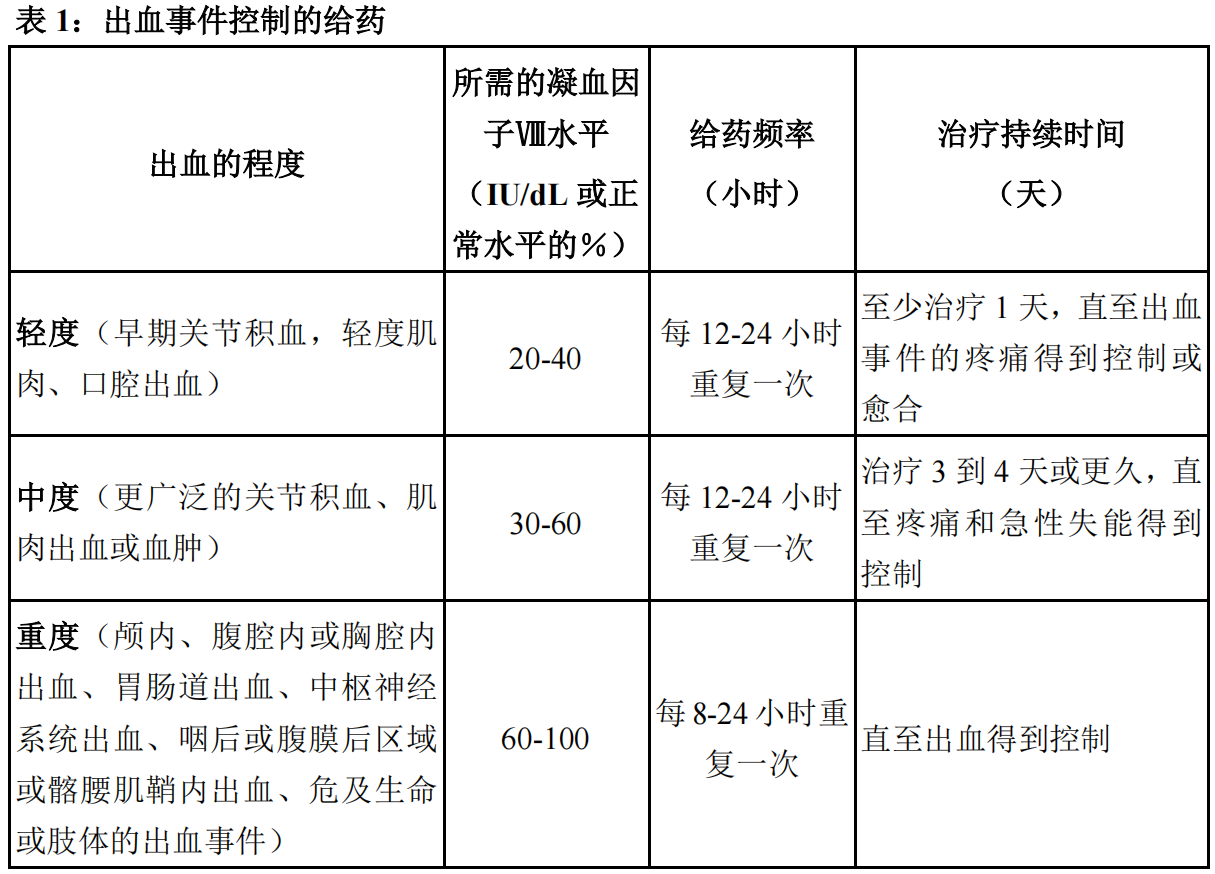
围手术期出血的管理
表2中提供了手术期间(围手术期)本品给药的指导原则。治疗的目标是维持血浆凝血因子VIII活性水平等于或高于表2中所列的血浆水平(正常水平的%或以IU/dL表示)。在实施大手术期间,强烈推荐监测恰当的实验室检测参数,包括连续测定凝血因子VIII的活性(见【注意事项】)。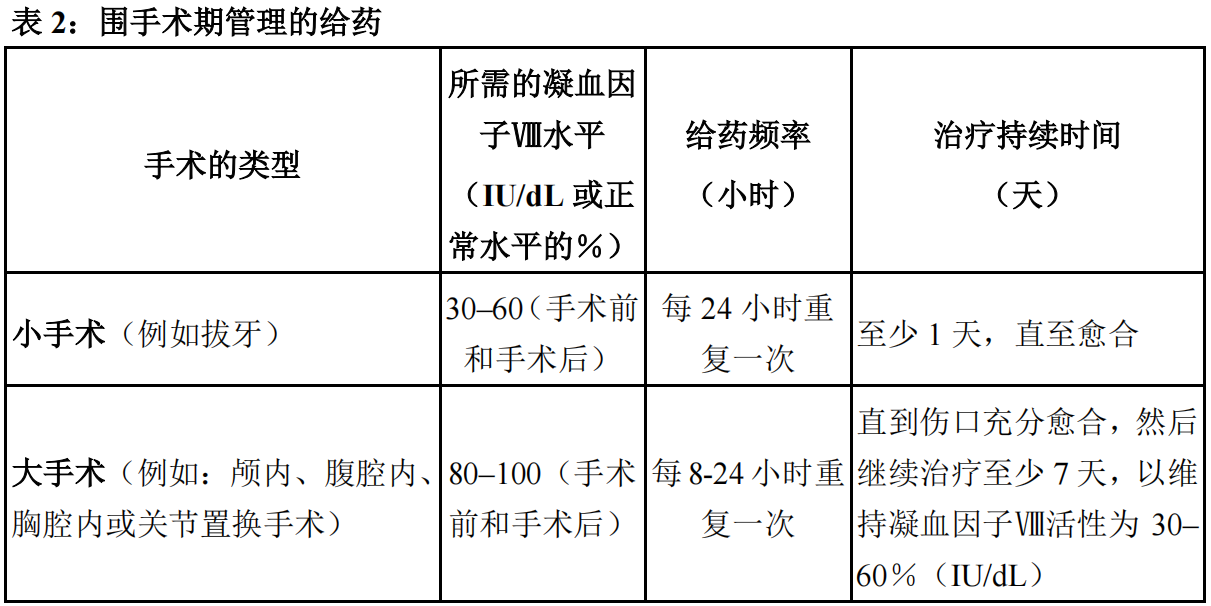
常规预防
依据临床应答为每位患者单独设定剂量。
成年和青少年患者:每公斤体重20至40IU的本品,每周2至3次。
年龄≤12岁的儿童患者:每公斤体重25至50IU的本品,每周2次、每周3次或隔日1次,视每位患者的具体要求而定(见【儿童用药】)
1.给药前的配制及复溶(参见说明书后的附件)
2.给药方法
仅用于静脉注射。
给药之前,肉眼检查经复溶的本品溶液中是否有不溶性微粒或变色。如果观察到溶液中出现任何颗粒物或溶液变色,则不得使用,并且立即请通过拜耳热线(400-810-0360)联系拜耳医学沟通部。
复溶后应尽快将本品进行给药。如果未立即给药,则室温下储存不得超过3小时。
静脉给予本品时,注射时间可为1-15分钟。依据每位患者的应答调整给药速度。
临床试验中最常报告(≥3%)的不良反应为头痛、发热和瘙痒(见表3)。
1.临床试验的经验
在193例曾经接受过治疗且至少接受本品暴露长达3个月的患者(PTPs)(包括51例年龄<12岁的儿童患者)中评价了本品的安全性。通过使用源于3项多中心、前瞻性、开放性临床研究的合并数据库,对本品的安全性进行分析。年龄≥12岁的患者参与研究的中位时间为372天,中位暴露时间(暴露日(EDs)为159个暴露日。年龄<12岁的患者参与研究的中位时间为182天,中位暴露时间为73个暴露日。安全性分析不包括因围手术期管理接受本品治疗2至3周的受试者(n=5)以及在PK研究中接受单次本品治疗的受试者(n=6)。表3中列出了临床研究期间报告的不良反应。在儿童患者中,不良反应的发生率、类型以及严重程度与成人患者相似。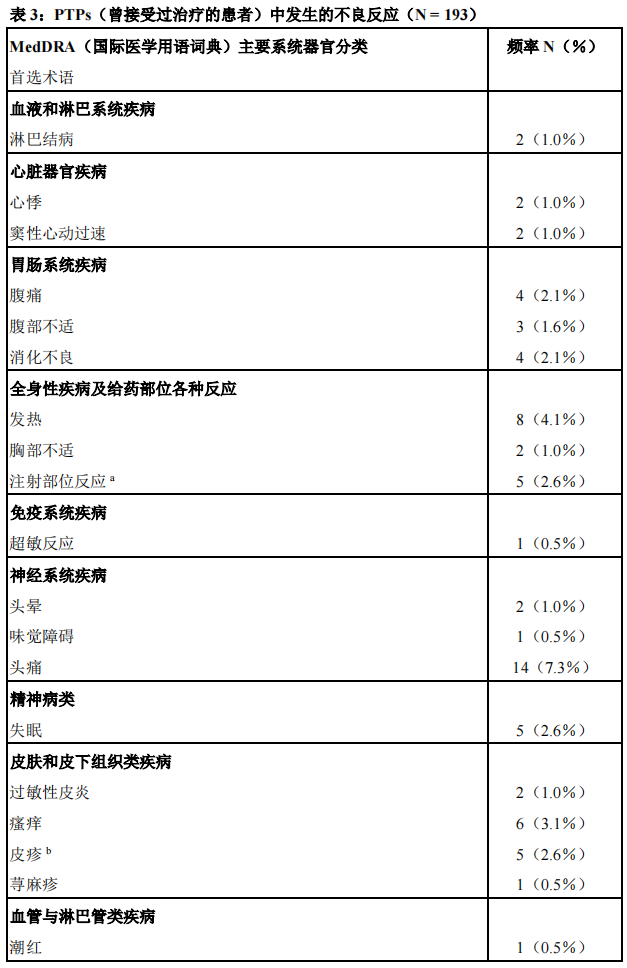
a包括注射部位外渗和血肿、输注部位疼痛、瘙痒和肿胀
b包括皮疹、红斑性皮疹和瘙痒性
免疫原性
在研究期间规定时间间隔以及研究完成访视时,使用本品首次给药之前采集的血液样本,通过改良的Bethesda检测方法,监测所有临床试验受试者针对凝血因子VIII的中和性抗体(抑制物)的产生。
针对本品开展的临床试验(I期至III期)共评价了204例诊断为重度A型血友病(凝血因子VIII<1%)、之前接受凝血因子VIII浓缩物暴露≥50暴露日(EDs),且无抑制物形成史的儿童和成人患者。
在已完成研究中,无PTPs(曾接受过治疗的患者)形成针对凝血因子VIII的中和性抗体。在一项正在进行的扩展研究中,1例年龄为13岁的PTP(曾接受过治疗的患者)患者于550个暴露日(EDs)之后出现滴度为0.6BU的中和性抗体,且伴随出现急性感染和抗心磷脂抗体IgG阳性。凝血因子VIII回收率为每1IU/kg回收2.2IU/dL,年化出血率(ABR)为0,并且无需更改治疗方案。
在一项正在进行主动招募的PUPs(未曾接受治疗的患者)临床试验中,14例接受治疗的受试者中有6例(42.9%,95%置信区间为17.7%-71.1%)形成了抑制物。在这6例受试者中,3例受试者(21.4%)的抑制物为高滴度,3例受试者(21.4%)暂时出现低滴度的抑制物,无需更改这3例受试者的治疗方案。
抗体形成的检测取决于分析法的敏感性和特异性。此外,多种因素可能影响分析中观察到的抗体(包括中和性抗体)形成阳性结果,包括分析法、样本处理、样本采集时间、合并用药以及潜在疾病。考虑到这些原因,对针对本品的抗体产生与针对其他产品的抗体产生进行比较可能会产生误导。
本品不得在对活性物质、任何辅料或对小鼠或仓鼠蛋白有超敏反应史的患者中使用。 (见【成份】)
1.超敏反应
使用本品可能出现超敏反应,包括速发型过敏反应。超敏反应早期体征可能包括胸闷或喉咙发紧、头晕、轻度低血压和恶心,也可能进展为速发型过敏反应。如果出现严重的速发型过敏反应症状,请停止使用本品,并且立即进行紧急治疗。
本品可能包含痕量小鼠和仓鼠蛋白(见【成份】)。使用该产品进行治疗时,患者可能出现对这些非人类哺乳动物蛋白的超敏反应。
2.中和性抗体
本品给药之后可能出现中和性抗体(抑制物)形成。使用所有凝血因子VIII产品时,未曾接受过治疗的患者(PUP)形成抑制物的风险最大(见【不良反应】)。通过进行恰当的临床观察和实施实验室检测,仔细监测患者是否形成针对凝血因子VIII的抑制物。如果给予剂量之后未实现预期的血浆凝血因子VIII活性水平,或出血事件未实现预期的控制,则可怀疑形成了抑制物(中和性抗体)。
3.心血管风险因素
当通过凝血因子VIII治疗后凝血功能恢复正常时,有心血管危险因素或疾病的血友病患者发生心血管事件的风险可能与非血友病患者相似。
4.导管相关感染
通过中央静脉接入设备(CVADs)给予本品时,可能观察到导管相关的感染。这些感染的发生与产品本身无关。
5.监测实验室检测结果
使用经过验证的检测方法监测血浆凝血因子VIII活性水平,以确保凝血因子VIII水平已充足,并且得以维持(见【用法用量】)。
监测凝血因子VIII抑制物的形成。给予预计剂量的本品之后,如果未实现预期的凝血因子VIII血浆水平,或出血事件未得到控制,则通过Bethesda检测方法测定抑制物。使用Bethesda单位(BU)报告抑制物的滴度。
目前尚无药物过量的报道。
在妊娠女性中,目前没有使用本品的数据,因此无法告知使用者药物相关风险。未使用本品进行动物生殖研究。妊娠女性使用本品是否可能会对胎儿造成危害,或是否会影响生殖能力,目前尚不明确。仅在明确需要时,才可使用本品。在全球范围内,基于整体的已有情况,出生缺陷和流产的发生率分别为 2.6-6.9%和 10-21%。目前尚无信息表明人类乳汁中存在本品,从而对母乳喂养的婴儿造成影响,或本品能够影响乳汁产生。在评估哺乳带来的发育和健康获益时,应同时考虑母亲对本品的临床需求以及本品或母亲的潜在状况对哺喂婴儿造成的任何潜在不良反应。本品儿童患者(<12 岁)使用剂量均依据国外临床试验结果而定,尚未积累中国儿 童(<12 岁)的临床数据。本品在儿童 PTPs(曾接受过治疗的患者)中已进行了安全性和有效性研究。在年龄≤ 12 岁的儿童中,体重校正后凝血因子VIII清除率高于成人和青少年患者。清除率的差异被认为是儿童患者需要更高给药剂量或给药频率的原因(见【药理毒理】)。本品的临床研究中未纳入组年龄≥65 岁的患者,老年患者对本品的应答是否与年轻患者不同尚未确定。但是,其他凝血因子VIII产品的临床经验尚未发现老年患者与年轻患者之间存在任何差异。与接受重组凝血因子VIII的其他患者一样,应该单独为每位老年患者选择剂量。
目前尚未发现和其他药物存在药物相互作用。
Bayer HealthCare LLC
86978266000082,86978266000099
本品能够暂时替代缺失的凝血因子Ⅷ。
通过活化部分凝血活酶时间(APTT)来测定血浆凝血时间,A 型血友病患者中 APTT延长,使用本品治疗能使 APTT 恢复正常。
本品在改良的体外遗传毒性试验(使用小鼠淋巴瘤细胞进行的哺乳动物基因突变和染色体畸变试验)中,结果为阴性。
本品未进行动物致癌性试验。
3项(包括中国在内的)在重型A型血友病(凝血因子VIII<1%)患者中的国际多中心临床研究,评价了本品用于出血事件的按需治疗和控制、围手术期出血管理以及常规预防治疗时的安全性和有效性。三项研究中纳入的均为免疫功能正常且无凝血因子VIII抑制物形成病史的重度A型血友病(凝血因子VIII活性≤1%)患者。
研究1:本研究是一项在青少年和成人(年龄≥12岁至<65岁)PTPs(曾接受过治疗的患者)患者(≥150暴露日(EDs))中进行的多中心、开放性、交叉、非对照研究,旨在评价本品用于常规预防治疗和围手术期出血管理时的药代动力学、有效性和安全性(见表4)。主要疗效变量为年化出血率(ABR)。预防治疗的给药方案是,剂量为20至50IU/kg,每周2次或3次,其中,研究者基于每位受试者的具体要求分配给药频率。
研究2:本研究是一项在青少年和成人(年龄≥12岁至<65岁)PTPs(曾接受过治疗的患者)患者(≥150暴露日(EDs))中进行的多中心、开放性、交叉、非对照、随机化研究,旨在评价为期一年的治疗期内,使用本品进行预防治疗优于按需治疗(见表4)。主要疗效指标为年化出血率(ABR)。预防治疗的给药方案是,剂量为20至30IU/kg,每周2次,或剂量30至40IU/kg,每周3次,受试者随机分配至不同治疗组。
研究3:本研究是一项在儿童(年龄≤12岁)PTPs(曾接受过治疗的患者)患者(≥50暴露日(EDs)中进行的多中心、开放性、非对照研究,旨在评价本品预防治疗以及围手术期治疗管理时的药代动力学、有效性以及安全性(见表5)。主要疗效指标为,日常预防治疗期间,上一次预防性注射后48小时内出现的年化出血事件的总数。在不考虑注射时间的情况下分析了预防治疗期间的年化出血率(ABR)。预防治疗的给药方案是,剂量为25至50IU/kg,给药频率为每周2次、每周3次或隔日一次,而且研究者可依据每位受试者的具体要求调整给药方案。
所有研究中,研究者基于标准疗法自行决定突破性出血和围手术期管理的疗法。
共有204例受试者入组已完成的临床试验中,包括153例≥12岁的受试者和51例<12岁的受试者。140例受试者至少接受治疗长达12个月,其中43例受试者接受治疗长达24个月。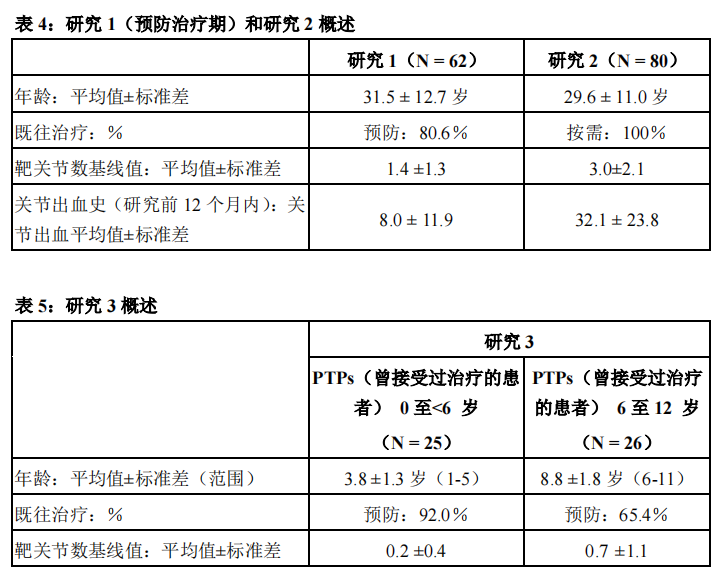
出血事件的按需治疗和控制
青少年和成人患者
研究1和研究2中,110例受试者中,共治疗1892例出血事件(见表6)。大多数出血事件为自发事件,发生于关节中,严重程度为轻度至中度。
研究1和研究2中,共对1859例接受治疗的出血事件进行了受试者治疗疗效评价,并且将其与之前的治疗经验进行了比较。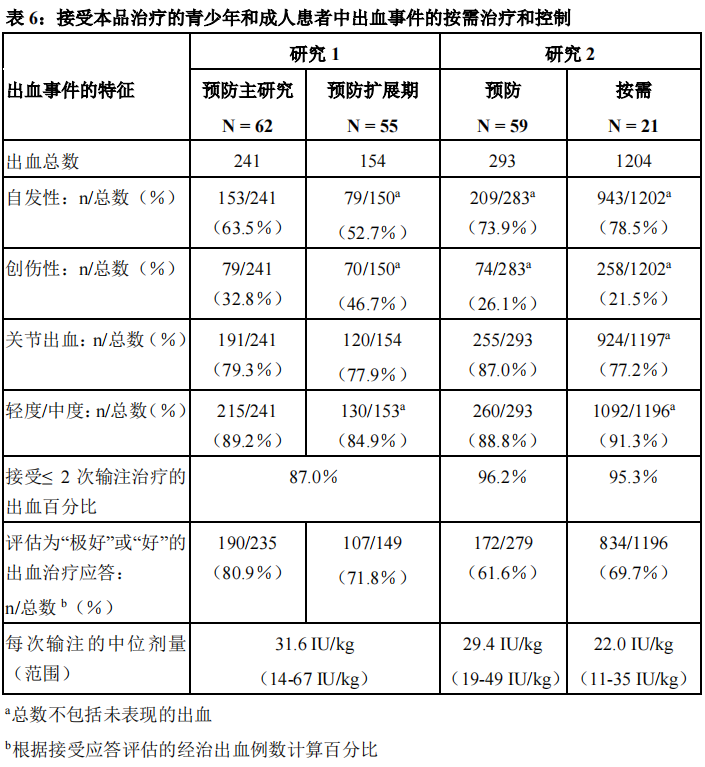
12岁及小于12岁的儿童
在28例儿童受试者的97例出血事件中开展本品治疗的评价。大多数(96.9%)出血事件的严重程度为轻度至中度。59例(72.8%)出血事件为创伤相关。为期6个月的治疗期间,治疗突破性出血事件的中位本品剂量为每次输注36.94IU/kg(范围20.8–71.6IU/kg)。
出血治疗应答的评价如下所列:
极好:立即实现疼痛缓解和/或出血体征改善,无需再给予额外输注;好:疼痛明显缓解和/或出血体征改善,但是为实现完全缓解,可能仍需要给予一次额外输注;中度:出血体征可能或略有改善,并且为实现完全缓解,仍然至少需要一次额外输注;不良:输注期间未出现改善或状况恶化。
在90.1%的出血事件中,出血按需治疗的止血疗效评价为“好”或“极好”(较小年龄组中为97.8%,较大年龄组中为81.0%)。大多数出血事件(89.7%)在输注≤2次可得到成功治疗。年龄0至<6岁的儿童对治疗的应答与6至12岁的儿童相似(见表7)。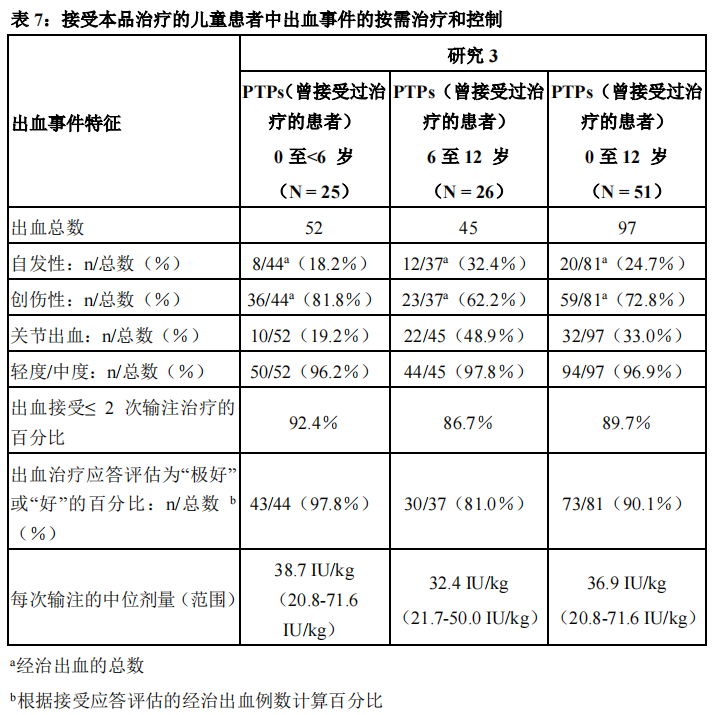
围手术期管理
44例曾接受过治疗的重度A型血友病患者中(43例成人和青少年患者以及1例年龄小于12岁的儿童患者),共实施14例大手术和46例小手术。在14例大手术中,7例手术为骨科手术,包括关节置换术。大约51%的小型手术为拔牙。所有受试者通过静脉推注接受本品。在青少年和成人受试者中,初始本品剂量的范围介于3000–5000IU之间。手术当天的中位总剂量为107.5IU/kg(范围:60–207IU/kg)。接受了大手术的唯一一例年龄小于12岁的受试者中,总初始本品剂量为2500IU(108.7IU/kg)。
手术期间和手术后,失血量位于预期范围内。外科医生评价出血控制为“好”(相对于非血友病患者中预计的出血量,血友病患者围手术期出血量稍高,但未达到临床显著水平;实施的治疗与非血友病患者相似)或“极好”(围手术期出血量与非血友病患者相似)。
常规预防
青少年和成人患者
共有140例受试者接受本品预防治疗至少长达12个月,研究1中,中位时间(范围)为157个暴露日(EDs)(25-178),[研究期和扩展期:305个暴露日(EDs)(25-355)],研究2中为153个暴露日(EDs)(103-187)(见表8)。在这两项研究中,意向治疗(ITT)人群中的受试者接受了95%至100%预定数目的预防治疗输注。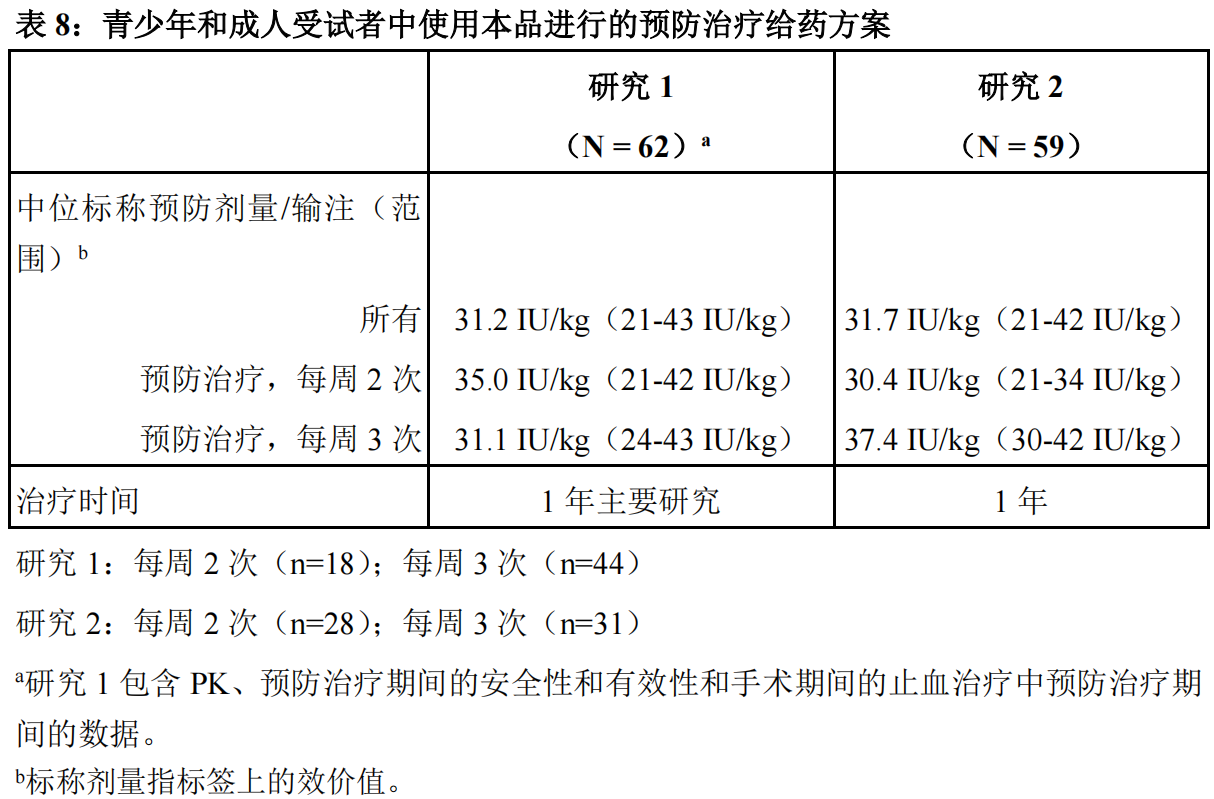
研究1中的意向治疗人群的平均和中位年化出血率(ABR)分别为3.8±5.2和1次出血/年。研究2中,通过方差分析比较了接受按需治疗和预防治疗的受试者之间的出血发生率,结果证明,接受按需治疗的受试者(每年60次出血)与接受预防治疗的受试者(每年2次出血)相较,中位年化出血率(ABR)存在显著的统计学差异(p<0.0001)。在研究2中,接受按需治疗的受试者中,平均年化出血率(ABR)为57.7±24.6,而接受预防治疗的受试者中,平均年化出血率(ABR)为4.9±6.8。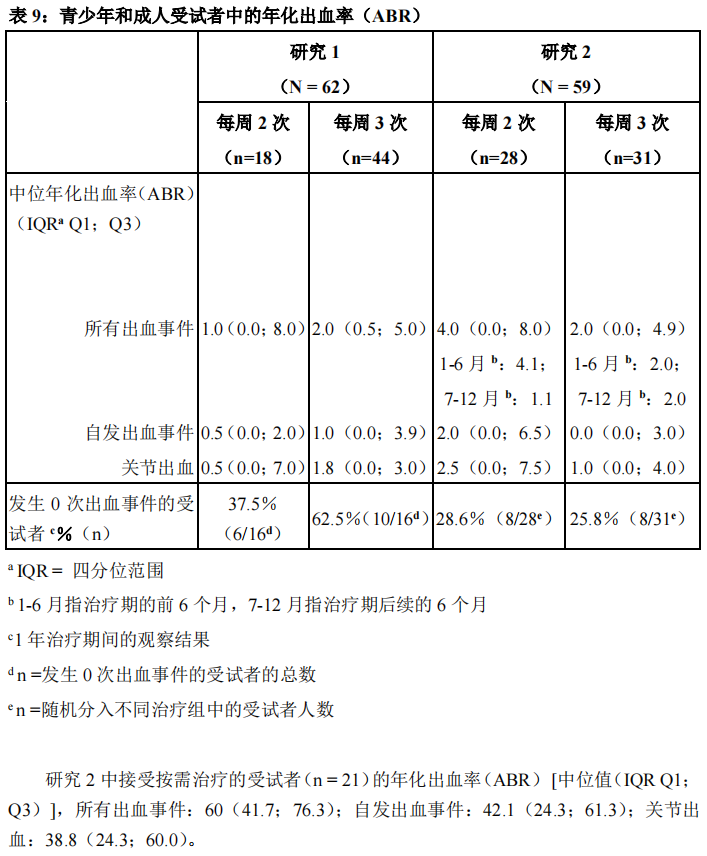

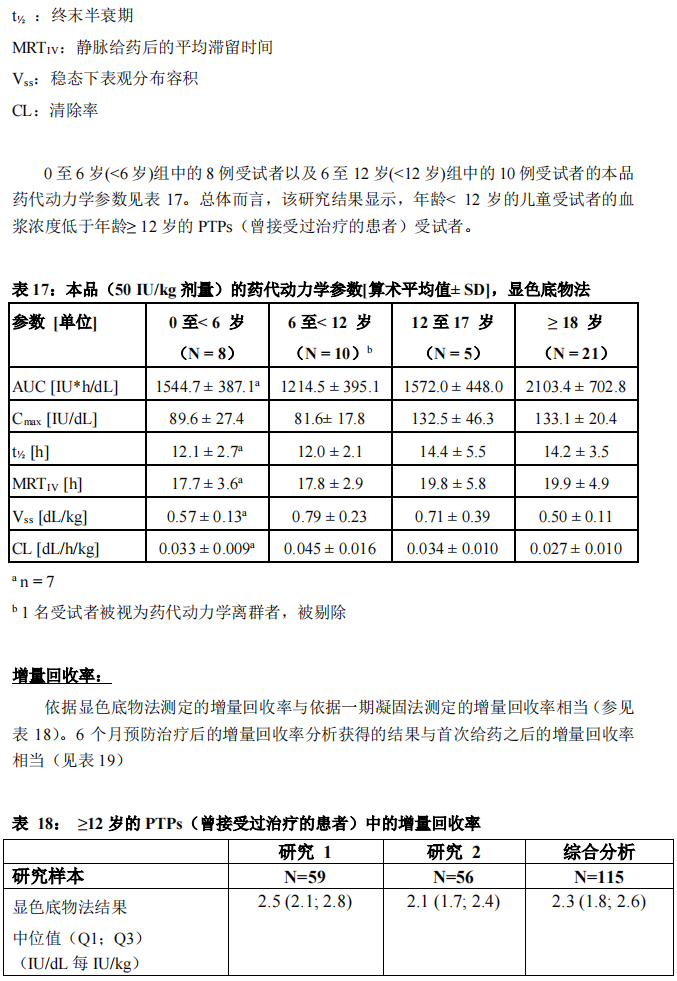
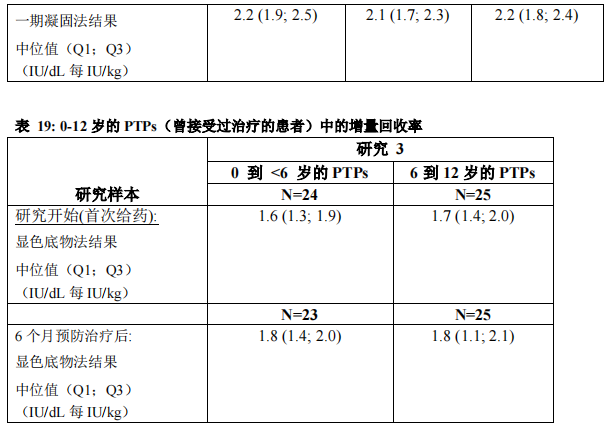
在重度 A 型血友病 PTPs(曾接受过治疗的患者)患者(年龄 0 至 61 岁)中研究了50 IU/kg 的本品给药后的药代动力学(PK)。本品的药代动力学参数显示于表 16(一期凝固法)和表 17(显色底物法)中。单次给药和重复给药(19 例受试者接受 6 至 12 个月预防给药)后,本品的药代动力学相似。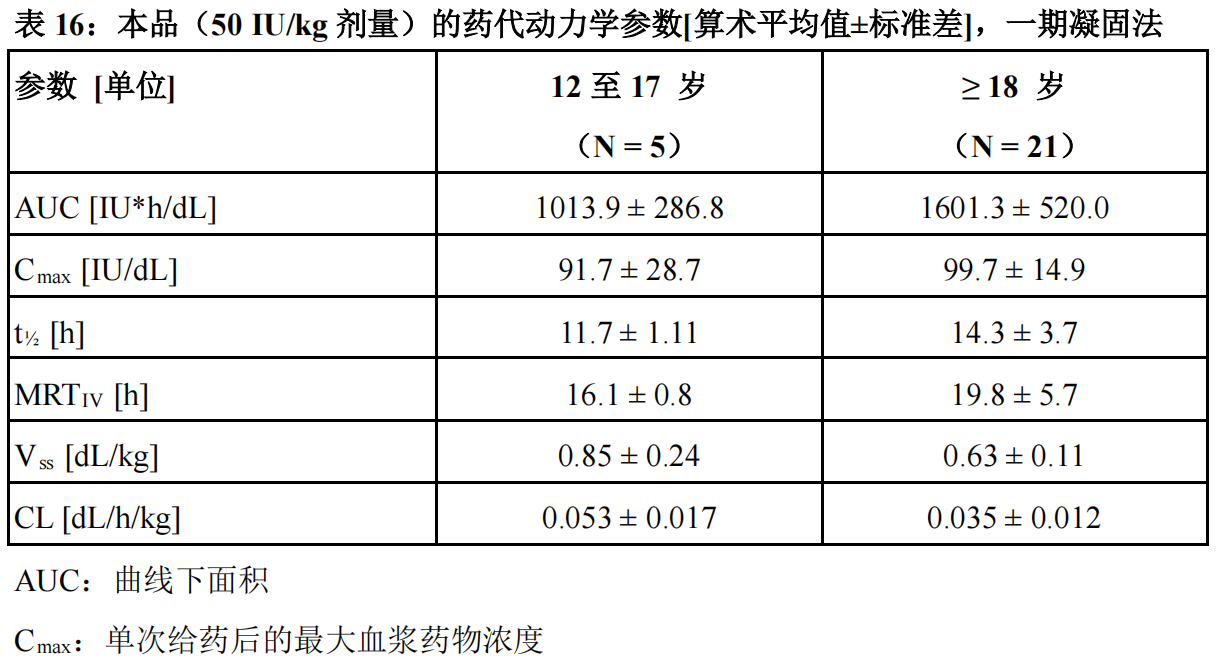
注射剂
250IU/瓶;500IU/瓶
直接接触药品的包装材料:透明I型玻璃瓶,灰色溴丁基胶塞 1瓶注射用重组人凝血因子Ⅷ 1支含2.5mL灭菌注射用水的预填充注射器 1支灭菌的药瓶适配器 1支一次性使用带过滤器静脉输液针
2~8℃避光贮藏和运输,禁止冷冻。 复溶后的本品应尽快给药。如果无法尽快给药,则不得在室温下保存超过 3 小时。
1580元起
30 个月
S20180017,S20180016

