维葡瑞/VPRIV说明书
Velaglucerase Alfa for Injection
维拉苷酶α
活性成份:维拉苷酶α
维拉苷酶α是通过DNA重组技术在HT-1080人成纤维细胞系中产生的。
辅料:蔗糖、枸橼酸钠、枸橼酸、聚山梨酯20。
本品为白色至类白色固体饼状物。
适用于1型戈谢病患者的长期酶替代治疗(ERT)。
应在具有戈谢病患者管理经验的医生指导下,使用本品进行治疗。
用量
1. 酶替代疗法初治患者的推荐起始剂量
对于未接受过酶替代治疗的成人和未接受过酶替代治疗的4岁及4岁以上儿童患者,维拉苷酶α的推荐起始剂量为60U/kg,隔周一次。剂量可根据每例患者治疗目标的达成和维持情况进行调整。
2. 从伊米苷酶换药至维拉苷酶α
目前正在接受稳定剂量伊米苷酶治疗的1型戈谢病成人患者和4岁及4岁以上儿童患者,可换药至维拉苷酶α,即在伊米苷酶末次给药后2周以既往伊米苷酶相同剂量开始维拉苷酶α治疗。剂量可根据每例患者治疗目标的达成和维持情况进行调整。
用法
仅用于静脉滴注。
通过静脉滴注给药,滴注时间为60 min。使用本品时需要复溶和稀释,仅供一次性使用,必须通过0.22 μm过滤器给药。必须使用无菌技术。按如下操作配制本品:
1. 根据个体患者的体重和处方剂量确定需要复溶药瓶的数量。
2. 将所需的药瓶从冰箱中取出,每个药瓶用4.3 ml无菌注射用水复溶。
3. 复溶后,应轻轻混合药瓶。不应振晃药瓶。每个药瓶可抽取出溶液4.0 ml(100 U/ml)。
4. 在进一步稀释之前,应当目视检查药瓶中的溶液;该溶液应呈澄清至略带乳白色和无色;如果溶液变色或存在外来颗粒物,则不应使用该溶液。
5. 使用注射器从适当数量的药瓶中取出计算好剂量的药品。使用另一支注射器将袋装100ml 0.9%氯化钠溶液中的空气抽出。将取出的药品用氯化钠溶液稀释用于静脉滴注。滴注应在复溶后24小时内开始。
滴注溶液的复溶和稀释:已证明,在2℃至8℃避光下,该药使用中的化学和物理稳定性为24小时。从微生物学的角度考虑,复溶后药品应立即使用。
任何未使用的药品或废弃物应按照当地要求进行处置。
在给予维拉苷酶α时,应能随时提供适当的医疗支持,包括在急救方面经过适当培训的人员。如果发生过敏性或其他急性反应,应立即停止滴注并给予适当的治疗。(参见【注意事项】)
在未进行相容性研究的情况下,严禁该药品与其他药品混合使用。
特殊人群
肾或肝功能损伤患者
根据当前维拉苷酶α的药代动力学和药效学认识,不建议对肾或肝功能损伤患者进行剂量调整。(参见【药代动力学】)
老年人(≥65岁)
老年患者可以在与其他成人患者相同的剂量范围内(15至60 U/kg)进行治疗。(参见【临床试验】)
儿童
在临床研究中接受维拉苷酶α治疗的94例患者中有20例(21%)处于儿童和青少年年龄段(4至17岁)。儿童的安全性和有效性特征与成人相似。(参见【临床试验】)
安全性总结
下述数据反映了5项临床试验中接受维拉苷酶α(15至60 U/kg,每两周一次)治疗的94例1型戈谢病患者的暴露情况。54例为ERT初治患者,40例患者从伊米苷酶转至维拉苷酶α。首次接受维拉苷酶α治疗的患者年龄介于4岁至71岁之间,其中男性46例,女性48例。
临床试验中患者最严重的不良反应为超敏反应。最常见的不良反应为输液相关反应。最常见的输液相关反应症状为:头痛、头晕、低血压、高血压、恶心、疲乏/乏力和发热/体温升高(参见【注意事项】)。输液相关反应是导致停药的唯一不良反应。
不良反应列表
表1列出了1型戈谢病患者报告的不良反应。根据MedDRA系统器官分类和频率进行描述。频率定义为十分常见(≥1/10)、常见(≥1/100,<1/10)和偶见(≥1/1000,<1/100)。在每个频率分组中,不良反应按严重程度递减的顺序排列。为了区别于干预性临床试验,来自上市后报告的药物不良反应均以斜体印刷。
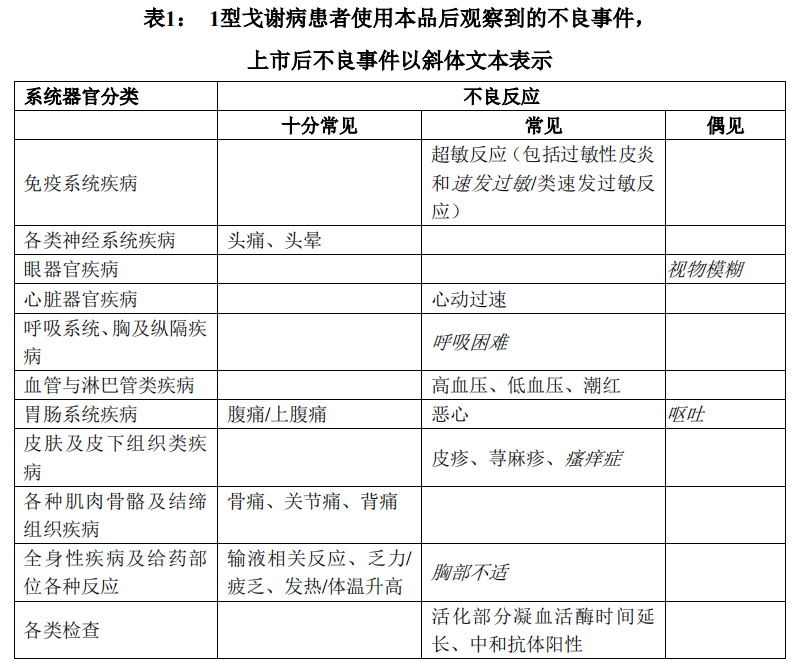
不良反应说明
呕吐:有时候呕吐可能是严重的(来自上市后使用经验报告)
儿童
在涵盖4至17岁儿童和青少年的临床研究中,本品的安全性特征与在成年患者中观察到的类似。
老年人群(≥65岁)
在65岁及以上患者的临床研究中,本品的安全性特征与其他成人患者中观察到的相似。
对本品活性成分或任一辅料有严重过敏反应者禁用。
超敏反应
超敏反应,包括与速发过敏反应一致的症状,已经在临床研究和上市后使用的患者中报告过。大多数超敏反应通常在滴注后12 h以内发生。最常报告的超敏反应症状包括恶心、皮疹、呼吸困难、背痛、胸部不适(包括胸闷)、荨麻疹、关节痛和头痛。
输液相关反应
输液相关反应(IRR)定义为本品滴注开始后24h内发生的任何药物不良反应。输液相关反应是临床研究接受治疗的患者中最常见的不良反应。IRR通常表现为超敏反应。最常报告的超敏反应症状包括恶心、皮疹、呼吸困难、背痛、胸部不适(包括胸闷)、荨麻疹、关节痛和头痛。在临床研究和上市后使用的患者中已经报告了与速发过敏反应一致的症状。除了与超敏反应相关的症状外,IRR可表现为疲乏、头晕、发热,血压升高,瘙痒症或视物模糊。在初治患者中,大部分输液相关反应发生在治疗开始后的前6个月。
输液相关反应(包括超敏反应)的预防和管理
输液相关反应的管理应基于反应的严重程度,采取包括减慢滴注速度,给予抗组胺药、退烧药和/或皮质类固醇等药物治疗,和/或停止后再恢复治疗(延长滴注时间)。
由于存在包括速发过敏反应在内的超敏反应风险,在给予本品时,应能随时提供适当的医疗支持,包括在急救方面经过适当培训的人员。如果在诊所发生速发过敏反应或其他急性反应,应立即停止滴注并给予适当的治疗。
对维拉苷酶α或其他酶替代疗法表现出超敏反应症状的患者应慎重接受治疗。
在需要对症治疗的情况下,治疗前给予抗组胺药和/或皮质类固醇可预防后续的反应。
免疫原性
在使用维拉苷酶α时,抗体可能在治疗相关反应中发挥作用。为了进一步评价这种关系,如果发生重度输液相关反应以及缺乏或丧失疗效的情况,应检查患者体内是否存在抗体,并将结果报告给公司。
在临床试验中,94例患者中有1例(1%)产生了针对维拉苷酶α的IgG抗体。在这1例事件中,该抗体在体外检测中被确定为中和抗体。该患者未报告输液相关反应。没有患者产生针对维拉苷酶α的IgE抗体。
钠
每瓶药品含12.15 mg钠。控制钠摄入的患者应注意。
对驾驶和操作机械能力的影响
本品对驾驶或操作机械的能力没有影响或影响可忽略不计。
贮藏注意事项
1. 在冰箱内(2℃-8℃)贮藏,切勿冷冻。
2. 将药瓶保存在外盒内以避光。
3. 请将药品放在儿童视线外或接触不到的地方。
尚无维拉苷酶α用药过量的经验。临床研究中维拉苷酶α的最大剂量为60 U/kg。
育龄妇女 戈谢病患者在妊娠期和产褥期可能在一段时间内会出现疾病活动性增加。对于正在考虑妊娠的戈谢病患者,需要进行风险-获益评估。 妊娠 尚无或只有有限的孕妇使用维拉苷酶α的数据。给孕妇处方该药时应慎重。尚无来自哺乳期妇女研究的数据。目前尚不清楚维拉苷酶α是否在人乳中分泌。给哺乳妇女处方该药时应慎重。来自于在成人和儿童[94例(21%)中有20例儿童] 患者中开展的对照研究的证据支持在4至17岁年龄段使用该药。儿童和成人患者的安全性和有效性特征类似。这些研究允许纳入2岁及以上的患者,并预计2岁以上的安全性和有效性特征相似。然而,对4岁以下的儿童,目前尚无数据可用。在研究HGT-GCB-044中评估了对身高的影响(参见【临床试验】)。老年人(年龄超过65岁)可以用与成年人相同的剂量和频率(15至60U/kg)使用本品。 在65岁及以上患者的临床研究中,本品的安全性特征与其他成人患者中观察到的相似。
维拉苷酶α不是细胞色素P450的底物,因此没有进行药物-药物相互作用研究。
Shire Pharmaceuticals Ireland Limited
86983330000028
戈谢病是由葡糖脑苷脂酶(GBA)基因突变引起的常染色体隐性异常,可以导致一种 β-葡糖脑苷脂酶缺乏。葡糖脑苷脂酶可以催化葡糖脑苷脂转化为葡萄糖和神经酰胺。这种酶缺乏导致巨噬细胞溶酶体内葡糖脑苷脂累积,产生泡沫细胞或戈谢细胞。维拉西酶 α 可以催化葡糖脑苷脂水解,减少葡糖脑苷脂累积。这种溶酶体贮积症临床表现为肝、脾、骨髓或其他器官中戈谢细胞的累积,骨髓和脾中的戈谢细胞累积导致明显的贫血和血小板减少。
生殖毒性
在大鼠雄性和雌性生育力研究中,维拉西酶 α 最大剂量达 17mg/kg/天(102 mg/m2/天,根据体表面积折算约为人推荐给药剂量 60U/kg/天的 1.8 倍)时未见对雄性或雌性生育力参数的影响。妊娠大鼠静脉注射维拉西酶 α 剂量达 17mg/kg/天时(102mg/m2/天,根据体表面积折算约为人推荐给药剂量 60U/kg/天或1.5mg/kg/天或 55.5mg/m2/天的 1.8 倍),妊娠兔静脉注射剂量达 20mg/kg/天时(240mg/m2/天,根据体表面积折算约为人推荐给药剂量 60U/kg/天的 4.3 倍),未见维拉西酶 α 引起对生育力的影响或对胎仔的损害。大鼠围产期研究显示剂量达 17mg/kg/天时(102mg/m2/天,根据体表面积折算约为人推荐给药剂量 60U/kg/天的 1.8 倍)未见对产前、产后发育的不良影响。
尚未进行本品致癌性的动物评价或潜在的遗传毒性研究。
临床有效性和安全性
对初治患者进行的研究
研究TKT025是在12例成人(≥18岁)ERT初治患者(定义为在参与研究前至少12个月未接受过ERT治疗)中开展的一项为期9个月的开放性研究。在前3例患者中,维拉苷酶α最初以剂量递增方式给药(15、30、60 U/kg),其余9例患者以60 U/kg剂量开始治疗。在维拉苷酶α治疗开始后,最早在3个月即可观察到血红蛋白浓度和血小板计数较基线的临床显著改善,在6个月和9个月可观察到肝脏和脾脏体积较基线的临床显著改善。
完成研究TKT025的10例患者入组了一项开放性扩展研究(TKT025EXT),其中有8例完成了该研究。经过至少12个月的维拉苷酶α连续治疗后,所有患者均符合剂量降低标准-达到4项“第1年”1型戈谢病ERT治疗目标中的至少2项,剂量从60 U/kg逐步减量至30 U/kg。患者每两周一次接受剂量范围为30至60 U/kg(中位剂量为35 U/kg)的给药,长达84个月(7年)。由于血红蛋白浓度和血小板计数得以改善以及肝脏和脾脏体积缩小,治疗期间持续的临床有效性得以继续被证实。到第57个月时,经MRI扫描评估,8例患者中有8例的腰椎骨髓负荷(BMB)评分减少至少2分。在第24个月(0.4;95%CI 0.1,0.7)和第33个月(0.4;95%CI 0.2,0.6)分别观察到平均腰椎和股骨颈骨密度(BMD)Z评分较基线的改善。治疗7年后,较基线平均增加:腰椎Z评分0.7(95%CI 0.4,1.0),股骨颈评分0.5(95%CI 0.2,0.7)。与基线相比,根据WHO骨密度分类,没有患者被归类为更严重。
研究TKT032是在25例2岁及以上ERT初治(定义为在参与研究前至少30个月未接受过ERT治疗)患者中开展的为期12个月的随机、双盲、平行分组有效性研究。要求入组患者有戈谢病相关贫血和血小板减少或器官肿大。每两周一次随机给予患者
45U/kg(N=13)或60U/kg(N=12)剂量的维拉苷酶α。维拉苷酶α 60U/kg每两周一次静脉给药后,与基线相比,平均血红蛋白浓度(+2.4 g/dl)和血小板计数(+50.9×109/l)得到临床意义的显著增加,肝脏体积由正常肝脏的1.46倍缩小到1.22倍(平均缩小17%),脾脏体积由正常脾脏的14.0倍缩小到5.75倍(平均缩小50%)。在45U/kg给药组,观察到血红蛋白浓度(+2.4g/dl)和血小板计数(+40.9×109/l)较基线有意义的增加,肝脏体积由正常肝脏的1.40倍缩小到1.24倍(平均缩小6%),脾脏体积由正常脾脏的14.5倍缩小到9.50倍(平均减少40%)。
研究HGT-GCB-039是在34例2岁及以上ERT初治患者(定义为在参与研究前至少12个月未接受过ERT治疗)中开展的为期9个月的随机、双盲、非劣效性、阳性对照(伊米苷酶)、平行分组有效性研究。要求入组患者有戈谢病相关贫血和血小板减少或器官肿大。患者每两周一次接受60 U/kg 维拉苷酶α(N=17)或60U/kg伊米苷酶(N=17)。在维拉苷酶α治疗9个月后,血红蛋白浓度较基线的平均绝对增加为1.624 g/dl(±0.223 SE)。在临床上和统计学上证实血红蛋白浓度的这种增加非劣于伊米苷酶(从基线到9个月的变化的平均治疗差异[维拉苷酶α - 伊米苷酶]:0.135 g/dl)。在维拉苷酶α治疗9个月后和第一次血红蛋白缓解(定义为自基线增加1 g/dl)的时间内,维拉苷酶α和伊米苷酶在血小板计数和肝脏及脾脏体积变化方面没有统计学意义差异。
在从接受伊米苷酶治疗转至本品的患者中开展的研究
研究TKT034是一项在40例2岁及以上患者中开展的为期12个月的开放性安全性研究,这些患者曾接受伊米苷酶治疗至少30个月,剂量范围为15至60U/kg。要求患者在入组之前,至少6个月内使用稳定剂量的伊米苷酶。保持维拉苷酶α的给药剂量与之前的伊米苷酶一致。评价了血红蛋白浓度和血小板计数较基线(定义为患者伊米苷酶治疗结束时)的变化。在从伊米苷酶转至维拉苷酶α的患者,经过12个月的治疗,血红蛋白浓度和血小板计数维持在治疗水平。
研究HGT-GCB-058是一项在211例患者中开展的开放性临床安全性研究,包括205例既往接受过伊米苷酶治疗的患者,6例初治患者和57例65岁及以上患者(56/57已从伊米苷酶转至维拉苷酶α)。对从伊米苷酶转来的患者每两周一次滴注与伊米苷酶相同剂量(15至60U/kg)的维拉苷酶α。从伊米苷酶<15U/kg转来的患者给予
15U/kg 维拉苷酶α。既往使用伊米苷酶治疗的患者接受8次(中位值)维拉苷酶α滴注,治疗的中位持续时间为15.1周。这些患者的安全性特征与其他临床试验中观察到的类似。在研究期间,发现163例患者中仅有1例产生抗维拉苷酶α抗体。既往使用伊米苷酶治疗的患者的平均血红蛋白浓度和血小板计数在整个研究期间维持并保持在参考值范围内。
扩展研究HGT-GCB-044
参与TKT032、TKT034和HGT-GCB-039研究的患者中共计95例(73例成人和22例儿童)参与了开放性扩展研究并接受维拉苷酶α治疗。57例为初治患者。所有患者均接受至少2年的ERT治疗,随访时间平均为4.5年(最短2.3年,最长5.8年)。在这项研究中,在治疗24个月后评估初治患者的血红蛋白浓度、血小板计数、肝脏体积和脾脏体积。结果如表2所示。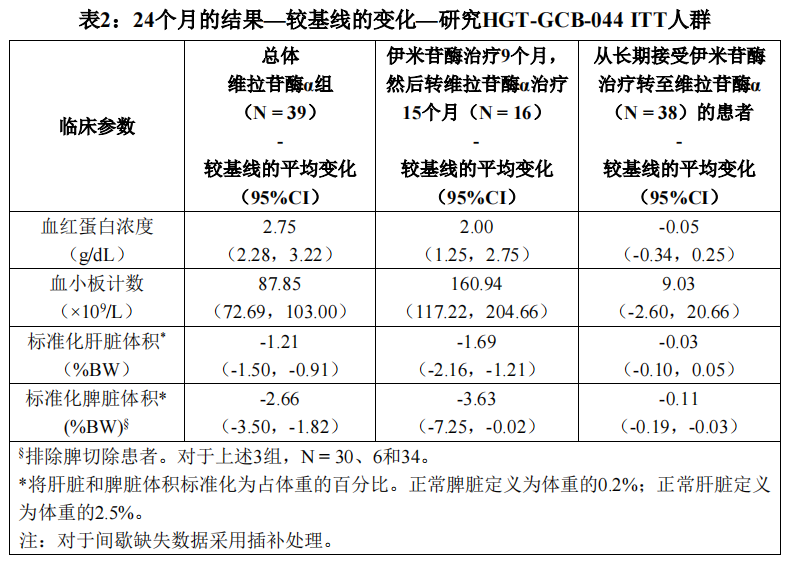
在这项研究中,使用腰椎和股骨颈的双重X射线吸收测定法来评估BMD。在31例接受维拉苷酶α治疗的初治成年患者中,基线时平均腰椎BMD Z评分为-1.820(95%CI:-2.21,-1.43),24个月维拉苷酶α治疗后,较基线增加了0.62(
95%CI:0.39,0.84)。在接受9个月伊米苷酶治疗并接受15个月维拉苷酶α治疗的初治患者中也观察到了类似的结果。在从长期伊米苷酶转至维拉苷酶α的患者中,24个月时腰椎骨密度维持不变。相反,股骨颈BMD未观察到显著变化。在儿童人群中(4至17岁),在总初治人群通过60个月的治疗后,可观察到平均身高Z评分的增加,表明维拉苷酶α对线性生长有获益的治疗作用。在接受9个月伊米苷酶治疗后转至维拉苷酶α治疗的儿童人群中,通过48个月的治疗观察到类似的治疗作用。在研究HGT-GCB-034中从长期伊米苷酶转至维拉苷酶α的儿童受试者在基线时具有较高的平均身高Z评分,并且其平均身高Z评分在一段时间内保持稳定。在研究结束时,对血红蛋白、血小板计数、器官体积、骨矿物质密度和身高的这些治疗作用保持不变。
男性和女性1型戈谢病患者之间没有明显的药代动力学差异。药代动力学评估时,没有受试者是抗维拉苷酶α抗体阳性。因此,评估抗体应答对维拉苷酶α药代动力学特征的影响不可行。
吸收
在达到稳态前,滴注60 min的前20 min内维拉苷酶α的血清浓度迅速升高,通常在滴注开始后40 min至60 min达到Cmax。滴注结束后,维拉苷酶α血清浓度以单相或双相方式迅速下降,在15、30、45和60 U/kg的剂量下平均t1/2为5-12 min。
分布
在15至60 U/kg的剂量范围内,维拉苷酶α表现出近似线性(即一级)的药代动力学特征,Cmax和AUC的增加与剂量大致成比例。稳态分布容积约为体重的10%。血清中维拉苷酶α的高清除率(平均6.7-7.6 mL/min/kg)与巨噬细胞通过甘露糖受体迅速摄取维拉苷酶α一致。
消除
儿童患者(N=7,年龄范围4至17岁)的维拉苷酶α的清除率包含在成人患者(N=15,年龄范围19至62岁)的清除值范围内。
注射剂
目标装量为4.4ml,每瓶的总含量为11mg或440U维拉苷酶α。用4.3ml无菌注射用水复溶后,每瓶将提供4.0ml可抽取体积,其中含有10mg或400U维拉苷酶α。
直接接触包材:中硼硅玻璃管制注射剂瓶,注射制剂用覆聚乙烯-四氟乙烯 膜丁基橡胶塞。 包装规格:每盒 1 瓶,每盒 5 瓶,每盒 25 瓶
于2℃-8℃保存和运输。
36个月
国药准字SJ20210013

