Shire Pharmaceuticals 醋酸艾替班特注射液说明书
Icatibant Acetate Injection
艾替班特
本品主要成份为醋酸艾替班特。
化学名称:(R)-精氨酰-(S)-精氨酰-(S)-丙基-(2S, 4R)-(4-羟基脯氨酰)甘氨酰-(S)-[3-(2-噻吩基)丙氨酰]-(S)-丝氨酰-(R)-[(1,2,3,4-四氢-3-异喹啉基)甲酰基](2S,3aS, 7aS)-[(六氢-2-吲哚啉基)甲酰基]-(S)-精氨酸,醋酸盐
化学结构式: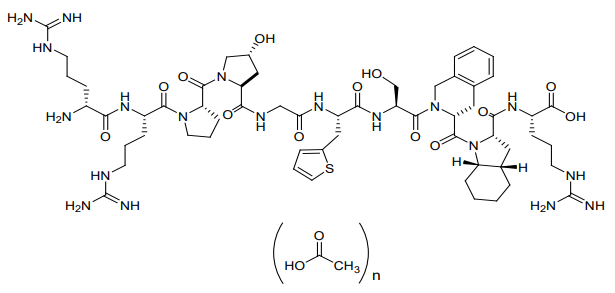
分子式:C59H89N19O13S· nC2H4O2
分子量:1304.52 • n60.05
辅料:氯化钠、冰醋酸、氢氧化钠、注射用水
本品为无色至淡黄色的澄明液体。
用于治疗成人、青少年和≥2 岁儿童的遗传性血管性水肿(HAE)急性发作。
剂量
成人
本品的推荐治疗剂量为 30mg/次,采用腹部皮下缓慢注射方式给药。一般情况下,单次注射足以治疗疾病的一次发作。在不足以缓解或症状复发情况下,可在 6 小时后注射第 2 次。如果第 2 次注射产生的疗效不足以缓解症状或症状复发,可在 6 小时后进行第 3 次注射。在 24 小时内给药不可超过 3 次。在已完成的临床试验中,每个月的给药次数未超过 8 次。
儿童患者
本品的推荐剂量需要依据儿童和青少年(2~17 周岁)的体重确定,详见表1。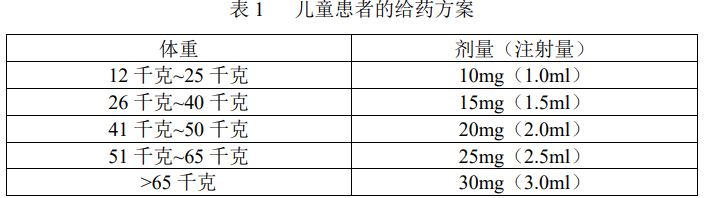
在已完成的临床试验中,遗传性血管水肿(HAE)发作时的给药次数未超过1 次。
对于不足 2 周岁或体重低于 12 千克的儿童不建议使用试验剂量方案,因为该药物对这一年龄阶段的儿童用药的安全性和有效性尚未确定。
老年患者
超过 65 周岁的患者资料不足。老年患者使用后会出现艾替班特全身暴露增加,这与本品的安全性方面的关系尚不可知。建议无需调整剂量。
肝脏损伤
肝损伤患者在治疗时不需要调整剂量。
肾脏损伤
肾损伤患者在治疗时不需要调整剂量。
给药指导
推荐于腹部区域皮下注射本品。注射本品时应当缓慢注射。每瓶醋酸艾替班特注射液仅能使用一次。
给药前应肉眼观测颗粒和变色。药物溶液应无色透明。如产品含颗粒或变色不要给药。消毒注射部位,皮下注射给药时间至少30秒。
对于通过护理人员给药或自身注射给药,应当由在诊断和治疗遗传性血管水肿方面有丰富经验的医生来决定。对于从未注射过本品的患者,第一次注射治疗应当在医疗机构或在医师的指导下进行。在获得专业医疗人员的有关皮下注射的培训,并确认患者可安全、准确进行皮下注射后,成年人方可进行自身注射或通过护理人员注射本品。2~17岁的儿童和青少年患者,需由经过专业医疗人员皮下注射培训的护理人员注射本品。
安全性概述
在用于注册的临床研究中,共有999次遗传性血管水肿发作经专业医疗人员皮下注射醋酸艾替班特注射液30mg;共有129名健康受试者和236名遗传性血管水肿患者经专业医疗人员皮下注射醋酸艾替班特注射液30 mg。
在临床试验中,几乎所有经皮下注射艾替班特治疗的受试者,都出现了注射部位反应,包括皮肤刺激、肿胀、疼痛、发痒、红斑和烧灼感。这些反应严重性一般是轻度至中度、一过性,无需进一步治疗,可自行缓解。
不良反应列表
表2中的不良反应发生频率定义如下:
十分常见(≥1/10);常见(≥1/100,<1/10);偶见(≥1/1,000,<1/100);罕见(≥1/10,000,<1/1,000);十分罕见(<1/10,000)。
来自上市后发生的不良反应均以斜体表示。
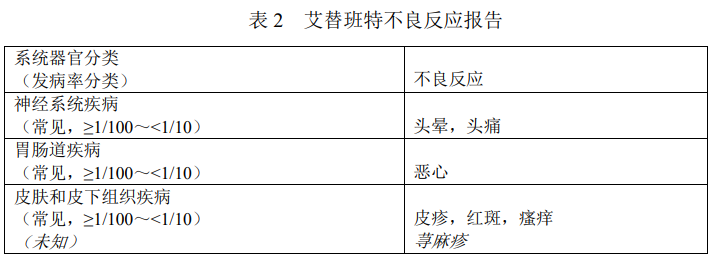
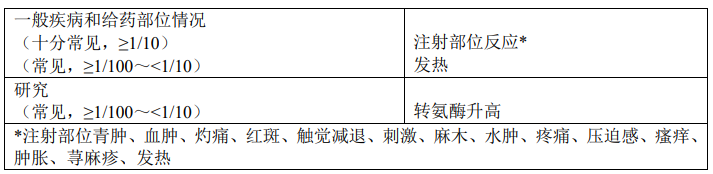
儿童
在临床研究中,共有32名患有HAE病症的儿童患者(8名年龄在2~11周岁的儿童和24名年龄在12~17周岁的青少年)接受艾替班特治疗。其中31名患者进行单剂量艾替班特治疗,1名HAE病症发作两次的患者(青少年)注射两个剂量艾替班特。根据患者体重计算皮下注射醋酸艾替班特注射液的给药量(0.4mg/kg),最大给药剂量为30mg。
大多数接受皮下注射艾替班特的儿童患者都会发生轻度至中度注射部位反应,包括红斑、肿胀、灼痛、皮肤疼痛和瘙痒,与报道的成人不良反应一致。两名儿童患者发生严重的注射部位反应,并在6小时内完全消退。这些反应为红斑、肿胀、烧灼感和温热感。
在临床研究中没有观察到生殖激素的显著变化。
免疫原性
在III期对照试验中,观察到经重复治疗的成人出现罕见的暂时性抗艾替班特抗体阳性,所有患者都保持疗效。用艾替班特治疗的一名患者在用药前和用药后均检测到抗艾替班特抗体阳性。随访该患者5个月,并进一步检测所采集的样品,其结果显示其他样本的抗艾替班特抗体均为阴性。无超敏反应或过敏反应报道。
对活性成分艾替班特或对该品种用到的任何辅料过敏患者禁用。
喉部疾病
喉部发作的患者在注射艾替班特后应立即就医,并在医疗机构治疗观察,直到医生判断安全。
缺血性心脏病
理论上,在缺血情况下,来自缓激肽B2受体的拮抗作用可能使心功能恶化和冠脉血流减少。所以对有急性缺血性心脏病或不稳定性心绞痛的患者,在治疗中应注意观察。
卒中
尽管有证据表明卒中后立即进行B2受体阻断产生有益的影响,但是理论上仍可能会出现艾替班特减弱缓激肽的正性晚期神经保护作用。因此,在卒中后数周内的患者给药应注意观察。
护理人员/自我给药
对于既往从未接受过艾替班特治疗的患者,应在医疗机构或在医生指导下进行首次治疗。
如果自我治疗或护理人员给药后,症状缓解不足或复发,建议患者或护理人员应就医咨询。对于成年人,同一次发作可能需要的后续剂量应在医疗机构内给药。对于青少年或儿童,没有给予同一次发作后续剂量的数据。
出现喉部发作的患者应始终就医,并且在家中接受注射后也应在医疗机构接受观察。
儿童患者
艾替班特治疗儿童患者遗传性血管水肿反复发作临床经验不足。
对驾驶和操控机器能力的影响
醋酸艾替班特注射液对驾驶和操作机械能力有轻微影响。有报道,在使用本品后出现疲劳、嗜睡、疲倦、睡意和眩晕的症状,这些可能与HAE的发作有关。如患者感到疲乏或眩晕建议患者停止驾驶和操作机械。
在临床研究中评价90 mg剂量(在皮下三个部位各30 mg),不良反应特征与单个皮下部位30 mg所见相似。
另一项临床研究,健康受试者静脉给予剂量3.2mg/kg(接近治疗剂量的8倍),引起红斑、瘙痒、潮红和低血压,无需治疗干预。
妊娠 尚无有关妊娠期间使用该药物的临床数据。动物试验表明会影响子宫着床和分娩,但对人类的潜在风险尚不明确。 在潜在获益高于对胎儿的潜在风险时,例如在治疗危及生命安全的喉部疾病发作时,也可在妊娠期间使用。 生育 重复使用艾替班特会对大鼠和狗的生殖器官产生影响。艾替班特对雄性小鼠和大鼠的生育能力没有影响。在一项研究中,39名健康成年男性和女性每6小时注射30mg,每3天3次,总共9次,女性或男性在基础水平的生殖激素浓度变化和GnRH刺激后的生殖激素浓度变化没有临床上的显著变化。对女性黄体酮的浓度和黄体功能,对女性月经周期没有显著影响,对男性精子数量、活力和形态方面没有显著影响。用于本研究的给药方案不可用于临床实践。大鼠分泌的乳汁中艾替班特的浓度与母体血液相似。在出生后的幼鼠发育中没有检测到任何影响。 尚未明确艾替班特是否会分泌到人类乳汁中,但建议在给药后12小时内不应哺乳。见【用法用量】。见【用法用量】。
未发现涉及CYP450的药代动力学方面的药物相互作用。
尚未研究与血管紧张素转换酶(ACE)抑制剂的联合用药,由于缓激肽水平可能增加,ACE抑制剂禁用于HAE患者。
Vetter Pharma-Fertigung GmbH & Co. KG
86983330000011
艾替班特是缓激肽 B2 受体的竞争性拮抗剂,亲和力与缓激肽相似。遗传性血管水肿(HAE)是一种由 C1-酯酶抑制剂缺乏或功能障碍所致的遗传疾病,C1-酯酶抑制剂是凝血因子 XII/激肽释放酶蛋白水解级联反应(该反应导致缓激肽生成)的关键调节因子。缓激肽是一种血管舒张物质,被认为可引起 HAE 的典型症状,如局部肿胀、炎症和疼痛。艾替班特可抑制缓激肽与 B2 受体结合,从而治疗 HAE 急性发作时的临床症状。
遗传毒性:
艾替班特 Ames 试验、中国仓鼠骨髓细胞染色体畸变试验、小鼠体内微核试验结果均为阴性。
生殖毒性:
大鼠、犬每日皮下给予艾替班特,可导致卵巢、子宫、睾丸萎缩/变性,乳腺、前列腺出现不良反应。在大鼠中,≥3mg/kg[按 AUC 计,约为人体最大推荐剂量(MRHD)的 5 倍(男性)和 2 倍(女性)以上]可见睾丸萎缩、前列腺分泌减少、睾酮水平降低、黄体退化;雌鼠在≥10mg/kg 剂量(按 AUC 计,约为女性MRHD 的 6 倍以上)可见发育卵泡减少、乳腺雄性化和子宫萎缩。在犬中,≥1mg/kg(按 AUC 计,约为 MRHD 的 2 倍以上)可见精子计数减少、子宫萎缩;10mg/kg[按 AUC 计,约为 MRHD 的 30 倍(男性)和 15 倍(女性)以上]可见睾丸和前列腺萎缩及睾酮水平降低,卵巢变小及发育卵泡数量减少。
与每日给药出现的毒性相反,犬持续 9 个月每周 2 次给予艾替班特,未见卵巢、子宫、睾丸、乳腺和前列腺毒性,3mg/kg 剂量下的 AUC 分别约为 MRHD 的5 倍(男性)和 3 倍(女性)。雄犬每周 2 次给药未见对精子数量、睾丸的影响。
雄性小鼠每日静脉给予艾替班特达 81mg/kg(按体表面积计,约为 MRHD 的5 倍以上),大鼠每日皮下给予艾替班特达 10mg/kg(按 AUC 计,约为 MRHD 的11 倍以上),均未见对生育力或生殖行为的影响。
在大鼠生育力和早期胚胎发育毒性试验中,皮下注射给予艾替班特10mg/kg/d(按 AUC 计,为 MRHD 的 7 倍),可致胚胎着床前丢失增加。
在大鼠胚胎-胎仔发育毒性试验中,自妊娠第 7 天至 18 天皮下注射给予艾替班特达 25mg/kg/d(按体表面积计,相当于 MRHD 的 2.7 倍),未见致畸作用或对胚胎、胎仔存活的影响。
在兔胚胎-胎仔发育毒性试验中,自妊娠第 7 天至 18 天皮下注射给予艾替班特,≥0.1mg/kg(按体表面积计,约为 MRHD 的 0.025 倍以上)可致早产和流产; 10mg/kg/d 剂量(按 AUC 计,约为 MRHD 的 13 倍)可见剂量依赖性的着床数和活胎数减少以及剂量依赖性的着床前丢失率增加;剂量高达 10mg/kg/d,未见致畸作用。
在大鼠围产期发育毒性试验中,自妊娠第 6 天至产后第 20 天皮下注射给予艾替班特 1、3、10mg/kg/d(按 AUC 计,分别相当于 MRHD 的 0.5 倍、2 倍、7倍),≥1mg/kg/d 可见分娩延迟,≥3mg/kg/d 可见分娩延迟导致的母鼠死亡,≥3mg/kg/d 可见胎仔死亡及出生后 4 天幼仔死亡增加,10mg/kg 剂量可见 F1 代翻正反射受损及毛发生长速度降低。皮下注射艾替班特后,可在母鼠乳汁中检测到原型药及代谢产物 M2。艾替班特对 F1 代的未见反应剂量为 1mg/kg/d,未得到对 F0 代母鼠的未见反应剂量。
致癌性:
小鼠(每周 2 次)、大鼠(每日 1 次)连续 2 年皮下给予艾替班特 2 年,剂量分别达 15mg/kg/d、6mg/kg/d,未见致癌性,按照 AUC 计,分别约相当于最大推荐人体剂量(MRHD)暴露量的 10 倍、6 倍以上。
幼龄动物毒性:
大鼠于幼龄发育阶段(出生后 22 天至 70 天)每日皮下给予艾替班特,按体表面积计,在约≥1/3 MRHD 剂量下可延迟雄性生殖器官的性成熟(睾丸和附睾萎缩),在高于或约相当于 MRHD 剂量下可导致给药期末雄鼠的生育力和生殖能力受损,在约为 3 倍 MRHD 剂量下未见对雌鼠的影响。雄性幼龄大鼠的组织病理学改变与性成熟大鼠和犬中结果一致,这归因于对缓激肽 B2 受体的拮抗作用以及对促性腺激素的继发影响。以上发现的反应可能为艾替班特每日给药的结果,犬连续 9 个月每周给药 2 次未见睾丸毒性。
其它毒性:
已提示 B2 受体可能与缓激肽的心脏保护作用有关,在急性缺血后的再灌注期间,对 B2 受体的拮抗作用可能对心血管系统产生不利影响。艾替班特可降低豚鼠离体心脏的冠状动脉血流量,延长大鼠离体心脏缺血再灌注后心律失常持续时间。在麻醉心肌梗死犬模型中,冠状动脉内输注艾替班特的死亡率较生理盐水对照组增加 2 倍。本品在急性缺血方面的人体经验有限。对于发生急性冠状动脉缺血、不稳定型心绞痛的患者,或发生卒中后几周内的患者,仅当获益超过理论风险时才能使用本品。
醋酸艾替班特注射液临床试验数据来自国外临床研究。从一项初始开放性Ⅱ期研究和三项对照Ⅲ期研究中获得了有效性数据。
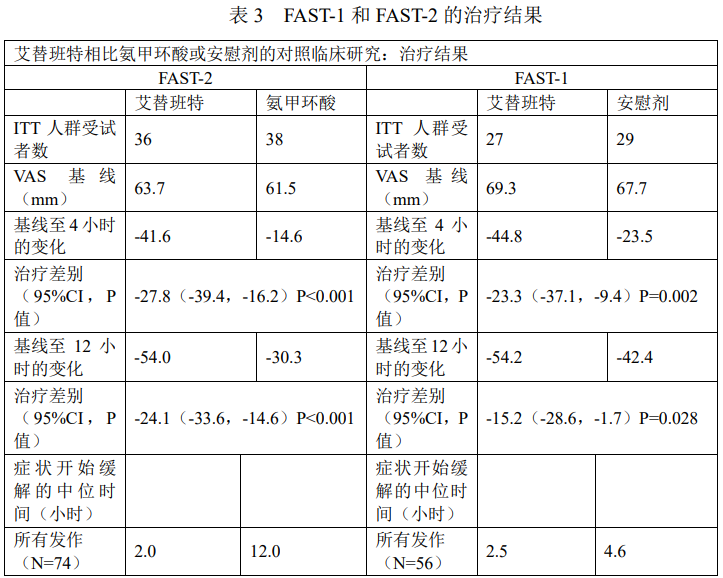
Ⅲ期临床研究(FAST-1和FAST-2)是随机双盲对照试验,除对照品(一项用氨甲环酸口服制剂作为对照和一项用安慰剂作为对照)不同外,其他试验设计均相同。130名患者随机接受30mg的艾替班特(63名患者)或对照品(氨甲环酸38名和安慰剂29名)。随后HAE发作的患者在一项开放延伸研究中进行治疗。患有喉部血管水肿的患者接受艾替班特的开放性治疗。主要研究终点采用视觉模拟评分法(VAS)评估症状开始缓解的时间。表3显示了这些研究的治疗结果。
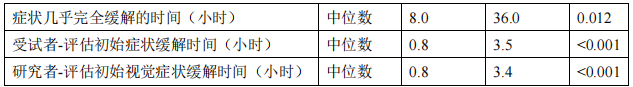
FAST-3是一项随机、安慰剂作为对照的平行试验研究,共98名成年患者,平均年龄为36周岁,随机皮下注射30mg艾替班特或安慰剂。本研究中的一部分患者在接受雄性激素、抗纤维蛋白溶解药物或C1抑制剂时出现了急性HAE。主要研究终点采用3项复合视觉模拟评分法(VAS-3)评估症状开始缓解的时间,该评分包括皮肤肿胀、皮肤疼痛和腹痛。表4显示了FAST-3的治疗结果。
在这些研究中,与氨甲环酸(12.0小时)和安慰剂(4.6和19.8小时)相比,艾替班特患者症状缓解的中位时间(分别为2.0、2.5和2.0小时)更快。次要有效终点证实了艾替班特的治疗疗效。
在对这些Ⅲ期对照研究的综合分析中,无论年龄、性别、种族、体重或患者是否使用雄激素或抗纤维蛋白溶解药物,症状缓解开始的时间和主要症状缓解开始的时间相似。
在Ⅲ期对照试验中,复发发作的反应是一致的。共237名患者接受1386剂30mg艾替班特治疗1278次急性HAE。在前15次治疗中(1114剂用于1030次发作),所有症状缓解开始的中位时间相似(2.0至2.5小时)。92.4%HAE发作的患者均使用单剂量进行治疗。
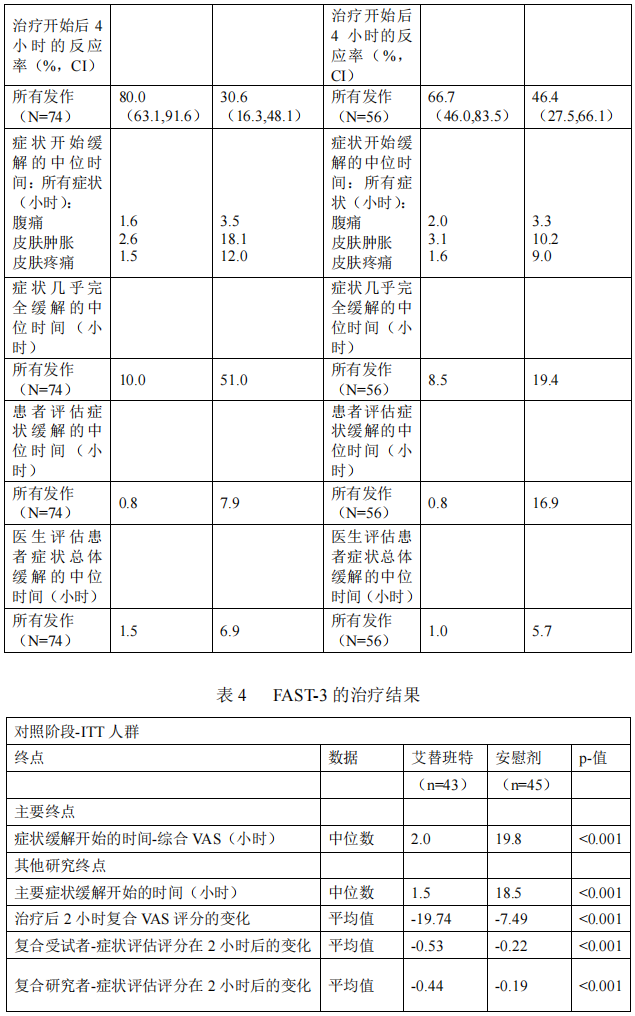
在Ⅲ期临床对照试验中,对66名HAE发作后影响到喉部的患者进行治疗,症状缓解所需时间与HAE非喉部发作的患者所需时间相近。
儿童患者
一项包括32名患者的开放性、非随机的非对照试验(HGT-FIR-086)中,所有患者至少接受了一剂量艾替班特(以实际体重计:从0.4mg/kg加量至最大剂量30mg/kg),大多数患者至少治疗六个月。11位患者处于青春前期,21位患者处于青春期或青春后期。
使用艾替班特进行HAE发作治疗的有效人数是22(11位青春前期,11位青春期或青春后期)。
主要疗效终点是使用综合研究者报告的症状评分来评估症状缓解开始的时间(TOSR),症状缓解时间是指症状改善幅度为20%所需时间(小时)。
总体中位时间至症状缓解开始时间是1小时(95%置信区间,1.0~1.1小时),在治疗后1小时和2小时,分别有大约50%和90%的患者开始症状缓解。
总体来说,中位时间至症状缓解至最轻微(从开始治疗至所有症状比较轻微或消失最早的时间)所需时间是1.1小时(95%置信区间,1.0~2.0小时)。
吸收
皮下注射 30 mg 后,本品的绝对生物利用度约为 97%。健康受试者(N=96)单次皮下注射艾替班特 30 mg 后,约 0.75 小时后检测到平均(±标准差)最大血药浓度(Cmax)为 974±280 ng/mL。30 mg 剂量单次给药后的平均浓度-时间曲线下面积(AUC0-∞)为 2165±568 ng·hr/mL,3 次 30 mg 剂量间隔 6小时给药后未观察到艾替班特累积证据。
分布
醋酸艾替班特分布容积(Vss)约为 20-25 L。血浆蛋白结合率为 44%。
消除
醋酸艾替班特主要通过代谢消除,少于 10%的剂量作为原形药物经尿液消除。清除率约为 15-20 L/h,与剂量无关。终末血浆半衰期约为 1-2 小时。
生物转化
醋酸艾替班特经蛋白水解酶广泛代谢成无活性代谢产物,主要经尿液排泄。
体外研究证实,醋酸艾替班特不经氧化代谢途径降解,也不是主要细胞色素 P450(CYP)同工酶(CYP 1A2、2A6、2B6、2C8、2C9、2C19、2D6、2E1和 3A4)的抑制剂,而且也不是 CYP 1A2 和 3A4 的诱导剂。
特殊人群
年龄和性别
在年轻(18 至 45 岁)和老年(超过 65 岁)健康男性和女性受试者中每 6小时给予 30 mg 皮下剂量艾替班特、共给药三次的研究中,单次-剂量 30 mg 皮下给予艾替班特后,老年男性和女性与年轻男性和女性比较显示 AUC 分别较高接近 2 倍。但是,观察到性别匹配的老年和年轻受试者 Cmax 间只有较小差别(~12-14%)。老年受试者较年轻受试者清除率低,故全身暴露较高。
除了年龄效应也观察到性别对艾替班特药代动力学的影响。注意到艾替班特清除率与体重相关,较低体重者则艾替班特清除率较低。因此,相比男性,女性通常体重较低,艾替班特清除率值也较低,导致接近 2 倍高的全身暴露(AUC 和 Cmax)。尚未确定老年和较年轻患者及男性和女性患者间疗效和安全性差别。无需根据年龄和性别调整剂量。
肝损害
发现健康受试者(n=8)和轻至中度(Child Pugh 评分 5 至 8)肝受损受试者(n=8)以 0.15 mg/kg/天剂量连续静脉输注艾替班特超过三天后,药代动力学参数具有可比性。在另一研究中,严重肝受损受试者中(Child-Pugh 评分 7至 15) 艾替班特清除率与健康受试者相似。对肝功能受损患者无需调整剂量。
肾损害
因为艾替班特的肾清除是次要消除通路,预计肾受损不影响艾替班特的药代动力学,因此对艾替班特未进行正规的肾受损研究。10 例患有肝肾综合征的(GFR 30-60 mL/min)受试者艾替班特的清除率不依赖于肾功能,艾替班特或其代谢物血浆水平与正常肾功能受试者比较未显示任何可观察到的差别。肾功能受损患者无需调整剂量。
种族
单个种族药效的信息是有限的。已有的数据显示清除量在非白种人(n=40)和白种人(n=132)之间没有显著差异。
儿童
通过在 HGT-FIR-086 研究中儿童 HAE 患者给药,确定了艾替班特的药代动力学。单次皮下给药(0.4mg/千克,最多 30mg,达峰时间约为 30 分钟),终末半衰期约为 2 小时。给药至发作和没有发作的 HAE 患者,两者之间暴露未见显著差异。群体药代动力学模型中成人和儿童的数据显示艾替班特的清除率与体重有关,儿童 HAE 患者的体重越轻,清除率越低。基于根据体重给药的建模,儿童 HAE 患者艾替班特的预计暴露量低于成人 HAE 患者研究中观察到的暴露量。
注射剂
3ml: 30mg (按C59H89N19O13S计)
预灌封注射器组合件,预灌封注射器用溴化丁基橡胶活塞,并附带皮下注射 针头(25G,16mm)。 1 支/盒(带 1 个针头),3 支/盒(带 3 个针头)。
25℃以下保存,不得冷冻。
24个月
国药准字HJ20210024

