诺和泰® (Ozempic®)说明书
Semaglutide Injection
司美格鲁肽
活性成份:司美格鲁肽(通过基因重组技术,利用酿酒酵母细胞生产的人胰高血糖素样肽-1(GLP-1)类似物)。1ml注射液中含有 1.34mg 司美格鲁肽。每支预填充注射笔含有司美格鲁肽 4mg,置于 3ml 溶液中。
化学名称:Nε26[ (S)-(22,40-二羧酸-10,19,24-三氧代-3,6,12,15-四氧杂- 9,18,23-三氮杂四十烷-1-酰基)][Aib8,Arg34]GLP-1-(7-37)肽
化学结构式: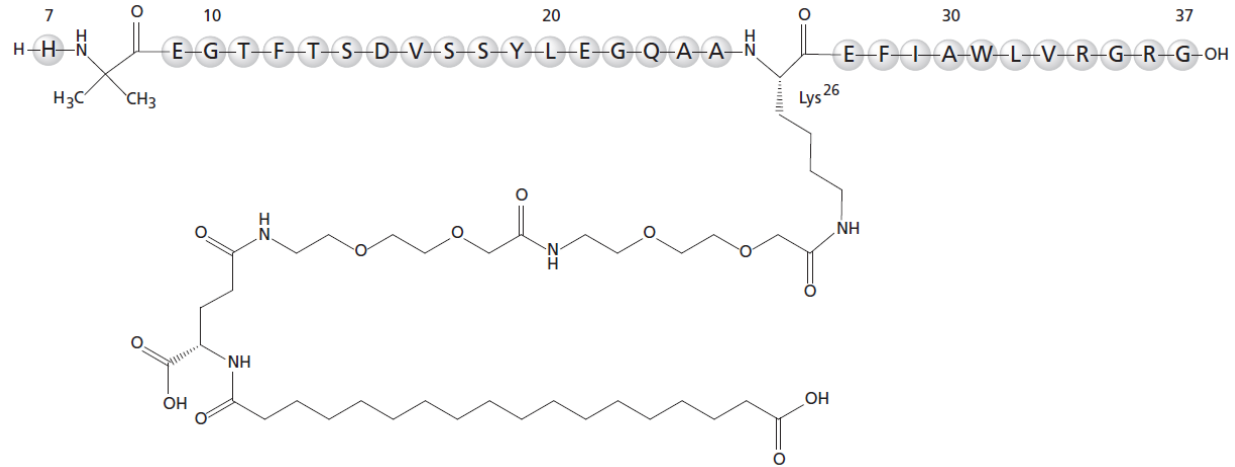
分子式:C187H291N45O59
分子量:4113.58 g/mol
辅料:磷酸氢二钠二水合物、丙二醇、苯酚、盐酸(用于调节 pH 值)、氢氧化钠(用于调节 pH 值)和注射用水。本品以苯酚作为抑菌剂,每 100ml 本品中加入苯酚 0.550g。
本品为无色或几乎无色的澄明等渗液体;pH=7.4。
本品适用于成人 2 型糖尿病患者的血糖控制:在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物治疗血糖仍控制
不佳的成人 2 型糖尿病患者。
适用于降低伴有心血管疾病的 2 型糖尿病成人患者的主要心血管不良事件(心血管死亡、非致死性心肌梗死或非致死性卒中)风险。
用量
司美格鲁肽的起始剂量为 0.25mg 每周一次。4 周后,应增至 0.5mg 每周一次。在以 0.5mg 每周一次治疗至少 4 周后,剂量可增至 1mg 每周一次,以便进一步改善血糖控制水平。本品 0.25mg 并非维持剂量。不推荐每周剂量超过1mg。当司美格鲁肽用于联合已有的二甲双胍治疗时,可维持当前二甲双胍剂量不变。
当本品用于联合已有的磺脲类药物治疗时,应考虑减少磺脲类药物的剂量,以降低低血糖的风险(见【不良反应】和【注意事项】)。
无需为调整本品剂量而进行自我血糖监测。但是,当开始使用本品与磺脲类药物联合治疗时,则可能需要自我监测血糖,以调整磺脲类药物的剂量,从而降低低血糖的风险(见【注意事项】)。
特殊人群
肾损害
轻度、中度或重度肾损害患者无需调整剂量。在重度肾损害患者中使用司美格鲁肽的经验有限。不推荐终末期肾病患者使用本品(见【药代动力学】)。
肝损害
肝损害患者无需调整剂量。在重度肝损害患者中使用司美格鲁肽的经验有限。在用本品治疗该类患者时应慎重(见【药代动力学】)。
用法
本品应每周注射一次,可在一天中任意时间注射,无需根据进餐时间给药。本品经皮下注射给药,注射部位可选择腹部、大腿或上臂。改变注射部位时无需进行剂量调整。本品不可静脉或肌肉注射。
如有必要,可以改变每周给药的日期,只要两剂间隔至少 2 天(>48 小时)即可。在选择新的给药时间后,应继续每周给药一次。
有关给药的更多信息见使用和其他操作的特别注意事项。
遗漏用药
如发生遗漏用药,应在遗漏用药后 5 天内尽快给药。如遗漏用药已超过 5天,则应略过遗漏的剂量,在正常的计划用药日接受下一次用药。在每种情况下,患者均应恢复每周一次的规律给药计划。






安全性特征总结
在 8 项Ⅲa 期试验中,共有 4792 例患者暴露于司美格鲁肽。临床试验最常报告的不良反应为胃肠系统疾病,包括恶心(十分常见)、腹泻(十分常见)和呕吐(常见)。通常,这些反应的严重程度为轻度或中度且持续时间较短。
不良反应列表 表 1 列出了 2 型糖尿病患者所有Ⅲa 期试验中确定的不良反应(在【临床试验】中进一步描述)。不良反应的频率是基于Ⅲa 期试验(不包括心血管结局试验)的汇总数据得出(详见表格后文字)。
按照系统器官分类和绝对频率列出不良反应。频率定义为:十分常见:(≥1/10);常见:(≥1/100 至<1/10);偶见:(≥1/1000 至<1/100);罕见:(≥1/10000 至<1/1000)和十分罕见:(<1/10000)。在每个频率分组中,不良反应均按照严重性降低的顺序列出。
表1 包括心血管结局试验在内的长期对照Ⅲa期试验的不良反应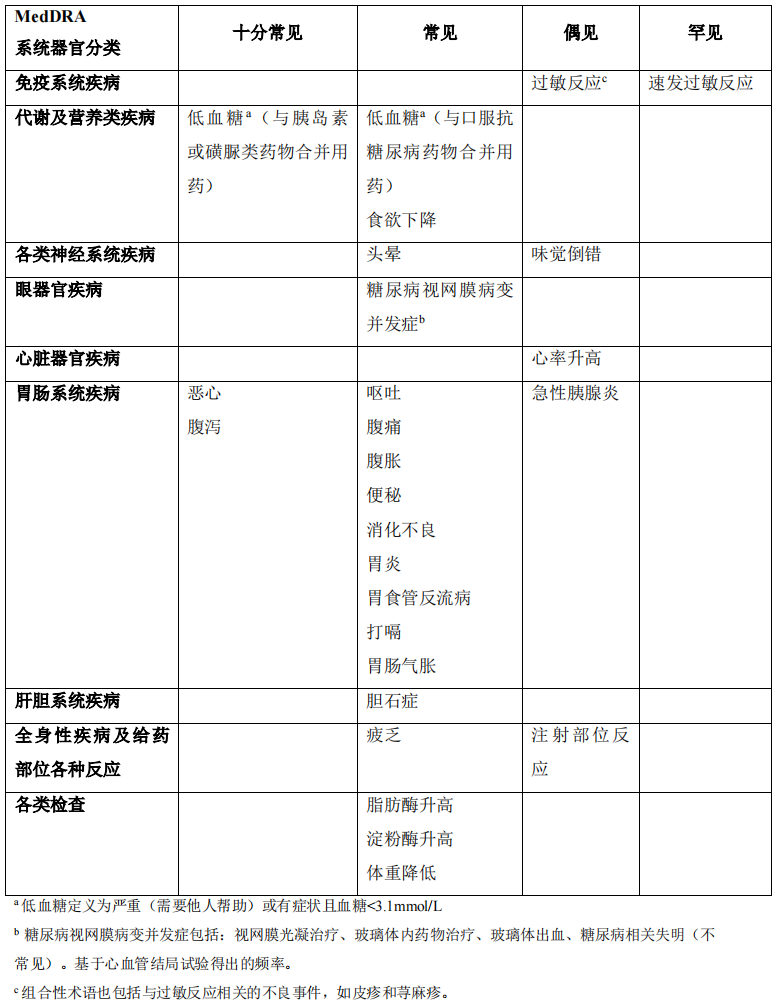
2年心血管结局和安全性试验
在心血管高危人群中,不良反应特征与其他Ⅲa 期试验观察到的不良反应相似(详见【临床试验】)。
部分不良反应描述
低血糖
本品单药治疗时,并未观察到严重低血糖事件。主要在本品与磺脲类药物或胰岛素联合使用时观察到严重低血糖(联合磺脲类药物时 1.2%的受试者,0.03例事件/患者年;联合胰岛素时 1.5%的受试者,0.02 例事件/患者年)。本品与磺脲类药物之外的其他口服降糖药联合使用时,观察到的低血糖事件非常少(0.1%受试者,0.001 例事件/患者年)。
胃肠道不良反应
司美格鲁肽 0.5mg 组和 1mg 组分别有 17.0%和 19.9%的患者发生恶心,12.2%和 13.3%的患者腹泻,6.4%和 8.4%的患者呕吐。大多数事件的严重程度为
轻度至中度,且持续时间短。分别有 3.9%和 5%的患者因不良事件停药。这些事件最常在治疗的最初几个月内报告。
低体重患者使用本品治疗时,可能会出现更多的胃肠道副作用。
急性胰腺炎
在 IIIa 期试验中,经裁定确认的急性胰腺炎的发生率在司美格鲁肽组和对照组分别为 0.3%和 0.2%。在为期 2 年的心血管结局试验中,经裁定确认的急性胰腺炎的发生率在司美格鲁肽组和安慰剂组分别为 0.5%和 0.6%(见【注意事项】)。
糖尿病视网膜病变并发症
一项为期 2 年的临床试验研究了 3297 例 2 型糖尿病患者,这些患者伴有心血管高风险,糖尿病病程长以及血糖控制不佳。在这项试验中,与安慰剂组(1.8%)相比,司美格鲁肽治疗组(3.0%)有更多的患者发生了裁定的糖尿病视网膜病变并发症事件。已有糖尿病视网膜病变的患者在接受胰岛素治疗后也观察到了这一结果。治疗差异出现在治疗早期并且持续整个试验。糖尿病视网膜病变并发症的系统评价仅在心血管结局试验中进行。在长达 1 年的临床试验中,共纳入了 4807 例 2 型糖尿病患者,司美格鲁肽组(1.7%)和对照药物组(2.0%)所报告的糖尿病视网膜病变相关的不良事件的比例相似。
因不良事件而停药
使用本品 0.5mg 和 1mg 治疗的患者,因不良事件停药的发生率分别为 6.1%和 8.7%,而安慰剂组是 1.5%。导致停用司美格鲁肽的最常见的不良事件为胃肠道事件。
注射部位反应
本品 0.5mg 和 1mg 治疗的患者分别有 0.6%和 0.5%报告注射部位反应(如注射部位皮疹、红斑)。这些反应通常为轻度。
免疫原性
与含蛋白或肽类的药品的潜在免疫特性一致,患者在接受本品治疗后可能会产生抗体。基线后任何时间点抗司美格鲁肽抗体检测阳性的患者比例很低(1-2%),且试验结束时没有患者产生抗司美格鲁肽中和抗体或具有内源性 GLP-1中和效应的抗司美格鲁肽抗体。
心率升高
曾有使用 GLP-1 受体激动剂后发生心率升高的情况。在Ⅲa 期试验接受本品治疗的受试者中,观察到平均每分钟心跳(bpm)从基线 72-76 次增加 1 到 6次。在伴有心血管风险的受试者中进行的一项长期试验中,接受本品治疗的受试者在治疗 2 年后心率升高>10bpm 的比例为 16%,而安慰剂组受试者在治疗 2 年后心率升高>10bpm 的比例为 11%。
疑似不良反应的报告
药品批准上市后报告疑似不良反应十分重要,以便对药品的受益/风险平衡进行持续监测。医疗专业人士应通过国家相关报告系统报告任何疑似不良反应。
对本品活性成份或本品中任何辅料过敏者。
甲状腺髓样癌(MTC)个人既往病史或家族病史,或 2 型多发性内分泌肿瘤综合征患者(MEN 2)(见【注意事项】)。
甲状腺 C 细胞肿瘤风险 完整的警示信息请参见说明书 ● 在啮齿类动物中,司美格鲁肽可引起甲状腺 C 细胞肿瘤。尚不清楚司美格鲁肽能否导致人类甲状腺 C 细胞肿瘤,包括甲状腺髓样癌(MTC),因为临床或非临床研究均无法确定其与人类的相关性。 ● 司美格鲁肽不得用于有 MTC 既往史或家族史患者以及 2 型多发性内分泌肿瘤综合征患者(MEN 2)。应告知患者可能的 MTC 风险及甲状腺肿瘤的症状。
本品不得用于 1 型糖尿病患者或用于治疗糖尿病酮症酸中毒。本品并非胰岛素的替代品。
尚无本品在纽约心脏病学会(NYHA)分级 IV 级的充血性心力衰竭患者中的使用经验,因此不推荐此类患者使用本品。
胃肠道反应
使用 GLP-1 受体激动剂可能与胃肠道不良反应有关。在治疗伴肾功能损害患者时,应该考虑到这一点,因为恶心、呕吐和腹泻可能导致脱水,而脱水可能导致肾功能恶化(见【不良反应】)。
急性胰腺炎
曾有使用 GLP-1 受体激动剂后发生急性胰腺炎的情况。应当告知患者急性胰腺炎的特征性症状。如果怀疑胰腺炎,应停用本品;如确诊为胰腺炎,不应再使用本品进行治疗。有胰腺炎病史的患者应慎用本品。
低血糖
接受本品联合磺脲类药物或胰岛素治疗的患者发生低血糖的风险可能会增高。开始本品治疗后,可以通过减少磺脲类药物或胰岛素的剂量来降低低血糖风险(见【不良反应】)。
糖尿病视网膜病变
在接受胰岛素和司美格鲁肽治疗并伴有糖尿病视网膜病变的患者中,观察到发生糖尿病视网膜病变并发症的风险增加(见【不良反应】)。已有糖尿病视网膜病变的患者在接受胰岛素治疗的基础上加用本品时应慎重。应依照临床指南,对此类患者进行密切监测和治疗。血糖控制的迅速改善与糖尿病视网膜病变一过性加重相关,但也不能排除其他作用机制。
甲状腺 C 细胞肿瘤风险
在司美格鲁肽临床相关血浆暴露水平下,小鼠和大鼠终身暴露后,会引起甲状腺 C 细胞肿瘤(腺瘤和癌)发生率呈剂量依赖性和治疗持续时间依赖性升高。目前尚不清楚司美格鲁肽是否会引起人类甲状腺 C 细胞肿瘤,包括甲状腺髓样癌(MTC),因为尚未确定司美格鲁肽诱导的啮齿类动物甲状腺 C 细胞肿瘤与人类的相关性。
另一种 GLP-1 受体激动剂利拉鲁肽在上市后报告了 MTC 病例;这些报告中的数据尚不足以确定或排除人类中 MTC 与 GLP-1 受体激动剂使用之间的因果关系。
本品禁用于有 MTC 个人既往病史或家族病史的患者,或 MEN 2 患者。应告知患者使用本品可能的 MTC 风险,以及甲状腺肿瘤的症状(例如颈部肿块、吞咽困难、呼吸困难、持续性声音嘶哑)。
对于使用本品治疗的患者,为早期发现 MTC 而常规进行血清降钙素或甲状腺超声监测的价值尚不明确。由于血清降钙素检测特异性低以及甲状腺疾病的背景发病率高,这些监测可能增加不必要程序的风险。血清降钙素值显著升高可能提示 MTC,MTC 患者的降钙素值通常>50ng/L。如果检测了血清降钙素并发现升高,应进一步评估该患者。对于在体格检查或颈部影像中发现甲状腺结节的患者,也应进一步评估。
急性肾损害
在使用 GLP-1 受体激动剂治疗的患者中,已有关于急性肾损害和慢性肾衰竭加重的上市后报告,这些病例有时可能需要血液透析。这些事件中有些发生在没有已知的基础肾病的患者中。大多数报告的事件发生在既往出现过恶心、呕吐、腹泻或脱水的患者中。对于报告重度胃肠道不良反应的患者,应在开始使用本品或进行剂量递增时监测其肾功能。
过敏反应
使用 GLP-1 受体激动剂曾有报告严重的过敏反应(如速发过敏反应、血管性水肿)。如发生过敏反应,应停用本品;立即给予标准治疗,并监测患者直至体征和症状消退。切勿用于既往对本品过敏的患者(见【禁忌】)。
其他 GLP-1 受体激动剂有引起速发过敏反应和血管性水肿的报告。既往曾对另一种 GLP-1 受体激动剂有血管性水肿或速发过敏反应史的患者应慎用本品,因为尚不明确此类患者接受本品治疗后是否更容易发生速发过敏反应。
钠含量
本品每剂含钠小于 1mmol(23mg),即基本上“无钠”。
对驾驶和机械操作能力的影响
司美格鲁肽对驾驶车辆或使用机器的能力没有影响或影响很小可以忽略不计。当与磺脲类药物或胰岛素联合使用时,应建议患者在驾驶和使用机器时采取预防措施,避免发生低血糖(见【注意事项】)。
使用和其他操作的特别注意事项
注射笔仅供一人使用。
本品仅在无色或几乎无色澄明时才可使用。
本品不得在冷冻后使用。
本品应使用长度不超过 8mm 的针头给药。本注射笔应与一次性的诺和针®配合使用。
本品不包含针头。
临床试验曾报告过单次剂量高达 4mg 和一周剂量高达 4mg 的药物过量。最常报告的不良反应为恶心。所有患者均康复且未发生任何并发症。尚无针对司美格鲁肽过量的特异性解毒剂。如果发生药物过量,应当根据患者的临床体征和症状采取适当的支持治疗。考虑到司美格鲁肽的半衰期长(约 1周),可能有必要延长对这些症状的观察期和治疗期(见【药代动力学】)。
妊娠 妊娠妇女使用司美格鲁肽的数据有限。本品禁用于妊娠期。如果患者准备怀孕,或已经怀孕,都应停止本品治疗。由于半衰期较长,计划妊娠前应至少停用本品 2 个月(见【药代动力学】)。 具有生育能力的女性 接受司美格鲁肽治疗时,推荐有生育能力的女性采取避孕措施。 生育力 司美格鲁肽对人类生育能力的影响尚不明确。动物试验结果显示,司美格鲁 肽不会影响雄性大鼠的生育能力。在雌性大鼠中,在与母体体重减轻相关的剂量水平,可见发情期延长和排卵数量小幅减少(见【药理毒理】)。不能排除对母乳喂养儿童的风险,因此不应在哺乳期使用本品。尚未确立本品在 18 岁以下的儿童和青少年中使用的安全性和有效性。尚未获得相关数据。基于包括 20-86 岁患者在内的研究数据分析,年龄对司美格鲁肽的药代动力学无影响。不需要根据年龄调整剂量。在年龄≥75 岁的患者中的治疗经验有限(见【药代动力学】)。
司美格鲁肽能延缓胃排空,可能影响同时使用的口服药的吸收速率。服用需快速胃肠道吸收的口服药的患者,使用本品时应慎重。
扑热息痛
通过标准餐试验期间扑热息痛的药代动力学评估发现,司美格鲁肽可延缓胃排空的速率。与本品 1mg 联用时,扑热息痛的 0~60 分钟药时曲线下面积(AUC0-60min)和峰浓度(Cmax)分别下降了 27%和 23%。扑热息痛的总暴露量(AUC0-5h)不受影响。与本品合并用药无需调整扑热息痛的剂量。
口服避孕药
预期司美格鲁肽不会降低口服避孕药的疗效,因为口服避孕药复方制剂(0.03mg 炔雌醇/0.15mg 左炔诺孕酮)与本品联合给药时,司美格鲁肽对炔雌醇和左炔诺孕酮总暴露量的影响不具有临床意义。炔雌醇的暴露量不受影响;稳态时左炔诺孕酮的暴露量增高 20%。该复方的各组分的峰浓度(Cmax)均未受影响。
阿托伐他汀
司美格鲁肽不会改变阿托伐他汀单次给药(40mg)后的总暴露量。阿托伐他汀的峰浓度(Cmax)下降了 38%。评估认为该变化无临床意义。
地高辛
司美格鲁肽不会改变地高辛单次给药(0.5mg)后的总暴露量和峰浓度(Cmax)。
二甲双胍
司美格鲁肽不会改变二甲双胍在 500mg 每日 2 次共 3.5 天给药后,二甲双胍的总暴露量和峰浓度(Cmax)。
华法林
司美格鲁肽不会改变华法林(25mg)单次给药后 R-和 S-华法林的总暴露量或峰浓度(Cmax),通过国际标准化比值(INR)检测发现,司美格鲁肽对华法林的药效学影响不具有临床意义。但当使用华法林和/或其他香豆素衍生物的患者开始本品治疗时,仍建议频繁监测 INR。
配伍禁忌
在未开展相容性研究的情况下,本品不得与其他药品混合使用。
Novo Nordisk A/S
86983568000012,86983568000029
司美格鲁肽是一种 GLP-1 类似物,与人 GLP-1 有 94%的序列同源性。司美格鲁肽作为 GLP-1 受体激动剂,可选择性地结合并激活 GLP-1 受体,GLP-1 受 体是天然 GLP-1 的靶点。GLP-1 是一种通过 GLP-1 受体介导而对葡萄糖代谢产生多种作用的生理激素。司美格鲁肽通过刺激胰岛素分泌和降低胰高血糖素分泌的机制来降低血糖,两者均为葡萄糖依赖性。因此当血糖升高时,胰岛素分泌受 到刺激而胰高血糖素分泌受到抑制。司美格鲁肽降低血糖的机制还涉及轻微延迟餐后早期胃排空。
司美格鲁肽半衰期延长的主要机制是与白蛋白结合,使其肾清除率降低和保护其不被代谢降解;此外,司美格鲁肽能抵抗 DPP-4 酶的降解而保持稳定。
遗传毒性
司美格鲁肽 Ames 试验、体外人淋巴细胞染色体畸变试验、大鼠体内骨髓微核试验结果均为阴性。
生殖毒性
大鼠生育力和胚胎-胎仔发育组合试验中,大鼠皮下注射给予司美格鲁肽0.01、0.03、0.09 mg/kg/天[相当于人最大推荐剂量(MRHD)1 mg/周的 0.1、0.4、1.1 倍],雄性大鼠从交配前 4 周至交配期间给药,雌性大鼠从交配前 2 周至妊娠第 17 天给药。各剂量下未见对雄性大鼠生育力的影响。雌性母体大鼠在所有剂量下均可见药理作用介导的体重增重和摄食量减少,所有剂量下均可见动情 周期延长,≥0.03 mg/kg/天剂量下可见黄体数小幅减少,这些影响可能是继发于司美格鲁肽对摄食量和体重的药理作用的适应性反应;在子代中,在人体暴露量下可见胎仔生长减缓、内脏(心血管)和骨骼(颅骨、椎骨、肋骨)异常。
兔胚胎-胎仔发育试验中,兔于妊娠第 6 天至第 19 天皮下注射给予司美格鲁肽 0.0010、0.0025、0.0075 mg/kg /天(相当于 MRHD 的 0.03、0.3、2.3 倍)。在所有剂量下均可见药理作用介导的母体体重增重和摄食量减少;≥0.0025 mg/kg/天剂量下可见早期妊娠丢失及胎仔内脏(肾脏、肝脏)和骨骼(胸骨)轻微异常的发生率增加。
食蟹猴胚胎-胎仔发育试验中,于妊娠第 16 天至第 50 天每周两次皮下注射给予司美格鲁肽 0.015、0.075、0.15 mg/kg(相当于 MRHD 的 1.0、5.2、14.9倍)。≥0.075 mg/kg 剂量下可见药理作用介导的母体初始体重明显降低、体重增重和摄食量减少,与胎仔的散发性异常(椎骨、胸骨、肋骨)的发生相一致。
食蟹猴围产期发育试验中,于妊娠第 16 天至第 140 天每周两次皮下注射给 予司美格鲁肽 0.015、0.075、0.15 mg/kg(相当于 MRHD 的 0.7、3.3、7.2 倍)。
≥0.075 mg/kg 剂量下可见药理作用介导的母体初始体重明显降低、体重增重和摄食量减少,与早期妊娠丢失的升高相一致,并导致子代略微偏小。
致癌性
CD-1 小鼠 2 年致癌性试验中,雄性小鼠皮下注射给予司美格鲁肽 0.3、1、3 mg/kg/天[以 AUC 计,相当于人最大推荐剂量(MRHD)1 mg/周的 5、17、59倍],雌性小鼠皮下注射给予司美格鲁肽 0.1、0.3、1 mg/kg/天(相当于 MRHD的 2、5、17 倍)。所有剂量组雄性和雌性动物均可见甲状腺 C 细胞腺瘤有统计学意义上的增加和 C 细胞癌数量上的增加。
SD 大鼠 2 年致癌性试验中,皮下注射给予司美格鲁肽 0.0025、0.01、0.025、0.1 mg/kg/天(0.0025 mg/kg/天的暴露量低于定量下限;其余剂量的暴露量分别相当于 MRHD 的 0.4、1、6 倍),所有剂量组雄性和雌性动物均可见甲状腺 C 细胞腺瘤有统计学意义上的增加,≥0.01 mg/kg/天组雄性可见甲状腺 C 细胞癌有统计学意义上的增加。大鼠甲状腺 C 细胞肿瘤与人类的相关性尚不清楚,也无法通过临床研究或非临床研究来确定其相关性。
药效学作用
所有的药效学评价均在司美格鲁肽 1mg 每周一次、治疗 12 周(包括剂量递增)达到稳态后进行。
空腹和餐后血糖:司美格鲁肽可以降低空腹和餐后血糖浓度。在 2 型糖尿病患者中,司美格鲁肽 1mg 治疗可降低血糖,表现在以下参数自基线的绝对变化(mmol/L)以及与安慰剂相比的相对降低(%)方面:空腹血糖(1.6mmol/L;降低 22%)、餐后 2 小时血糖(4.1mmol/L;降低 37%)、平均 24 小时血糖(1.7mmol/L;降低 22%)以及三餐的餐后血糖波动(0.6-1.1mmol/L,与安慰剂相比)。司美格鲁肽可在首次给药后降低空腹血糖。
β 细胞功能和胰岛素分泌:司美格鲁肽可改善 β 细胞功能。与安慰剂相比,司美格鲁肽可以改善 2 型糖尿病患者第 1 时相和第 2 时相的胰岛素分泌(分别增加 3 倍和 2 倍),并提高 2 型糖尿病患者 β 细胞的最大分泌能力。此外,与安慰剂相比,司美格鲁肽治疗增加了空腹胰岛素水平。
胰高血糖素分泌:司美格鲁肽可降低空腹和餐后胰高血糖素水平。在 2 型糖尿病患者中,与安慰剂相比,司美格鲁肽可使胰高血糖素出现以下相对下降:空腹胰高血糖素(8-21%)、餐后胰高血糖素分泌(14-15%)和平均 24 小时胰高血糖素水平(12%)。
葡萄糖依赖性胰岛素和胰高血糖素分泌:司美格鲁肽以葡萄糖依赖性方式、通过刺激胰岛素分泌和降低胰高血糖素分泌,来降低高血糖浓度。使用司美格鲁肽后,2 型糖尿病患者的胰岛素分泌速率与健康受试者相当。在诱导低血糖时,与安慰剂相比,司美格鲁肽并未改变 2 型糖尿病患者的胰高血糖素升高的反向调节反应,也不影响 C 肽水平降低。
胃排空:司美格鲁肽会导致餐后早期胃排空略延迟,从而降低餐后血液循环中血糖升高的速度。
食欲、能量摄入和食物选择:与安慰剂相比,司美格鲁肽可使连续 3 餐随意进餐的能量摄入降低 18-35%。支持这一结果的依据包括司美格鲁肽诱导产生的空腹状态和餐后的食欲抑制、饮食控制改善,对食物渴望减少以及对高脂食物的偏好相对减低。
空腹和餐后血脂:与安慰剂相比,司美格鲁肽可使空腹甘油三酯和极低密度脂蛋白(VLDL)胆固醇分别降低 12%和 21%。高脂餐引起的餐后甘油三酯、VLDL 胆固醇降低>40%。
心脏电生理学(QTc):在一项全面 QTc 试验中评价了司美格鲁肽对心脏复极的影响。在超治疗剂量水平(剂量高达 1.5mg 并达到稳态),司美格鲁肽不会延长 QTc 间期。
临床有效性和安全性
改善血糖控制和降低心血管疾病发病率和死亡率是 2 型糖尿病治疗的重要组成部分。
在 6 项随机对照Ⅲa 期试验中评价了本品 0.5mg 和 1mg 每周一次给药的有效性和安全性,这些试验共纳入 7215 例 2 型糖尿病患者(4107 例接受司美格鲁肽治疗)。5 项试验将血糖疗效评估作为主要目的,一项试验将心血管结局作为主要目的。
另外进行了两项临床试验,分别比较了本品 0.5mg 和 1mg 与西格列汀100mg 每日一次给药(共计 868 例患者),及与度拉糖肽 0.75mg 和 1.5mg 每周一次给药(共计 1201 例患者)的有效性和安全性。
与安慰剂和活性对照治疗(西格列汀、甘精胰岛素、艾塞那肽缓释制剂和度拉糖肽)相比,司美格鲁肽治疗(最长 2 年)可使糖化血红蛋白(HbA1c)下降和体重减轻,疗效持久,具有统计学优效性和临床意义。
年龄、性别、人种、种族、基线体重指数(BMI)、基线体重、糖尿病病程和肾功能损害程度不影响司美格鲁肽的疗效。
本品与二甲双胍和/或磺脲类药物联合治疗
1)以艾塞那肽缓释剂型为对照研究(SUSTAIN 3)
在一项为期 56 周的开放标签试验中,813 例接受二甲双胍单药治疗(49%)、二甲双胍加磺脲类药物(45%)或其他药物(6%)的患者随机分配至本品 1mg 组或艾塞那肽缓释制剂 2mg 每周一次治疗组。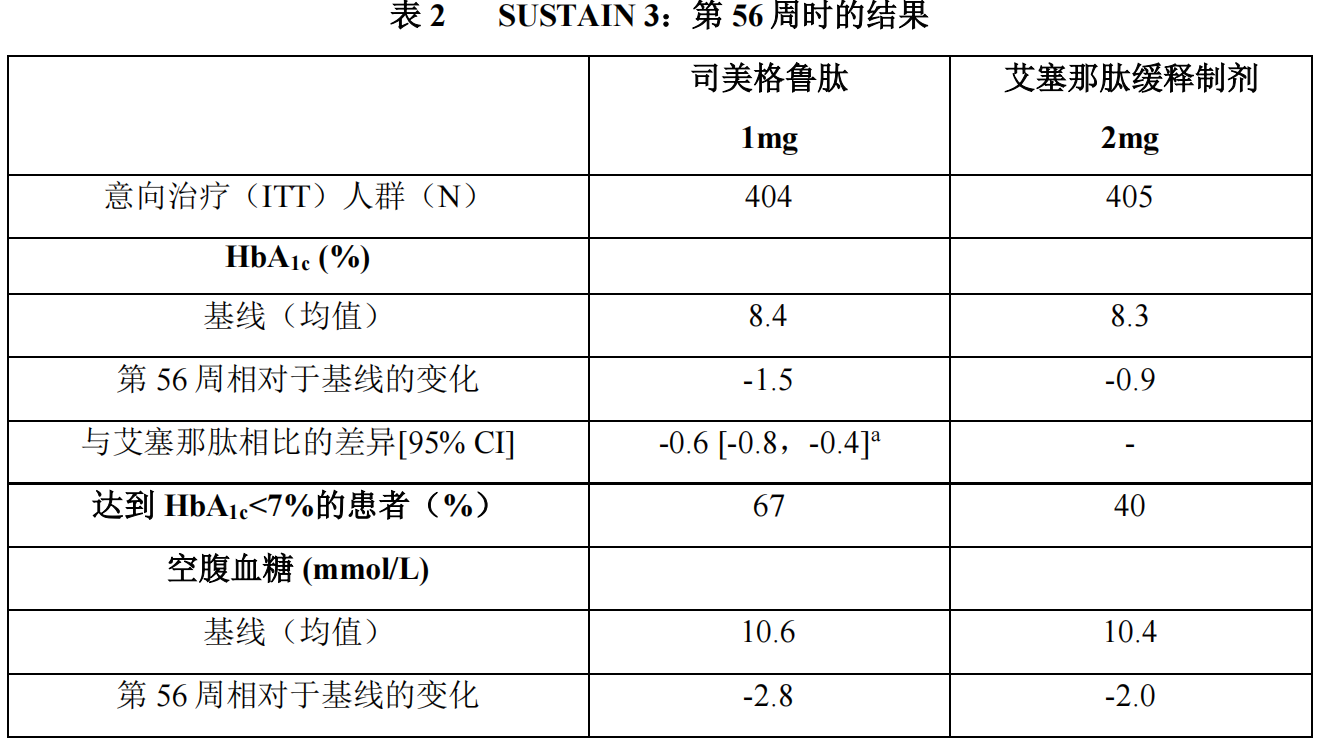
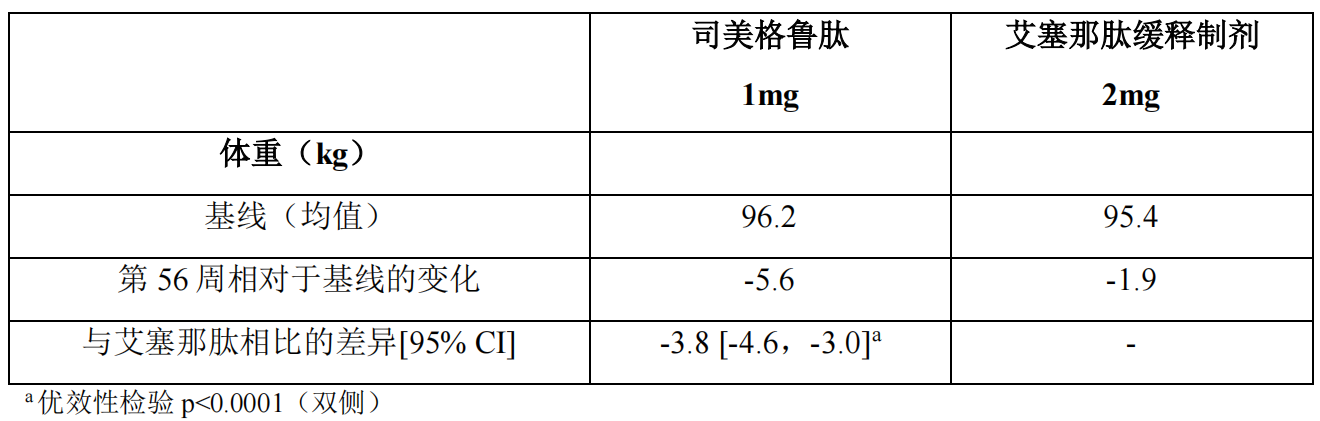
2)以甘精胰岛素为对照研究(SUSTAIN 4)
在一项为期 30 周的开放标签、对照试验中,1089 例患者在二甲双胍(48%)或二甲双胍和磺脲类药物联用的(51%)背景治疗下,随机分配至本品0.5mg 每周一次组、本品 1mg 每周一次组,或甘精胰岛素每日一次组。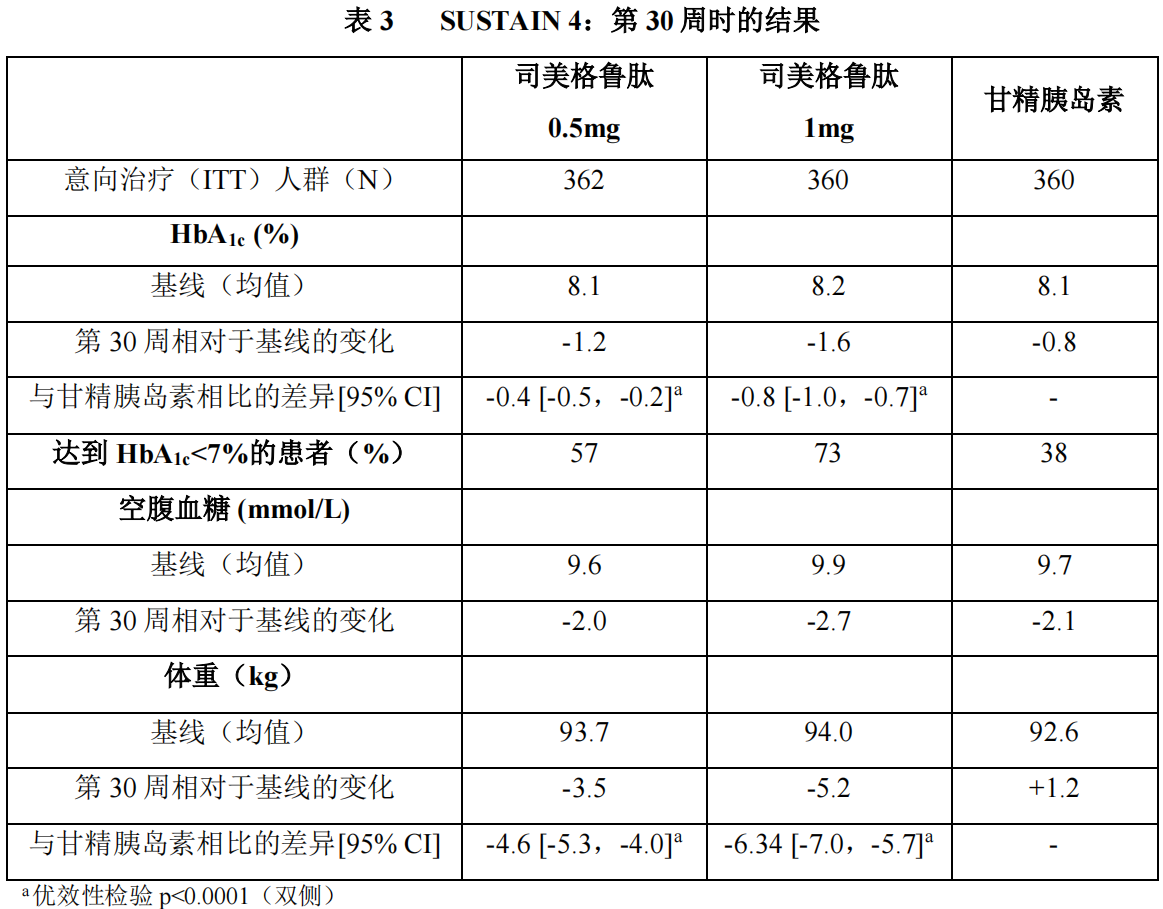
本品与二甲双胍联合治疗
1)以西格列汀为对照研究(NN9535-4114)
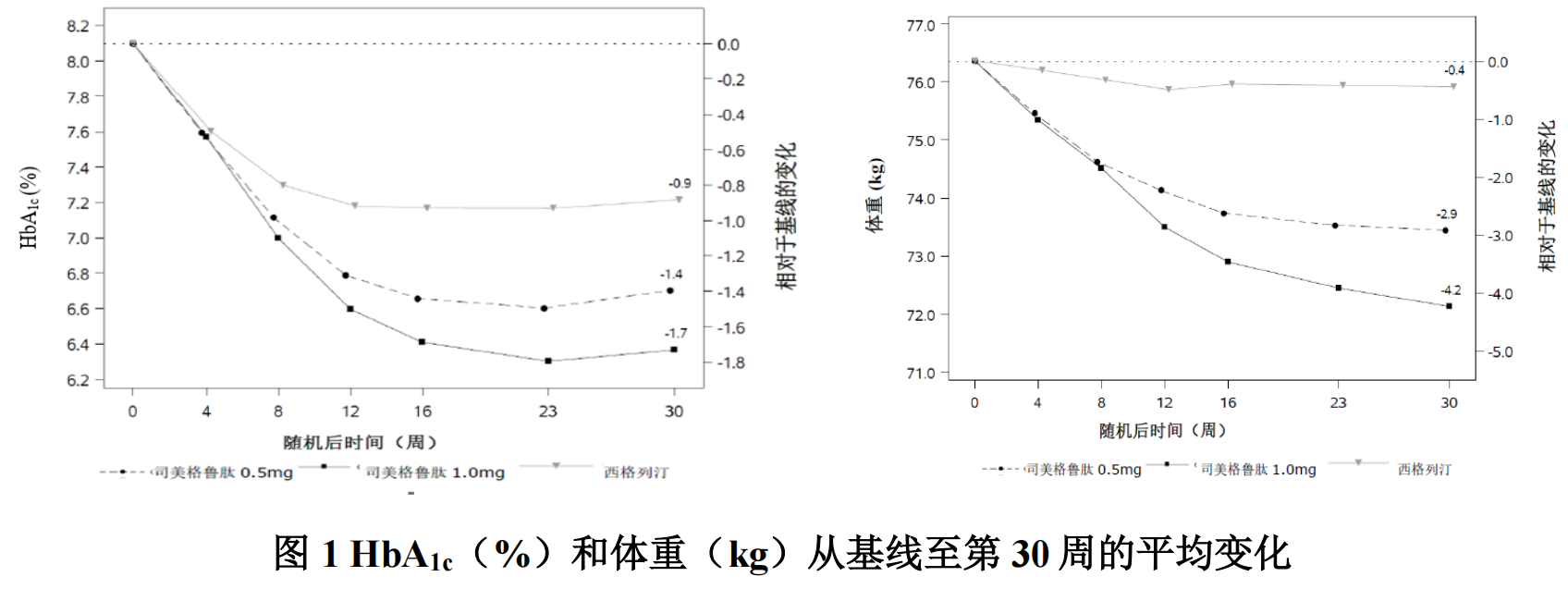
在一项为期 30 周的双盲试验中,868 例患者随机分配至本品 0.5mg 每周一次组、本品 1mg 每周一次组或西格列汀 100mg 每日一次组。
表 4 NN9535-4114 研究:第 30 周时的结果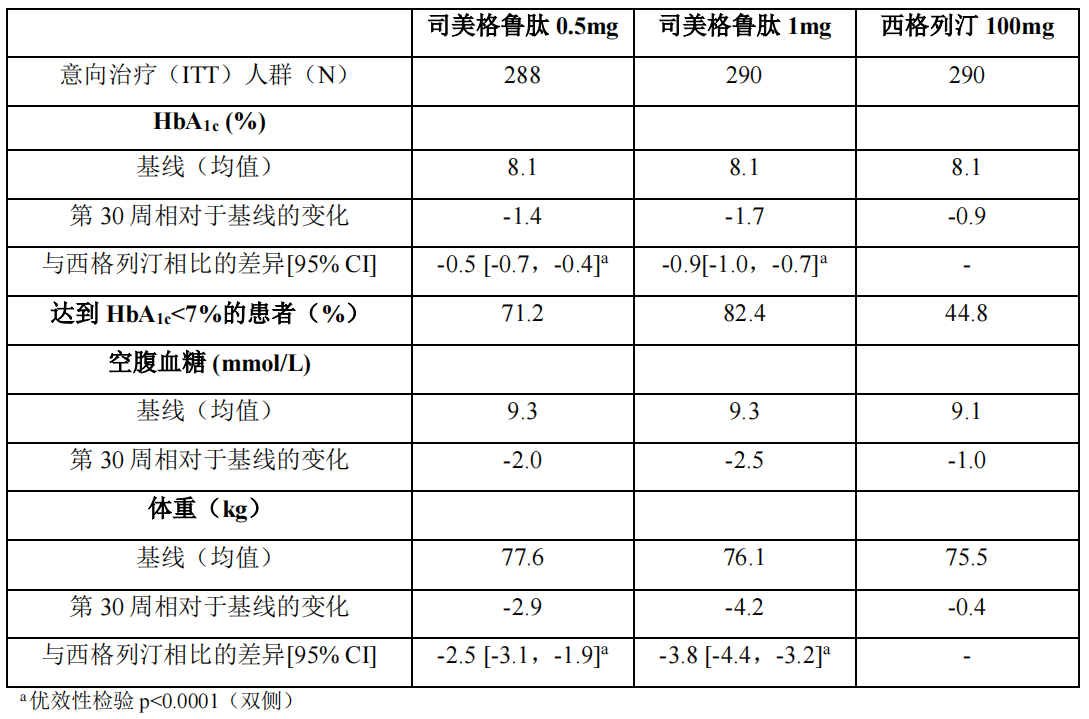
2)以度拉糖肽为对照研究(SUSTAIN 7)
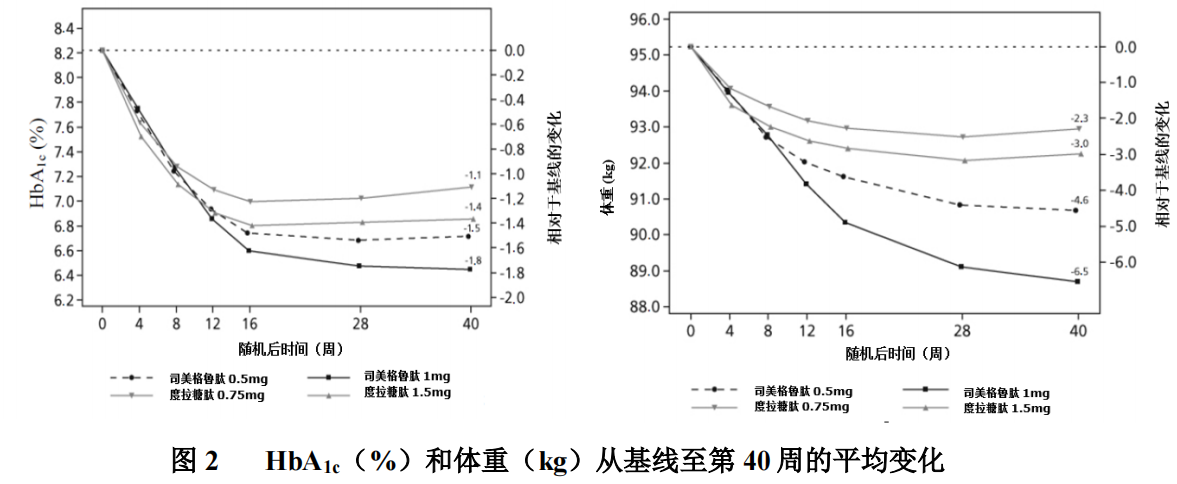
在一项为期 40 周、开放性试验中,1201 例接受二甲双胍的患者分别以1:1:1:1 的比例随机分配至本品 0.5mg、度拉糖肽 0.75mg、本品 1mg、度拉糖肽1.5mg 每周一次治疗组。该试验比较了 0.5mg 本品与 0.75mg 度拉糖肽以及 1mg本品与 1.5mg 度拉糖肽。
胃肠道不适是最常见的不良事件,接受本品 0.5mg(129 例患者[43%])、本品 1mg(133 例患者[44%])和度拉糖肽 1.5mg(143 例患者[48%])的患者比例相似;度拉糖肽 0.75mg 治疗组发生胃肠道不适的患者较少(100 例患者[33%])。
第 40 周时,本品(0.5mg 和 1mg)和度拉糖肽(0.75mg 和 1.5mg)治疗患者的脉率增加分别为 2.4、4.0 和 1.6、2.1 次/分。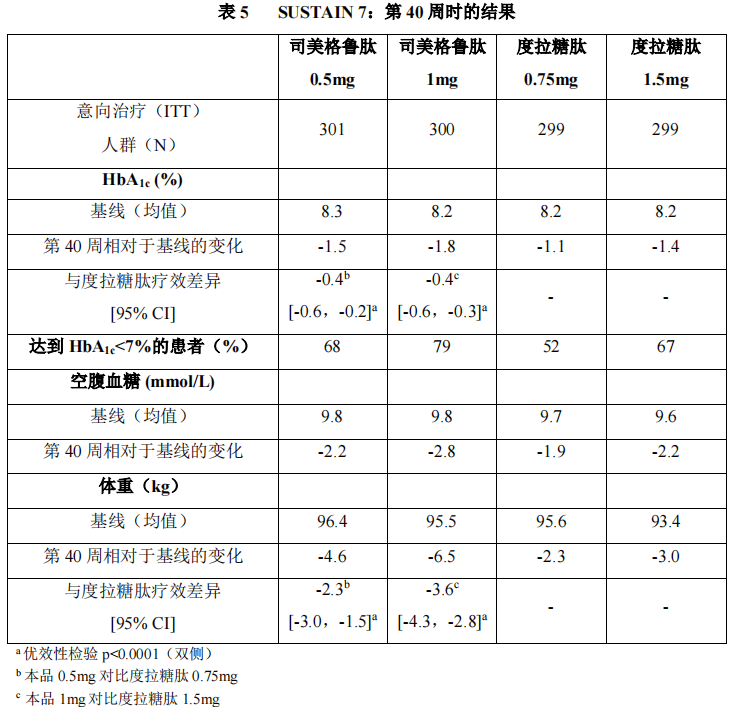
本品与磺脲类药物联合治疗
在心血管研究(SUSTAIN 6)中,123 例患者在基线时接受磺脲类单药治疗。本品 0.5mg 组、本品 1mg 组和安慰剂组基线时 HbA1c分别为 8.2%、8.4%和8.4%。在第 30 周,本品 0.5mg 组和本品 1mg 组以及安慰剂组的 HbA1c变化分别为-1.6%、-1.5%和 0.1%。
心血管研究(SUSTAIN 6)
在一项为期 104 周的双盲试验中,3297 例心血管高风险 2 型糖尿病患者,在标准治疗基础上,随机接受本品 0.5mg 每周一次、本品 1mg 每周一次或相应的安慰剂,治疗并随访两年。在整个试验中,98%的患者完成了试验,99.6%的患者在试验结束时可获知生命状态。
按年龄分布的试验人群:1598 例患者(48.5%)≥65 岁,321 例(9.7%)≥75 岁,20 例(0.6%)≥85 岁。有 2358 例肾功能正常或轻度肾损害患者,832 例中度和 107 例重度或终末期肾损害患者。61%是男性,平均年龄为 65 岁,平均BMI 为 33 kg/m2。糖尿病的平均病程是 13.9 年。
主要终点为从随机化至首次发生主要心血管不良事件(MACE:心血管死亡、非致死性心肌梗死或非致死性卒中)的时间。
发生 MACE 终点组分的总数为 254,包括司美格鲁肽组 108 例(6.6%)和安慰剂组 146 例(8.9%)。主要和次要心血管终点的结果见图 4。司美格鲁肽治疗可使包括心血管死亡、非致死性心肌梗死和非致死性卒中的主要复合终点风险降低 26%。心血管死亡、非致死性心肌梗死和非致死性卒中的例数分别为 90、111 和 71,其中司美格鲁肽组分别为 44 例(2.7%)、47 例(2.9%)和 27 例 (1.6%)(图 4)。主要复合终点的风险降低主要由非致死性卒中发生率降低(39%)和非致死性心肌梗死发生率降低(26%)所驱动(图 3)。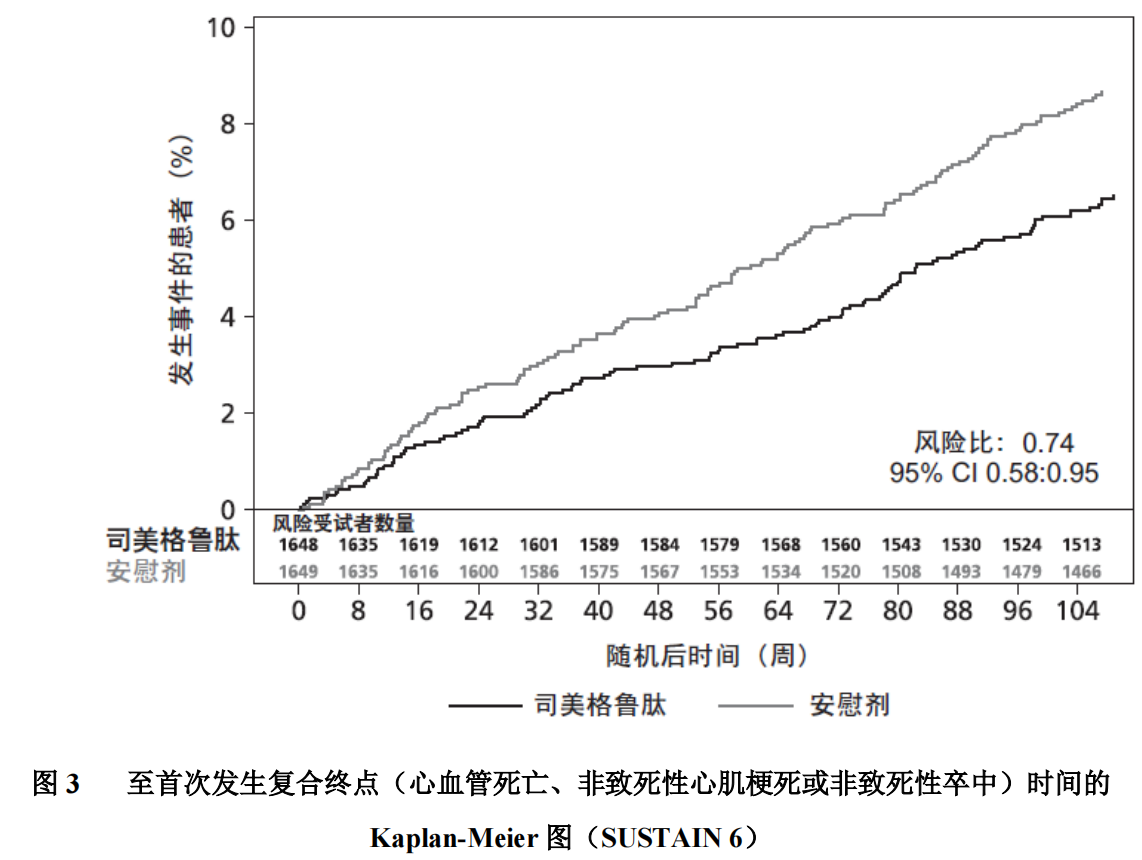
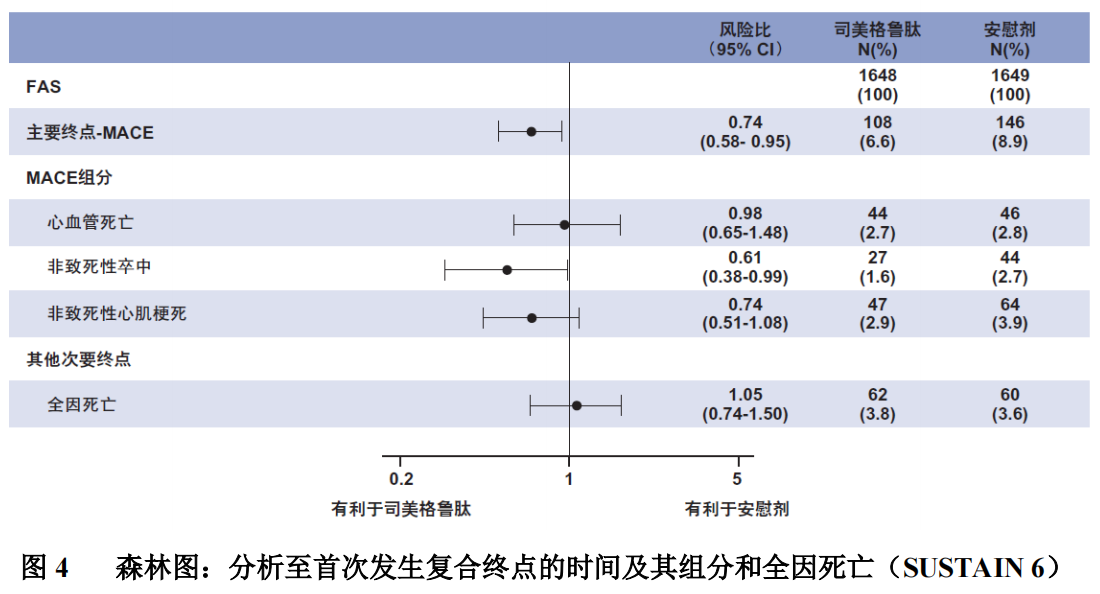
有 158 例新发或恶化的肾病(新发持续大量白蛋白尿,血清肌酐持续加倍,需要持续肾脏替代治疗,肾脏疾病导致的死亡)事件。至肾病时间的风险比[95%CI]为 0.64[0.46;0.88],由新发持续大量白蛋白尿驱动。
体重
治疗 1 年后,与活性对照西格列汀组(18%和 3%)和艾塞那肽缓释制剂组 (17%和 4%)相比,本品 0.5mg 组(46%和 13%)和 1mg 组(52-62%和 21-24%)有更多受试者实现了≥5%和≥10%的体重减轻。
在与度拉糖肽进行比较的 40 周试验中,本品 0.5mg 治疗组(44%和 14%)与度拉糖肽 0.75mg 治疗组(23%和 3%)相比,以及本品 1mg 治疗组(高达63%和 27%)与度拉糖肽 1.5mg 治疗组(30%和 8%)相比有更多受试者达到体重降低≥5%和≥10%。 在 SUSTAIN 6 中,在标准治疗基础上,观察到本品 0.5mg 组和 1mg 组与安慰剂 0.5mg 组和 1mg 组相比,自基线至第 104 周出现体重显著和持续减轻(分别为本品 0.5mg 组和 1mg 组-3.6kg 和-4.9kg 安慰剂组-0.7kg 和-0.5kg)。
血压
在已经开展的研究中,可在本品 0.5mg 组和 1mg 组中观察到平均收缩压显著降低(分别为 3.5-5.1mmHg,5.4-7.3mmHg)。司美格鲁肽组与对照组之间舒张压无明显差异。
与天然 GLP-1 相比,司美格鲁肽的半衰期较长,约为 1 周,使其适合每周一次皮下给药。其作用延长的主要机制为与白蛋白结合,这使其肾脏清除减少并保护其不被代谢降解。此外,司美格鲁肽能抵抗 DPP-4 酶的降解,从而增加稳定性。
吸收
司美格鲁肽给药后 1-3 天达到最大浓度。每周一次给药 4-5 周后达到稳态暴露。在 2 型糖尿病患者中,司美格鲁肽 0.5mg 和 1mg 皮下给药后的平均稳态浓度分别为大约 16nmol/L 和 30nmol/L。司美格鲁肽 0.5mg 和 1mg 的暴露量随剂量成比例增加。司美格鲁肽皮下注射给药,在腹部、大腿或上臂可获得相似的暴露水平。司美格鲁肽皮下给药的绝对生物利用度是 89%。
分布
在 2 型糖尿病患者中,司美格鲁肽皮下给药后的平均分布容积约为 12.5L。司美格鲁肽可与血浆白蛋白广泛结合(>99%)。
代谢
排泄前,司美格鲁肽先经过肽骨架的蛋白酶剪切和脂肪酸侧链的顺序 β 氧化而广泛代谢。中性内肽酶(NEP)可能参与司美格鲁肽的代谢。
消除
在放射性标记的司美格鲁肽的单次皮下给药研究中,发现司美格鲁肽相关物质的主要排泄途径是尿液和粪便;约 2/3 的司美格鲁肽相关物质经尿液排泄,约1/3 经粪便排泄。约 3%的司美格鲁肽以原形经尿液排泄。在 2 型糖尿病患者中,司美格鲁肽清除率约为 0.05L/h。其消除半衰期约为 1 周,末次给药后约 5 周体循环中仍存在有司美格鲁肽。
特殊人群
老年人群
基于包括 20-86 岁患者在内的Ⅲa 期研究的数据,年龄对司美格鲁肽的药代动力学无影响。
性别、人种和种族
性别、人种(白人、黑人或非裔美国人、亚洲人)和种族(西班牙裔或拉美裔、非西班牙裔或拉美裔)对司美格鲁肽的药代动力学无影响。
体重
体重对司美格鲁肽的暴露量有影响。体重越重,暴露量越低;个体间体重20%的差异将导致暴露量相差约 16%。在 40-198kg 体重范围内,0.5mg 和 1mg的司美格鲁肽给药可提供充分的全身暴露。
肾损害
肾损害对司美格鲁肽的药代动力学并无具有临床意义的影响。在肾功能正常受试者和不同程度肾损害的患者(轻度、中度、重度或透析患者)中,比较0.5mg 司美格鲁肽单次给药后的试验结果,验证了上述结论。根据Ⅲa 期研究数据,伴有肾损害的 2 型糖尿病受试者的表现也符合上述结论,但在终末期肾病患者中的使用经验有限。
肝损害
肝损害对司美格鲁肽的暴露量没有影响。在不同程度的肝损害(轻度、中度、重度)患者和肝功能正常受试者中进行比较,评价了 0.5mg 司美格鲁肽单次给药后的药代动力学特点。
儿童人群
尚未在儿童人群中进行司美格鲁肽的研究。
注射剂
1.34mg/ml,3ml(预填充注射笔)
本品为一次性预填充注射笔,由笔式注射器和装有 3ml 液体的笔芯组成。笔芯由 1 型玻璃制成,笔芯的一端由橡胶活塞(氯化丁基橡胶)封闭,另一端插入带有橡胶垫片(溴化丁基/聚异戊二烯)的铝盖。该注射笔由聚丙烯、聚甲醛、聚碳 酸酯和丙烯腈-丁二烯苯乙烯组成。 每支笔含有 3ml 溶液,每次仅可注射 1mg 剂量。该注射笔仅用于 1mg 剂量的维 持治疗。 包装规格:1 支/盒
首次使用前:储存于冰箱中(2℃-8℃)。远离冷冻元件。切勿冷冻本品, 冷冻后切勿使用。盖上笔帽避光保存。 首次使用后:储存于 30℃以下环境或冰箱中(2℃-8℃)。切勿冷冻本品, 冷冻后切勿使用。不用时盖上笔帽,以避光保存。 每次注射后和储存本品时应取下针头。这可以防止针头阻塞、污染、感染、 溶液泄漏和给药不准确。
36 个月。
国药准字SJ20210014,国药准字SJ20210015

