新可来 NUCALA说明书
Mepolizumab Injection
美泊利珠单抗
活性成份:美泊利珠单抗
辅料:蔗糖、枸橼酸、磷酸氢二钠、乙二胺四乙酸二钠、聚山梨酯 80
本品应为澄清至乳光,无色至浅黄色至浅棕色溶液,装于单剂量预充式自动注射器或单剂量预充式安全注射器中。
用于成人嗜酸性肉芽肿性多血管炎(EGPA)。
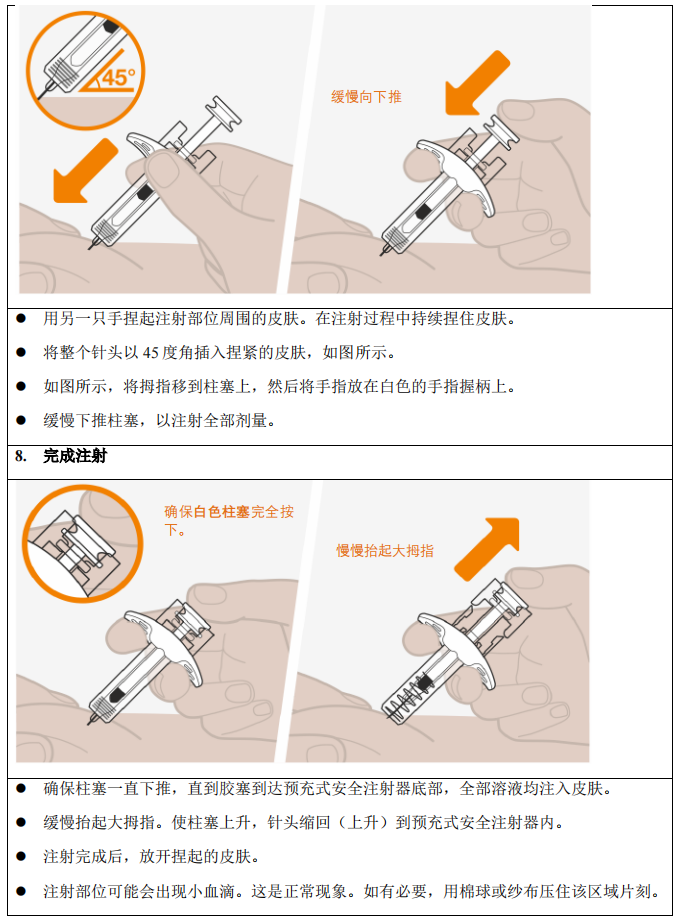
本品只能经皮下注射给药。
本品的推荐给药剂量为 300 mg,每 4 周一次。可在上臂、大腿或腹部皮下注射,分 3 次进行,每次 100 mg。注射位点之间至少间隔 5 cm。
本品预充式自动注射器和预充式安全注射器准备和给药的详细步骤见【使用说明】。
特殊人群用药
老年患者(≥65 岁):基于现有数据,无需对老年患者进行剂量调整(参见【老年用药】、【药代动力学】)。
肾功能或肝功能不全患者:基于现有数据,无需对肾功能不全患者或肝功能不全患者进行剂量调整(参见【药代动力学】)。
使用说明
美泊利珠单抗注射液,通过预充式自动注射器或预充式安全注射器皮下注射,每 4 周给药
一次。
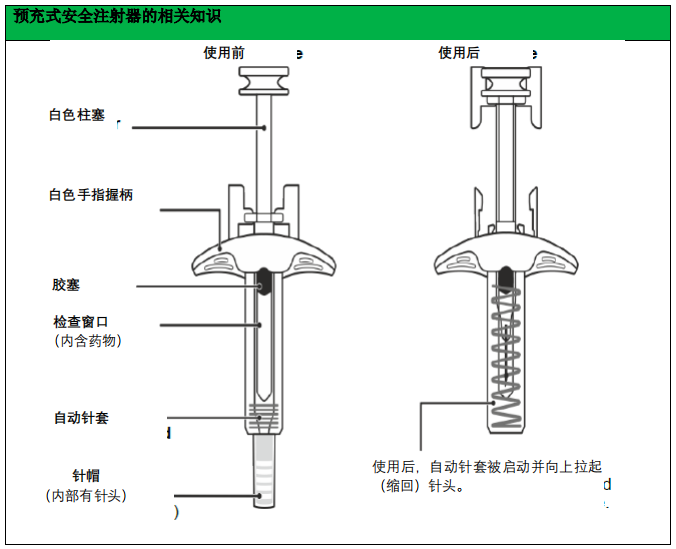
本品预充式自动注射器和预充式安全注射器的准备和给药
本品应在医护人员指导下使用。如果医护人员认为适当,则患者可以自行注射或由照料者
皮下注射本品。在使用前,根据【使用说明】为患者提供皮下注射技术、本品准备和给药方面
的适当培训。
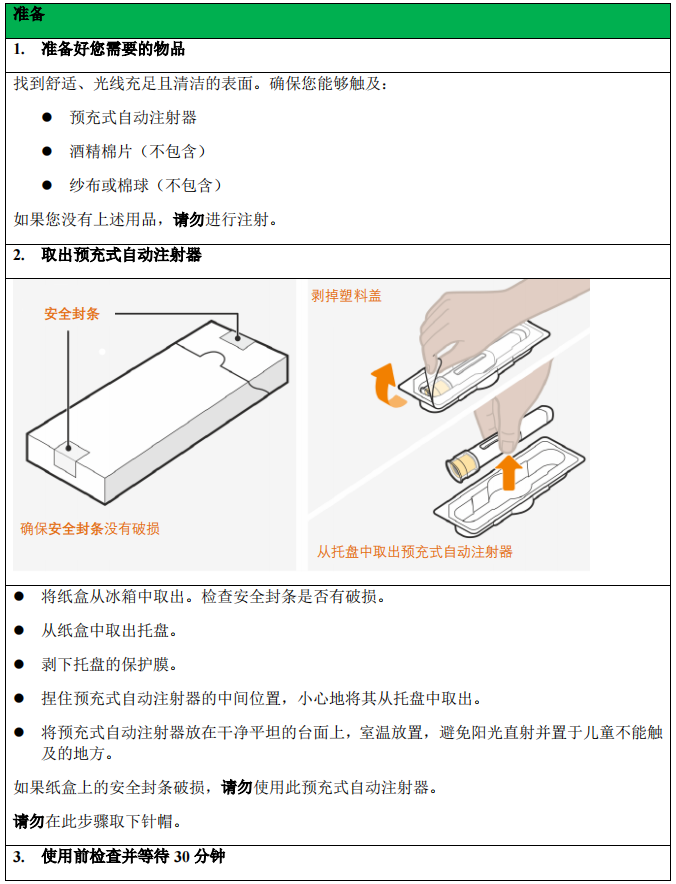
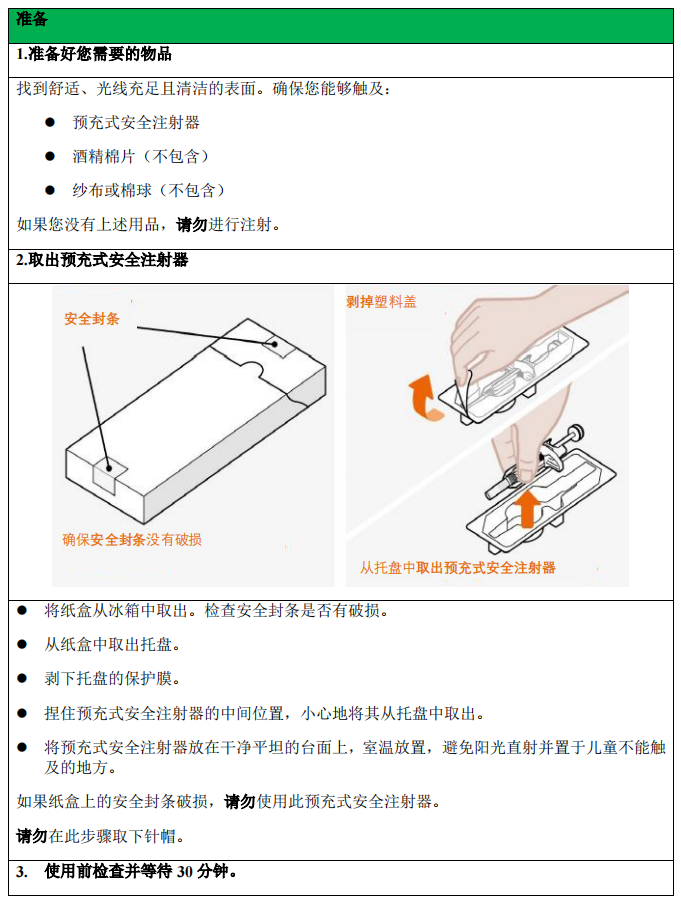
1. 将预充式自动注射器或预充式安全注射器从冰箱中取出,使其在室温下放置 30 分钟。
不得以其他任何方式加温本品。
2. 给药前,通过检查窗口目视检查注射器内的药液是否有颗粒物或变色。本品应为澄清
至乳光,无色至浅黄色至浅棕色。如果本品出现变色、浑浊或颗粒物,请勿使用。如果本品预
充式自动注射器或预充式安全注射器掉落在硬表面,请勿使用。
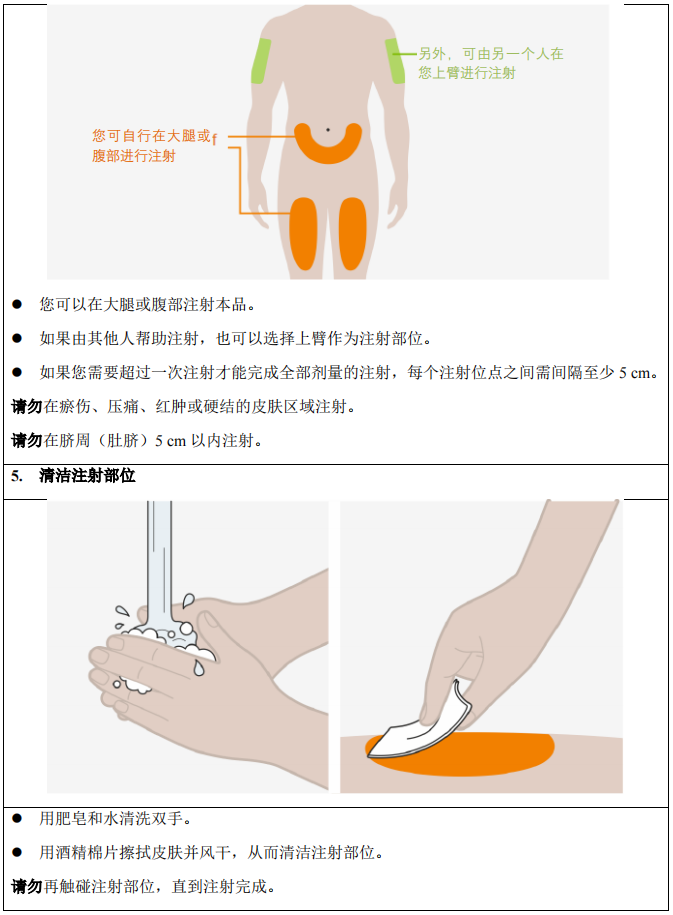
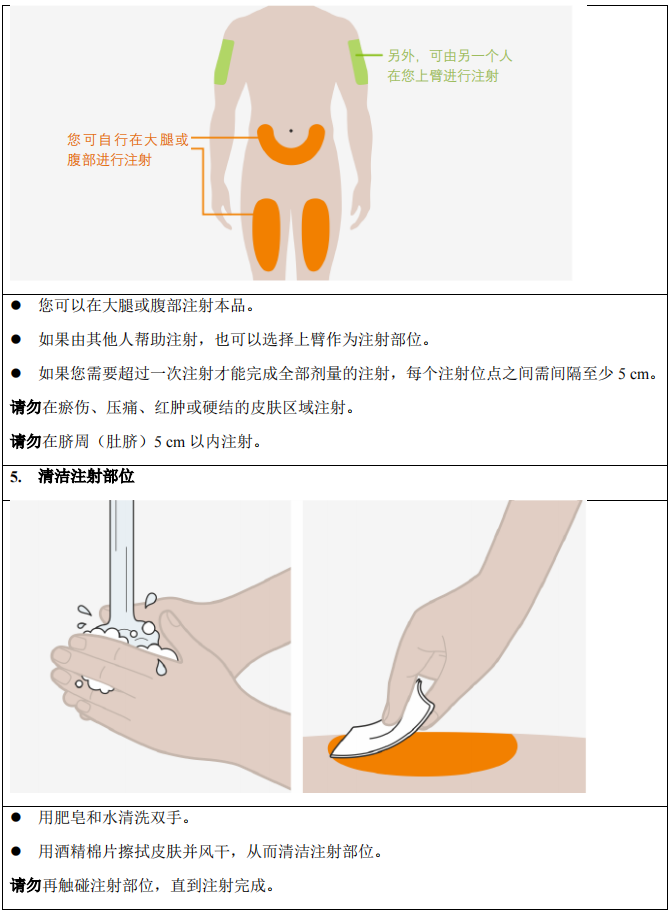
3. 在大腿或腹部进行皮下注射,避开肚脐周围 5 cm 区域。如果由照料者皮下注射,则上
臂也可以使用。
4. 确保每次皮下注射的注射位点间隔至少 5 cm。
5. 禁止在有压痛、瘀伤、红肿或硬结的皮肤区域注射。
6. 如有遗漏剂量,应尽快补充注射。此后,患者可以在常规的用药日继续用药。如果已
经到了下一次给药的时间,则按计划给药。
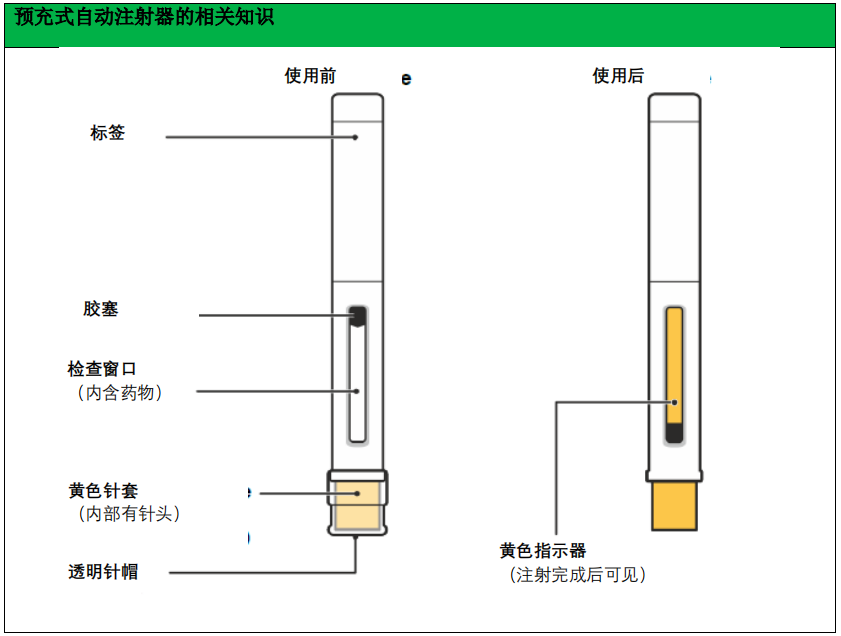
预充式自动注射器
请按照以下关于如何使用预充式自动注射器的说明正确使用。如不遵循使用说明,则可能
会影响预充式自动注射器的正常功能。此外,您还应该接受有关如何使用预充式自动注射器的
培训。
本品预充式自动注射器仅供皮下注射用
如何保存
2℃至 8℃冷藏。
置于原包装内避光保存。
置于儿童不易触及的地方。
禁止冷冻。
请勿摇晃。
避免暴露于高温。
本品从纸盒中取出后须在 8 小时内使用。如果未在 8 小时内使用,则丢弃。
使用前须知
预充式自动注射器仅供一次性使用,使用后应丢弃。
请勿与他人共用您的预充式自动注射器。
请勿摇晃预充式自动注射器。
如果预充式自动注射器掉落在硬表面上,请勿使用。
如果预充式自动注射器有损坏迹象,请勿使用。
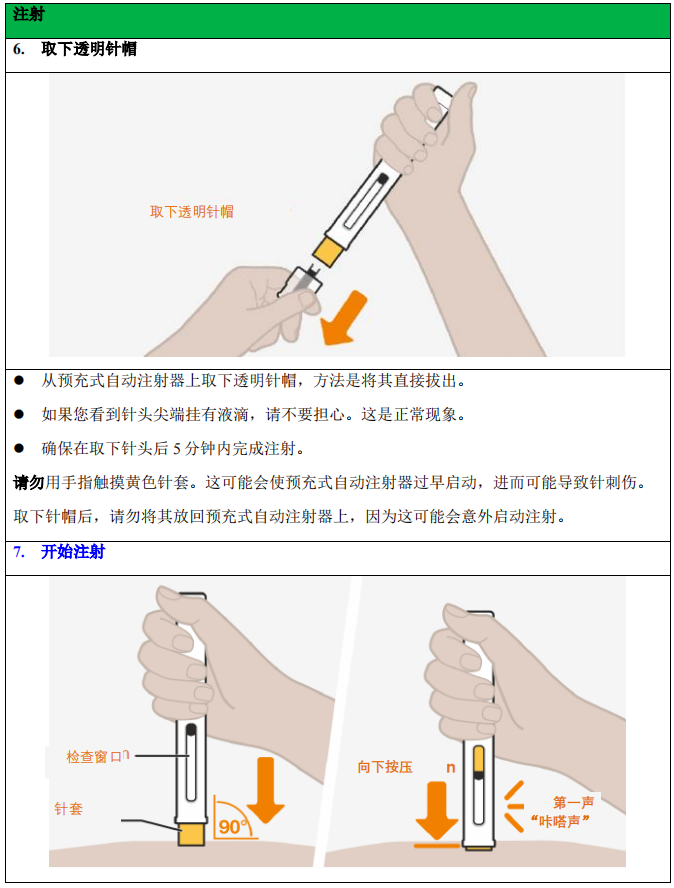
注射前,请勿取下针帽。

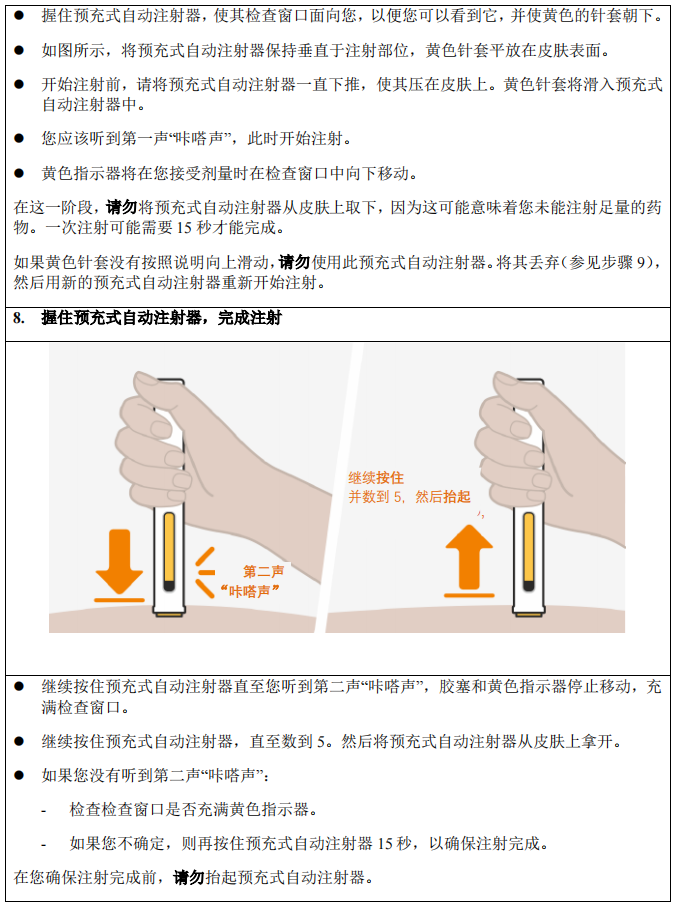

预充式安全注射器
请按照以下关于如何使用预充式安全注射器的说明正确使用预充式安全注射器。如不遵循使用
说明,则可能会影响预充式安全注射器的正常功能。此外,您还应该接受有关如何使用预充式
安全注射器的培训。
本品预充式安全注射器仅供皮下注射用。
如何保存
2℃至 8℃冷藏。
置于原包装内避光保存。
置于儿童不易触及的地方。
禁止冷冻。
请勿摇晃。
避免暴露于高温。
本品从纸盒中取出后须在 8 小时内使用。如果未在 8 小时内使用,则丢弃。
使用前
预充式安全注射器仅供一次性使用,使用后应丢弃。
请勿与他人共用您的预充式安全注射器。
请勿摇晃预充式安全注射器。
如果预充式安全注射器掉落在硬表面上,请勿使用。
如果预充式安全注射器有损坏迹象,请勿使用。
注射前,请勿取下针帽。


下表列出了在患有其他嗜酸性粒细胞性疾病(重度哮喘)的受试者的安慰剂对照研究中,接受美泊利珠单抗100 mg皮下给药的(n=263)的不良反应发生频率,以及来自自发性上市后报告的不良反应。
在一项针对EGPA受试者的52周双盲安慰剂对照研究中(300 mg美泊利珠单抗皮下给药n=68,安慰剂n=68),未发现不同于重度嗜酸性粒细胞性哮喘研究中受试者报告的其他不良反应。
采用下述约定定义不良反应频率:十分常见(≥ 1/10)、常见(≥ 1/100 - < 1/10)、偶见(≥ 1/1,000 - < 1/100)和罕见(≥1/10,000 - <1/1,000)。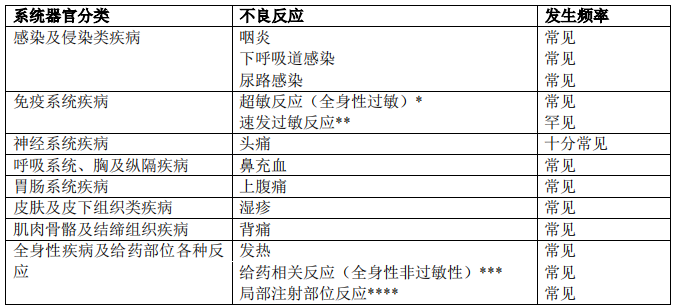
* 据报告,在重度嗜酸性粒细胞性哮喘研究中,包括超敏反应在内的全身性反应的整体发生率与安慰剂组相似。所报告的不良反应相关表现的示例和发病时间描述见【注意事项】。
** 来自自发性上市后报告。
*** 在重度嗜酸性粒细胞性哮喘研究的受试者中,与全身性非过敏性给药相关反应相关的最常见的表现是皮疹、潮红和肌痛;这些表现的报告频率并不高,在皮下接受美泊利珠单抗 100 mg 的受试者中报告率<1%。
****与皮下注射相关的最常见的症状包括:疼痛、红斑、肿胀、瘙痒和灼热感。
在其他章节对以下不良反应进行了更为详细的讨论:
超敏反应(参见【注意事项】)
机会性感染:带状疱疹(参见【注意事项】)
因为临床试验是在各种不同的情况下开展,所以在一种药物的临床试验中观察到的不良反应发生率不能直接与在另一种药物的临床试验中观察到的不良反应发生率进行比较,并且可能无法反映真实的发生率。
嗜酸性肉芽肿性多血管炎(EGPA)的临床试验
在 1 项随机、安慰剂对照、多中心、52 周试验中,共对 136 例 EGPA 受试者进行了评价。
受试者接受 300 mg 本品或安慰剂皮下给药,每 4 周一次。纳入的受试者既往诊断为 EGPA 至 少 6 个月,有复发或难治性疾病史,且在入组前口服稳定剂量的泼尼松龙或泼尼松(每日口服糖皮质激素 OCS 剂量≥7.5 mg,且≤50 mg)至少 4 周(参见【临床试验】)。其中,59%的受试者为女性,92%为白人,年龄范围为 20 岁至 71 岁。
全身性反应,包括超敏反应
在 52 周试验中,发生全身性(过敏性和非过敏性)反应的受试者百分比为:本品 300 mg组 6%,安慰剂组 1%。本品 300 mg 组 4%受试者和安慰剂组 1%受试者报告全身性过敏/超敏反应。本品 300 mg 治疗组报告的全身性过敏/超敏反应的表现包括皮疹、瘙痒、潮红、疲乏、高血压、躯干和颈部发热感、四肢厥冷、呼吸困难和喘鸣。本品 300 mg 组 1 例(1%)受试者和安慰剂组 0 例受试者报告全身性非过敏性反应。本品 300 mg 治疗组报告的全身性非过敏性反应表现为血管性水肿。在接受本品 300 mg 治疗的受试者中,一半的(2/4)全身性反应发生在给药当天。
注射部位反应
在接受本品 300 mg 治疗的受试者中,注射部位反应(如疼痛、红斑、肿胀)的发生率为15%,而安慰剂组为 13%。
免疫原性
在接受 300 mg 本品治疗的 EGPA 受试者中,1/68(< 2%)例检出抗美泊利珠单抗抗体。
在所有 EGPA 受试者中均未检出中和抗体。
在接受本品 100 mg 治疗的患有其他嗜酸性粒细胞性疾病(重度哮喘)的成人和青少年受试者中,15/260 例(6%)出现了抗美泊利珠单抗抗体。本品 100 mg 组中有 1 例患有其他嗜酸性粒细胞性疾病(重度哮喘)的受试者检出中和抗体。抗美泊利珠单抗抗体使得美泊利珠单抗清除率略微增加(约 20%)。尚无证据表明抗美泊利珠单抗抗体滴度和嗜酸性粒细胞水平变化之间存在关联。存在抗美泊利珠单抗抗体的临床意义尚不明确。在接受本品 40 mg 或 100 mg治疗的患有其他嗜酸性粒细胞性疾病(6 至 11 岁重度哮喘儿童)的受试者中,2/35 例(6%)在试验起始的短期阶段内检测到抗美泊利珠单抗抗体。在试验的长期阶段,无儿童检测到抗美泊利珠单抗抗体。
在接受本品 300 mg 治疗的患有其他嗜酸性粒细胞性疾病(成人和青少年高嗜酸性粒细胞增多综合征(HES))的受试者中,1/53(2%)例被检出抗美泊利珠单抗抗体。未在任一受试者中检出中和抗体。
报告的抗美泊利珠单抗抗体发生率可能低估了实际发生率,因为在高药物浓度时试验灵敏度较低。数据反映了特定试验中美泊利珠单抗抗体试验结果为阳性的受试者百分比。试验过程中观察到的抗体阳性发生率可能很大程度上取决于多个因素,包括检测方法敏感性及特异性、检测方法学、样本处理、样本采集时间、合并用药及基础疾病。
已知对本品中活性物质或任何辅料过敏的患者禁用。
超敏反应
本品给药后出现超敏反应(如速发过敏反应、血管性水肿、支气管痉挛、低血压、荨麻疹、皮疹)。这些反应通常发生在给药后数小时内,但有时迟发(即数天内)。如果出现超敏反应,则终止本品给药(参见【禁忌】)。
急性哮喘症状或疾病恶化
本品不得用于治疗急性哮喘症状或急性加重。本品不得用于治疗急性支气管痉挛或哮喘持续状态。
机会性感染:带状疱疹
在其他嗜酸性粒细胞性疾病(重度哮喘)的临床试验中接受美泊利珠单抗治疗的受试者中发生了带状疱疹。如果从医学角度适用,考虑接种疫苗。
糖皮质激素剂量降低
本品治疗开始后,不得突然停用全身或吸入性糖皮质激素(ICS)。如有需要,应逐渐降低糖皮质激素剂量,并且在医生指导下进行。糖皮质激素减量可能与全身性戒断症状和/或先前被全身糖皮质激素治疗抑制作用掩盖的疾病有关。
寄生虫(蠕虫)感染
嗜酸性粒细胞可能参与某些蠕虫感染的免疫应答。临床试验受试者中排除了已知感染寄生虫的患者。目前尚不清楚本品是否会影响患者对寄生虫感染的应答。已患有蠕虫感染的患者应在开始本品治疗前进行蠕虫感染治疗。如果患者在接受本品治疗期间感染蠕虫,而且对抗蠕虫治疗无应答,应考虑终止本品治疗直至感染痊愈。
对驾驶和操作机械能力的影响
尚未开展本品对驾驶或操作机械能力影响的研究。根据本品的药理学或不良反应特征,预计不会对此类活动产生不利影响。
在美泊利珠单抗用药过量情况下,没有特定治疗可供选择。如果出现药物过量,应给予患者支持性治疗,并根据需要进行适当的监测。
有关妊娠暴露的数据不足以提供有关药物相关风险的信息。单克隆抗体(如美泊利珠单抗)可随着妊娠的进展以线性方式穿过胎盘,因此,在妊娠的中期和晚期,对胎儿的潜在影响可能会更大。在食蟹猴中进行的产前和产后发育研究中,在导致暴露量约为人体最大推荐剂量(MRHD)300 mg 皮下注射时暴露量约 9 倍的剂量下,没有证据表明在整个妊娠期间静脉给予美泊利珠单抗会对胎仔造成伤害。只有在对母亲的预期收益超过了对胎儿的潜在风险时,才可在妊娠期使用美泊利珠单抗。尚未获得美泊利珠单抗是否进入人乳汁、对母乳喂养婴儿产生影响或对乳汁产生影响的相关信息。然而,美泊利珠单抗是一种人源化单克隆抗体(IgG1 κ),在人乳中存在少量的免疫球蛋白 G(IgG)。在妊娠期间接受给药的产后食蟹猴乳汁中存在美泊利珠单抗(参见【药理毒理】)。应一并考虑以下因素:哺乳带来的发育和健康获益、母亲对本品的临床需求以及美泊利珠单抗或母亲的潜在疾病对哺乳期婴儿造成的任何潜在不良影响。尚未在 18 岁以下 EGPA 患者中确定安全性和有效性。本品临床试验中未纳入足够数量≥65 岁的受试者接受本品治疗(n=50),所以无法明确老年人应用本品后的治疗应答是否与年轻人有所不同。报告的其他临床经验未见老年患者和年轻患者间在治疗应答方面存在任何差异。基于现有数据,老年患者不需要调整本品剂量,但不能排除一些老年人的敏感度更高。
尚未对本品开展正式药物相互作用试验。
Glaxo Operations UK Ltd.
86982649000026,86982649000019
美泊利珠单抗是一种抗白细胞介素-5(IL-5)单克隆抗体(IgG1κ)。IL-5 是参与嗜酸性粒细胞生长和分化、聚集、活化和存活的主要细胞因子。美泊利珠单抗可与 IL-5 结合,解离常数为 100 pM,通过阻碍 IL-5 与嗜酸性粒细胞表面表达的 IL-5 受体复合物的 α 链结合,抑制其生物活性。炎症是嗜酸性肉芽肿性多血管炎(EGPA)和其他嗜酸性粒细胞性疾病(哮喘和 HES)发病机制的重要组成部分,有多种类型的细胞(例如肥大细胞、嗜酸性粒细胞、中性粒细胞、巨噬细胞、淋巴细胞)和介质(例如组胺、类花生酸、白三烯、细胞因子)参与炎症过程。美泊利珠单抗通过抑制 IL-5 信号传导,减少嗜酸性粒细胞的生成和存活;然而,美泊利珠单抗在 EGPA 和其他嗜酸性粒细胞性疾病(哮喘和 HES)中的作用机制尚未完全确定。
生殖毒性
在一般毒理学研究中,食蟹猴连续 6 个月、每 4 周一次静脉注射美泊利珠单抗,最高剂量100 mg/kg [以 AUC 计,约为人最大推荐剂量(MRHD)300 mg/天的 20 倍],生殖器官未见不良组织病理学结果,提示对雌雄食蟹猴生育力无影响。在一项生育力、早期胚胎发育和胚胎-胎仔发育研究中,CD-1 小鼠每周一次静脉给予可抑制鼠 IL-5 活性的类似抗体 50 mg/kg,未见对雌雄动物生育力、交配和生殖功能的影响。
围产期毒性试验中,妊娠食蟹猴于妊娠第 20 天至第 140 天每 4 周一次静脉注射美泊利珠单抗,最高剂量 100 mg/kg(以 AUC 计,约为 MRHD 的 9 倍),未见美泊利珠单抗对胎仔或新生幼仔出生后 9 个月内生长(包括免疫功能)的不良影响。该试验未进行内脏或骨骼畸形检查。在食蟹猴中,美泊利珠单抗可穿过胎盘。出生后幼仔中的美泊利珠单抗浓度比母体浓度约高 2.4 倍。乳汁中的美泊利珠单抗浓度≤母体血药浓度的 0.5%。
在一项生育力、早期胚胎和胎仔发育试验中,自交配前 2 周至交配后 14 天,每周一次静脉给予 CD-1 小鼠可抑制鼠 IL-5 活性的类似抗体 50 mg/kg,未见致畸作用。据报道与野生型小鼠相比,IL-5 缺陷型小鼠的胚胎/胎仔发育一般不受影响。
致癌性
未开展长期动物试验评估美泊利珠单抗的潜在致癌性。采用动物模型进行研究的文献表明,IL-5 和嗜酸性粒细胞是肿瘤发生部位早期炎症反应的一部分,可促进肿瘤排斥。但是,其他报告提示嗜酸性粒细胞浸润肿瘤可以促进肿瘤生长。因此,人类使用抗 IL-5 抗体(如美泊利珠单抗)致恶性肿瘤风险尚不明确。
药效学
EGPA 成人受试者接受美泊利珠单抗 300 mg 皮下注射每 4 周一次持续 52 周后,血嗜酸性
粒细胞几何平均计数降至 38 个/mcL。与安慰剂组相比降幅为 83%,此降幅在治疗 4 周内即可
观察到(参见【临床试验】)。
在血嗜酸性粒细胞水平>200 个细胞/mcL 的患有其他嗜酸性粒细胞性疾病(哮喘)的成人受试者中,评价了皮下(SC)或静脉(IV)重复给予美泊利珠单抗后的药效学应答(血嗜酸6性粒细胞减少)。受试者接受美泊利珠单抗 4 种剂量中的 1 种(每 28 天给药一次,共 3 次):12.5 mg SC、125 mg SC、250 mg SC 或 75 mg IV。70 例随机入组受试者中有 66 例完成试验。
与基线水平相比,血嗜酸性粒细胞呈剂量依赖性降低。至第 3 天(给药后 48 小时),所有治
疗组的血嗜酸性粒细胞水平均降低。在第 84 天(末次给药后 4 周),在 12.5 mg SC、75 mg IV、125 mg SC 和 250 mg SC 治疗组中,血嗜酸性粒细胞相对基线的几何平均降幅分别为 64%、78%、84%和 90%。模型估计的在第 84 天产生 50%和 90%最大血嗜酸性粒细胞降幅所对应的给药剂量(皮下给药)分别为 11 mg 和 99 mg。患有其他嗜酸性粒细胞性疾病(重度哮喘)的成人和青少年受试者接受美泊利珠单抗 100 mg 皮下注射每 4 周一次持续 32 周后,血嗜酸性粒细胞几
何平均计数降至 40 个/mcL,较安慰剂组降幅达 84%。还评估了 6 至 11 岁患有其他嗜酸性粒细胞性疾病(重度哮喘)的儿童的药效学应答(嗜酸性粒细胞减少)。每 4 周 SC 给予 40 mg 美泊利珠单抗治疗 52 周后,血嗜酸性粒细胞的几何平均计数降低为 48 个/mcL,相对于基线降幅达 85%。
在成人、青少年和儿童中,该降幅在治疗 4 周内即可观察到,并且该效应维持在整个治疗
期间。
对于患有其他嗜酸性粒细胞性疾病(HES)的成人和青少年,每 4 周一次皮下注射给予美
泊利珠单抗 300 mg,持续 32 周后,血嗜酸性粒细胞几何平均计数降至 70 个细胞/mcL。与安
慰剂组相比几何平均降幅为 92%。
EGPA 临床试验的有效性
在一项随机、安慰剂对照、多中心、52 周试验(NCT #02020889)中,共对 136 例 EGPA
成人受试者进行了评价。受试者接受 300 mg 本品或安慰剂皮下给药,每 4 周一次,同时继续
接受稳定剂量 OCS 治疗。治疗期间,从第 4 周开始,可根据研究者判定逐渐降低 OCS 剂量。
协同主要终点为 52 周治疗期间的总累积缓解持续时间,定义为伯明翰血管炎活动评分(BVAS)
= 0(无活动性血管炎)且泼尼松龙或泼尼松剂量≤4 mg/日,以及治疗第 36 周和第 48 周时均
达到缓解的受试者比例。BVAS 是一种由临床医生填写的问卷,用于评估排除其他原因后认为
可能需要治疗的临床活动性血管炎。
本试验中受试者的人口统计学和基线特征参见表 2。


EGPA 缓解
接受本品 300 mg 受试者的累积缓解时间显著长于接受安慰剂治疗的受试者。与安慰剂组
相比,接受 300 mg 本品治疗受试者在第 36 周和第 48 周均达到缓解的比例显著增加(表 3)。
缓解各组分的结果也在表 3 中展示。此外,与安慰剂组相比,接受 300 mg 本品治疗的受试者
在最初 24 周内达到缓解并在 52 周研究治疗期间的剩余时间内维持缓解的人数比例显著增高
(本品 300 mg 组为 19%,安慰剂组为 1%;OR 19.7;95% CI:2.3,167.9)。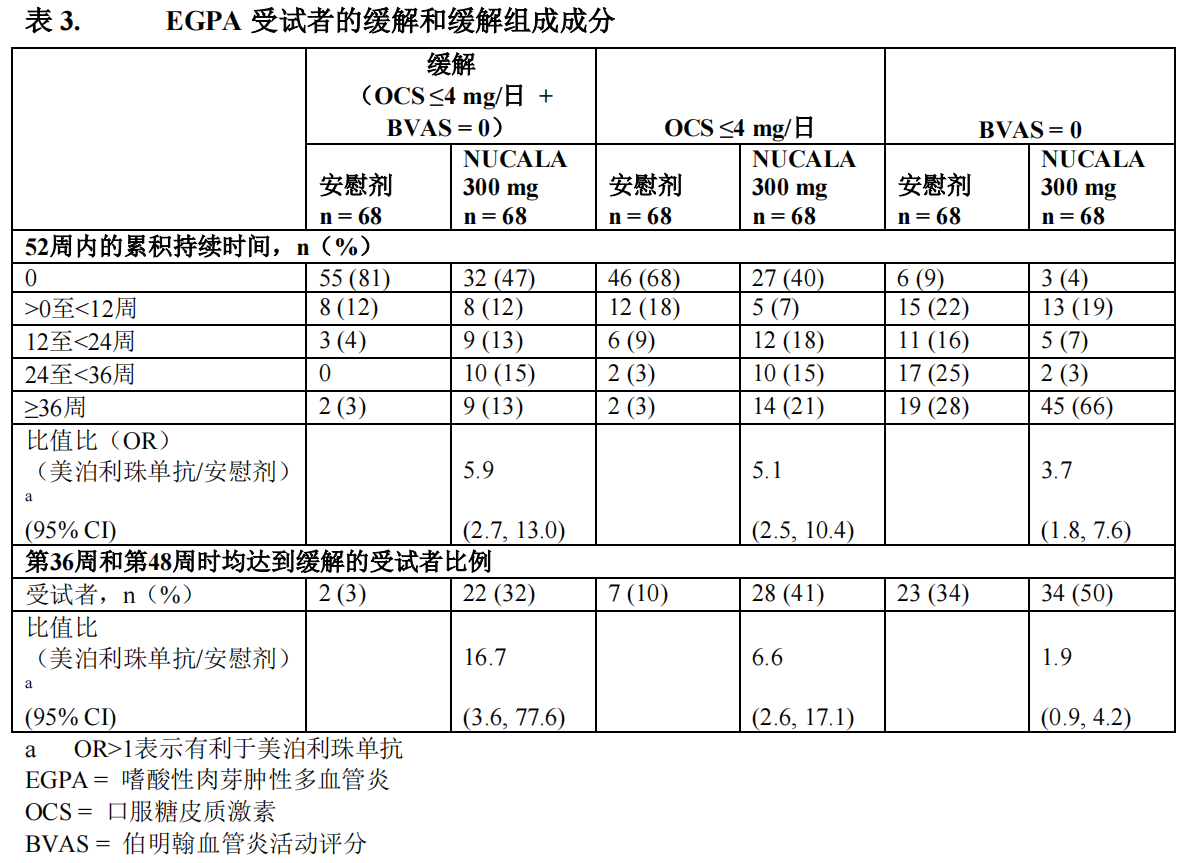
此外,当使用定义为 BVAS = 0 且泼尼松龙/泼尼松≤ 7.5 mg/日的缓解时,同样证明了在这些终点方面的统计学显著性获益。
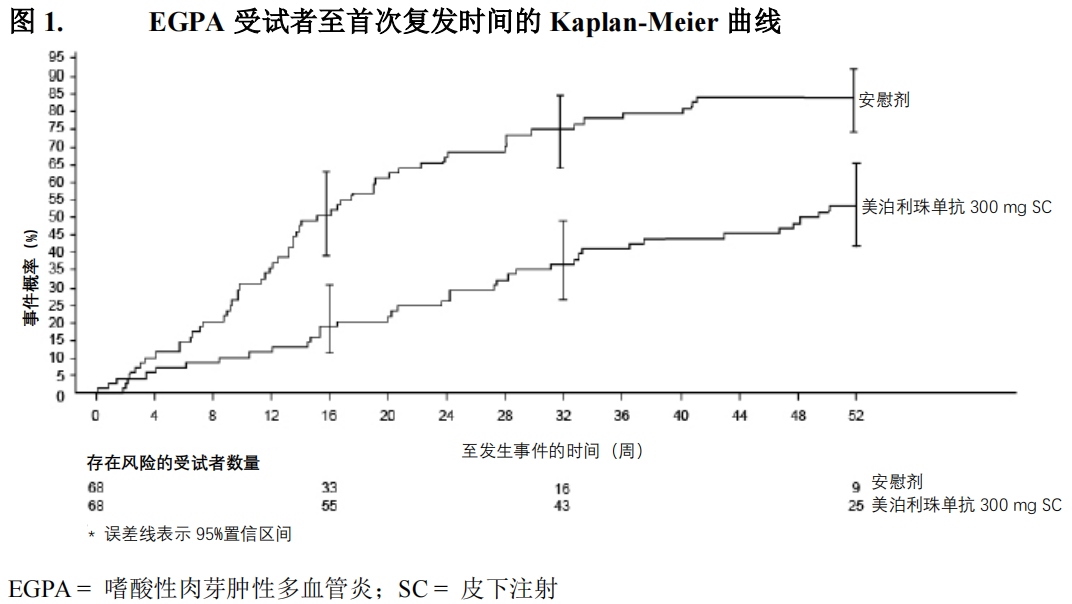
复发
接受本品 300 mg 的受试者中,至首次复发的时间(定义为需要增加糖皮质激素剂量或免疫抑制治疗或住院治疗的血管炎、哮喘或鼻窦症状相关的恶化)显著长于安慰剂组,风险比(HR,Hazard Ratio)为 0.32(95% CI:0.21,0.5)(图 1)。另外,本品 300 mg 治疗组受试者中的复发率低于安慰剂组受试者(300 mg 本品组与安慰剂组相比,率比(RR,Rate Ratio)为 0.50;95% CI:0.36,0.70)。与安慰剂组相比,美泊利珠单抗组不同复发类型(血管炎、哮喘、鼻窦炎)的发生率和次数在数值上均低于安慰剂组。
口服糖皮质激素剂量降低
与接受安慰剂的受试者相比,接受 300 mg 本品的受试者在第 48 周至第 52 周期间的平均OCS 每日剂量降低幅度增加(表 4)。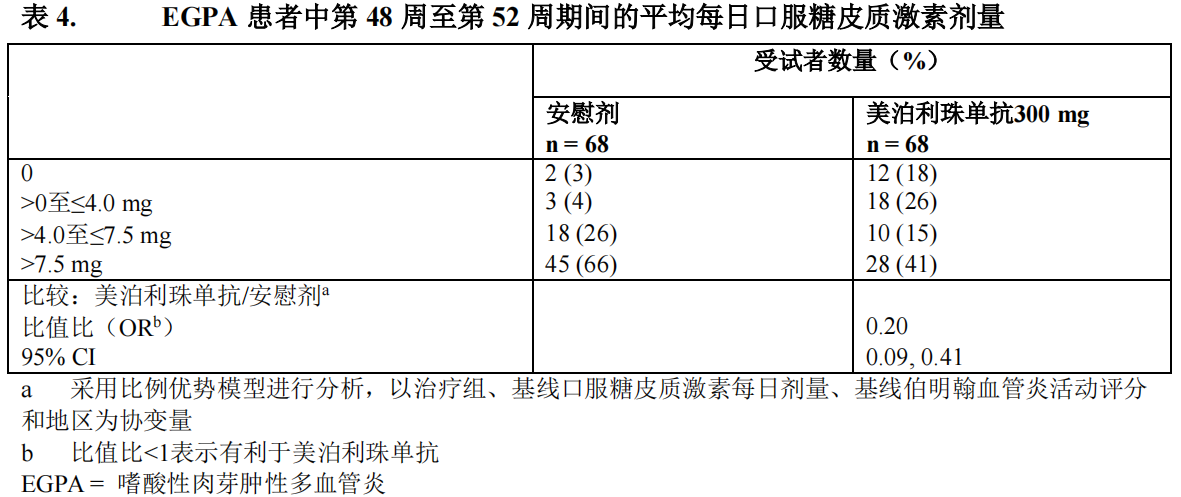
哮喘控制问卷-6(ACQ-6)
ACQ-6 是由 6 个项目组成的问卷,用于衡量哮喘控制的充分性和哮喘控制程度的变化,由受试者填写完成。在该 EGPA 临床试验中,第 48 至 52 周期间的治疗中 ACQ-6 应答率(定义为与基线相比评分下降 0.5 分或以上)为:本品 300 mg 组为 22%,安慰剂组为 16%(本品300 mg 与安慰剂组相比,OR 1.56;95% CI:0.63,3.88)。
美泊利珠单抗 12.5 mg 至 250 mg 剂量皮下给予患有其他嗜酸性粒细胞性疾病(哮喘)的成人受试者后,表现出大致与剂量成正比的药代动力学特征。在 EGPA(成人)或患有其他嗜酸性粒细胞性疾病(HES)的成人和青少年受试者中观察到的美泊利珠单抗药代动力学特征与在患有其他嗜酸性粒细胞性疾病(重度哮喘)的成人和青少年受试者中观察到的药代动力学特征相似。
对 EGPA(成人)或患有其他嗜酸性粒细胞性疾病(HES)的成人和青少年受试者皮下给予 300 mg 美泊利珠单抗后的全身暴露量约为给予患有其他嗜酸性粒细胞性疾病(重度哮喘)的成人和青少年受试者 100 mg 美泊利珠单抗后暴露量的 3 倍。
吸收
对患有其他嗜酸性粒细胞性疾病(重度哮喘)的成人和青少年受试者在上臂皮下注射 100 mg 美泊利珠单抗后,估计美泊利珠单抗的生物利用度约为 80%。 每 4 周一次重复皮下给药后,稳态时蓄积程度约为 2 倍。
分布
对于体重为 70 kg 的患有其他嗜酸性粒细胞性疾病(哮喘)的成人受试者,美泊利珠单抗的中央分布容积估计值约为 3.6 L。
代谢
美泊利珠单抗是一种人源化 IgG1 单克隆抗体,可被体内广泛分布且并不局限于肝组织的蛋白水解酶降解。
消除
患有其他嗜酸性粒细胞性疾病(哮喘)的成人受试者皮下注射美泊利珠单抗后,平均终末半衰期(t1/2)范围在 16 - 22 天之间。对于体重为 70 kg 的患有其他嗜酸性粒细胞性疾病(重度哮喘)的成人和青少年患者,美泊利珠单抗的表观清除率估计为 0.28 L/天。
特殊人群
种族和男/女性患者:群体药代动力学分析表明,种族和性别对美泊利珠单抗的清除没有显著影响。
年龄:群体药代动力学分析表明,年龄对美泊利珠单抗的清除没有显著影响。
儿童患者:在开放性临床试验的最初 12 周治疗阶段,对 6 至 11 岁患有其他嗜酸性粒细胞性疾病(重度哮喘)的受试者进行 SC 给药后的美泊利珠单抗药代动力学进行了研究。40 mg(对于体重﹤40 kg 的儿童)或 100 mg(对于体重≥40 kg 的儿童)SC 给药后的暴露量(AUC)分别为接受 100 mg 的成人和青少年的暴露量的 1.32 和 1.97 倍。基于这些结果,对 6 至 11 岁儿童每 4 周一次 40 mg SC 剂量的模拟,无论其体重如何,所产生的预期暴露量与成人和青少年相似。
肾功能损害患者:未开展临床试验研究肾功能损害对美泊利珠单抗的药代动力学影响。基于群体药代动力学分析,肌酐清除率值为 50 至 80 mL/min 的受试者与肾功能正常患者之间,美泊利珠单抗清除率相似。肌酐清除率值<50 mL/min 的受试者中的数据有限,但是,美泊利珠单抗不经肾脏清除。
肝功能损害患者:未开展临床试验研究肝功能损害对美泊利珠单抗的药代动力学影响。由于美泊利珠单抗被广泛分布的蛋白水解酶(并不局限于肝组织)降解,因此肝功能变化不太可能对美泊利珠单抗的消除产生影响。
药物相互作用研究
未对本品开展正式的药物相互作用研究。在 III 期研究的群体药代动力学分析中,没有常用合并小分子药物对美泊利珠单抗暴露量有影响的证据。
注射剂
100mg(1ml)/支(单剂量预充式安全注射器);100mg(1ml)/支(单剂量预充式自动注射器)
单剂量预充式自动注射器,1 支/盒。 单剂量预充式安全注射器,1 支/盒。
2℃至 8℃冷藏。 置于原包装内避光保存。 禁止冷冻。 请勿摇晃。 避免暴露于高温。 本品从纸盒中取出后须在 8 小时内使用。如果未在 8 小时内使用,则丢弃。
24 个月
国药准字SJ20210029,国药准字SJ20210030

