必妥维(Biktarvy)说明书
Bictegravir Sodium,Emtricitabine and Tenofovir Alafenamide Fumarate Tablets
比克恩丙诺
本品为复方制剂,每片含比克替拉韦钠(以比克替拉韦计)50mg,恩曲他滨200mg,富马酸丙酚替诺福韦(以丙酚替诺福韦计)25mg。
本品适用于作为完整方案治疗人类免疫缺陷病毒1型(HIV-1)感染的成人,且患者目前和既往无对整合酶抑制剂类药物、恩曲他滨或替诺福韦产生病毒耐药性的证据。(参见【用法用量】 和【药理毒理】)。
应由HIV疾病管理经验丰富的医生发起治疗。
剂量
每日一次,每次一片。
漏服剂量
如果患者在通常的服药时间后18小时内漏服一剂比克恩丙诺片,则患者应尽快补服比克恩丙诺片,并恢复正常给药时间表。如果患者漏服一剂比克恩丙诺片的时间超过18小时,则患者不应服用漏服的剂量,仅恢复通常的给药时间表即可。
如果患者在服用比克恩丙诺片后1小时内呕吐,应再服用一片比克恩丙诺片。如果患者在服用比克恩丙诺片后超过1小时出现呕吐,则患者无需在下一次给药时间前再服用一剂本品。
老年人
关于比克恩丙诺片用于65岁以上的患者的数据有限。老年患者无需调整剂量(参见【药代动力学】)。
肾功能损害
肌酐清除率估计值(CrCl)≥30mL/min的患者无需进行剂量调整。
对于CrCl估计值低于30mL/min的患者,不建议开始比克恩丙诺片治疗,原因是比克恩丙诺片用于此人群的数据不足(参见【药代动力学】)。
肝功能损害
在轻度(Child-PughA级)或中度(Child-PughB级)肝功能损害患者中无需调整比克恩丙诺片的剂量。尚未在重度肝功能损害(Child-PughC级)患者中进行比克恩丙诺片研究;因此,不推荐将比克恩丙诺片用于重度肝功能损害患者(参见【注意事项】和【药代动力学】)。
儿童人群
尚未确定比克恩丙诺片在18岁以下儿童中的安全性和疗效。尚无可用数据。
给药方法
口服。
比克恩丙诺片可随食物或不随食物服用(参见【药代动力学】)。
不应咀嚼、碾碎或掰开薄膜衣片。
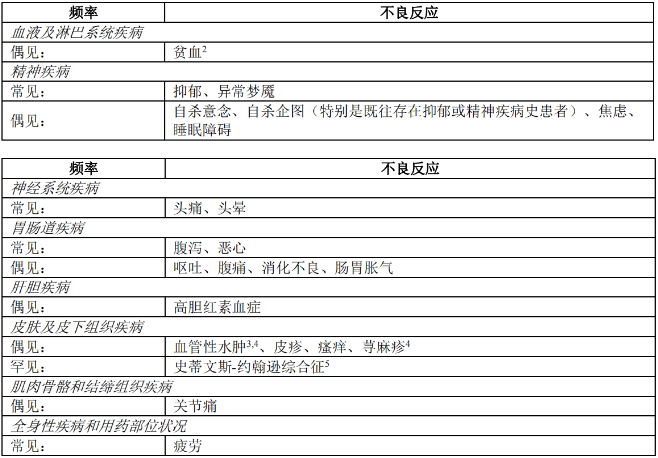
安全性特征总结
不良反应评估基于所有比克恩丙诺片2期和3期研究以及上市后经验的安全性数据。在针对接受96周比克恩丙诺片治疗的先前未接受过治疗的患者的临床研究中,最常报告的不良反应为头痛(5%)、腹泻(5%)和恶心(4%)o
不良反应总结表
表1按照系统器官分类和发生频率列出了不良反应。频次定义如下:常见(≥1/100至<1/10)、偶见(≥1/1,000至<1/100)、罕见(≥1/10,000至<1/1,000)或十分罕见(<1/10,000)。
1. 除血管性水肿、贫血、荨麻疹和史蒂文斯-约翰逊综合征(参见脚注2 - 5)外,在比克恩丙诺片临床研究中确定了所有不良反应。根据针对接受144周治疗的先前未接受过治疗的患者的3期临床研究(GS-US-380-1489和GS-US-380-1490)得出频率。
2. 在含恩曲他滨+丙酚替诺福韦的产品临床研究中未观察到此不良反应,但在与其他抗反转录病毒药物合用的恩曲他滨临床研究或上市后经验中确定了此不良反应。
3. 在含恩曲他滨产品的上市后监测中确定了此不良反应。
4. 通过对含丙酚替诺福韦产品进行上市后监测,确定了此不良反应。
5. 通过对比克恩丙诺片进行上市后监测,确定了此不良反应。使用3/X计算发生频率,其中X代表在临床试验中暴露于比克恩丙诺片的受试者累积数量(N = 3963)。
接受比克恩丙诺片<1%的受试者出现自杀意念、自杀企图和抑郁症自杀;所有事件均为严重事件且主要发生于存在既有抑郁史、既有自杀企图或精神疾病的受试者。
特定不良反应的说明
代谢参数
抗反转录病毒治疗期间体重以及血脂和血糖水平可能会增加(参见【注意事项】)。
免疫重建炎性综合征
在CART开始时存在严重免疫缺陷的HIV感染患者中,可能会出现无症状或残余机会性感染引起的炎症反应。此外,还报告了自身免疫疾病(如Graves病和自身免疫性肝炎);然而,所报告的发病时间更多变,这些事件可能会在治疗开始后数月时发生(参见【注意事项】)。
骨坏死
已报告了骨坏死病例,尤其是存在公认风险因素、患晚期HIV疾病或长期暴露于CART的患者。该不良事件的发生频率不明(参见【注意事项】)。
血清肌酐变化
比克替拉韦已显示会增加血清肌酐,因为其可抑制肾小管分泌肌酐;不过这些变化被视为不具有临床相关性,因为其并未反映出肾小球滤过率变化。至治疗第4周时血清肌酐有所增加,至第144周时保持稳定。在研究GS-US-380-1489和GS-US-380-1490中,比克恩丙诺片、阿巴卡韦/多替拉韦/拉米夫定和多替拉韦+恩曲他滨/丙酚替诺福韦组中血清肌酐中位值(Q1,Q3)自基线至第144周分别增加了0.11(0.03, 0.19)mg/dL(9.7 [2.7, 16.8] µmol/L)、0.11(0.04, 0.19)mg/dL(9.7 [3.5, 16.8] µmol/L)和0.12(0.06, 0.21)mg/dL(10.6 [5.3, 18.6] µmol/L)。在比克恩丙诺片临床研究中,至第144周时接受给药的患者中未出现因肾脏不良事件而停药的情况。
胆红素变化
研究GS-US-380-1489和GS-US-380-1490中,在17%的接受比克恩丙诺片治疗至第144周的先前未接受过治疗的患者中观察到总胆红素升高。升高主要为1级(12%)和2级(4%) (≥1.0至2.5x正常值上限[ULN]),与肝脏不良反应或其他肝脏相关实验室检测异常无关。5名接受比克恩丙诺片给药的患者(1%)出现被视为与研究药物无关的3级胆红素升高。在比克恩丙诺片临床研究中,至第144周时未出现因肝脏不良事件而停药的情况。
其他特殊人群
乙型肝炎合并感染患者
在21名接受比克恩丙诺片给药的HIV/HBV合并感染成人(研究GS-US-380-1490中8名未接受过治疗的HIV/HBV感染成人;研究GS-US-380-1878中8名HIV/HBV达到抑制成人和研究GS-US-380-1961中5名HIV-HBV达到抑制的女性)中,比克恩丙诺片的安全性特征与HIV-1单一感染患者的相应特征相似(参见【临床试验】)。
老年人
研究GS-US-380-1844、GS-US-380-1878以及在≥ 65岁的患者中开展的专项研究GS-US-380-4449(对86名≥ 65岁且病毒学特征受抑的HIV-1感染受试者进行评估)中,包括了111名≥ 65岁接受比克恩丙诺片治疗的患者。在这些患者中,未观察到比克恩丙诺片的安全性特征存在差异。
肾功能损害患者
在一项单臂、开放标签的临床研究(GS-US-292-1825)中,评估了96周接受长期血液透析的终末期肾病(eGFRCG < 15 mL/min)的55名病毒学特征受抑的HIV-1感染患者服用恩曲他滨+丙酚替诺福韦联合艾维雷韦+考比司他固定剂量复方片剂(艾考恩丙替片)的安全性。在研究GS-US-292-1825的扩展阶段,有10名患者转换为接受比克恩丙诺片进行了48周的治疗。在这项研究中的长期血液透析的终末期肾病患者中未发现新的安全性问题(参见【注意事项】和【药代动力学】)。
疑似不良反应的报告
药品批准后,报告疑似不良反应对持续监测药品的获益/风险平衡非常重要。在中国,
医疗保健专业人员需通过国家报告系统报告任何疑似不良反应。
对驾驶及操作机械能力的影响
应告知患者在比克恩丙诺片组分治疗期间已报告过头晕。
对本品活性成分或任一辅料出现超敏反应者禁用。
禁止与利福平或圣约翰草(Hypericumperforatum)合用(参见【药物相互作用】)。
治疗后乙型肝炎急性加重 已有报告指出,合并感染HIV-1和HBV并停用含恩曲他滨(FTC)和/或富马酸替诺福韦二吡呋酯(TDF)的产品的患者出现了乙型肝炎严重急性加重,在停用比克恩丙诺片时也可能出现此情况。 对于停用比克恩丙诺片的HIV-1和HBV合并感染者,严密监测肝功能,包括至少持续数月的临床及实验室随访。如果条件适当,可能需要进行抗乙型肝炎病毒治疗。(参见【注意事项】)
虽然已经证明抗反转录病毒治疗的有效病毒抑制作用可显著降低性行为传播的风险,但是不能排除仍有残余风险。应该按照国家指导原则釆取预防措施防止传播。
HIV和乙型肝炎或丙型肝炎病毒合并感染患者
对于接受抗反转录病毒治疗的慢性乙型肝炎或丙型肝炎患者,出现严重且可能致命的肝脏不良反应的风险升高。
关于比克恩丙诺片在HIV-1和丙型肝炎病毒(HCV)合并感染患者中的安全性和疗效的数据有限。
比克恩丙诺片含有丙酚替诺福韦,后者对乙型肝炎病毒(HBV)具有活性。
对于HIV-1患者,应在开始抗反转录病毒治疗之前或之时检测是否存在慢性乙型肝炎病毒(HBV)感染,HIV和HBV合并感染患者停止比克恩丙诺片治疗可能会导致肝炎重度急性加重。对于停止比克恩丙诺片治疗的HIV和HBV合并感染患者,应在停止治疗后通过至少数个月的临床及实验室随访进行严密监测。
肝病
尚未确定比克恩丙诺片在患有重大基础肝病患者中的安全性和疗效。
对于原先存在肝功能障碍(包括慢性活动性肝炎)的患者,联合抗反转录病毒治疗(CART)期间肝功能异常的频率增加,应根据标准实践进行监测。如果在这些患者中出现肝病加重的迹象,则必须考虑中断或停止治疗。
乳酸性酸中毒/重度肝肿大伴脂肪变性
已有报告指出,单独使用包括恩曲他滨(比克恩丙诺片的一种组分)和富马酸替诺福韦二吡呋酯(替诺福韦的另一种药物前体)在内的核苷类似物或与其他抗反转录病毒药物联合用药时出现乳酸性酸中毒和重度肝肿大伴脂肪变性,包括出现致命病例。任何患者的临床或实验室结果如果提示有乳酸性酸中毒或显著的肝毒性(可能包括肝肿大和脂肪变性,即便转氨酶没有显著升高),应当暂停比克恩丙诺片治疗。
体重和代谢参数
抗反转录病毒治疗期间可能出现体重增加以及血脂和血糖水平升高。这些变化可能在某种程度上与疾病控制和生活方式相关。在一些病例中有证据表明血脂受到治疗影响,而尚无有力证据表明体重增加与任何特定治疗有关。血脂和血糖监测参考已确定的HIV治疗指导原则。应在临床适当管理血脂疾病。
宫內暴露后线粒体功能障碍
核苷(酸)类似物可能对线粒体功能产生不同程度的影响,在使用司他夫定、去羟肌苷和齐多夫定时此情况最为明显。已在子宫内和/或产后暴露于核昔类似物的HIV阴性婴儿中报告了线粒体功能障碍:这些线粒体功能障碍报告主要与采用含齐多夫定的方案进行治疗相关。报告的主要不良反应为血液学疾病(贫血、中性粒细胞减少)和代谢疾病(高乳酸血症、高脂肪酶血症)。这些事件通常为短暂性事件。较为罕见地报告了一些迟发性神经系统疾病(张力亢进、痉挛、行为异常)。目前尚不了解此类神经系统疾病为短暂性事件还是永久性事件。对于子宫內暴露于核苷(酸)类似物且出现不明病因的严重临床检查异常(特别是神经学检查异常)的任何儿童,应考虑到这些结果。这些检查结果不会影响当前国家在妊娠女性中使用抗反转录病毒治疗以预防HIV垂直传播的建议。
免疫重建炎性综合征
在CART开始时存在严重免疫缺陷的HIV感染患者中,可能会出现无症状或残余条件病原体引起的炎症反应,该反应可能会导致出现严重的临床状况或症状加重。通常,在开始CART后最初几周或几个月内观察到此类反应。相关实例包括巨细胞病毒视网膜炎、全身性和/或局灶性分枝杆菌感染和耶氏肺孢子虫肺炎。应当评估任何炎症性症状,并在必要时开始治疗。
此外,曾报告在免疫再激活期间出现了自身免疫疾病(如Graves病,多肌炎,格林-巴利综合征,以及自身免疫性肝炎);然而,所报告的发病时间更多变,这些事件可能会在治疗开始后数月时发生。
机会性感染
应告知患者比克恩丙诺片或任何其他抗反转录病毒治疗均不会治愈HIV感染,并且他们仍可能会出现机会性感染和其他HIV感染并发症。因此,应由具备HIV相关疾病治疗经验的医生继续对该等患者进行密切的临床观察。
骨坏死
虽然认为病因具有多因素性(包括使用皮质类固醇、饮酒、严重免疫抑制、身体质量指数较髙),但是已报告了骨坏死病例(尤其常见于晚期HIV疾病和/或长期暴露于CART的患者)。建议患者在出现关节疼痛、关节僵硬或活动困难时就医。
肾毒性
不能排除丙酚替诺福韦治疗导致长期暴露于低水平替诺福韦引起肾毒性的潜在风险(参见【药理毒理】)。
接受长期血液透析的终末期肾病患者
一般应避免使用比克恩丙诺片,但如果潜在获益大于潜在风险,则可用于接受长期血液透析的终末期肾病(CrCl估计值< 15 mL/min)成人患者(参见【用法用量】)。在一项接受长期血液透析的终末期肾病(CrCl估计值< 15 mL/min)且感染HIV-1的成人中进行的恩曲他滨+丙酚替诺福韦联合艾维雷韦+考比司他固定剂量复方片剂(艾考恩丙替片)研究中,疗效维持至96周,但恩曲他滨暴露量显著高于肾功能正常患者。在研究的扩展阶段(其中有10名患者转换为接受比克恩丙诺片治疗48周)疗效继续维持。尽管未发现新的安全性问题,但仍不能确定恩曲他滨暴露量增加的影响(参见【不良反应】和【药代动力学】)。
与其他药品合用
比克恩丙诺片不应在空腹状态下与含有镁/铝的抗酸剂或铁补充剂同时合用。比克恩丙诺片应在含镁和/或铝的抗酸剂给药前至少2小时服用或在给药后2小时随食物服用。比克恩丙诺片应在铁补充剂给药前至少2小时服用或随食物服用(参见【药物相互作用】)。
不建议以下药品与比克恩丙诺片合用:阿扎那韦、卡马西平、环孢霉素(静脉使用或口服)、奥卡西平、苯巴比妥、苯妥英、利福布汀、利福喷丁或硫糖铝。
比克恩丙诺片不应与其他抗反转录病毒药品合用。
辅料
本品每片含钠小于1 mmol(23mg),即基本“无钠”。
如果发生药物过量,必须监测患者是否出现毒性迹象(参见【不良反应】)。比克恩丙诺 片药物过量的治疗需要采取一般支持性措施,包括监测生命体征以及观察患者的临床状态。
比克恩丙诺片药物过量无特定解毒剂。由于比克替拉韦与血浆蛋白高度结合,因此不太可 能通过血液透析或腹膜透析显著去除该药物。恩曲他滨可通过血液透析去除,在恩曲他滨给药 1.5小时内开始的3小时透析期间,可去除约30%的恩曲他滨剂量。替诺福韦可通过血液透析有效去除,提取系数约为54%。尚不清楚腹膜透析能否清除恩曲他滨或替诺福韦。
尚无妊娠女性使用比克替拉韦或丙酚替诺福韦的数据或此类数据非常有限(不足300例妊娠结局)。大量关于妊娠女性的数据(超过1,000例暴露结局)表明未出现与恩曲他滨相关的畸形或胎儿/新生儿毒性。 动物研究结果表明恩曲他滨不会对生育力参数、妊娠、胎仔发育、分娩或产后发育产生直接或间接的有害影响。在动物中进行的比克替拉韦和丙酚替诺福韦单独给药研究已显示,无证据表明对生育力参数、妊娠或胎仔发育产生有害影响(参见【药理毒理】)。 只有当对胎儿的潜在效益大于潜在风险时,才应在妊娠期使用比克恩丙诺片。尚不清楚比克替拉韦或丙酚替诺福韦是否会分泌到人类乳液中。恩曲他滨会分泌到人乳中。 在动物研究中,在哺乳期大鼠幼仔血浆中检测到比克替拉韦,这可能是由于乳汁中存在比克替拉韦所致,对哺乳期幼仔无影响。动物研究结果已表明,替诺福韦可分泌到乳汁中。 关于比克恩丙诺片所有组分在新生儿/婴儿中的影响的信息不充分,因此在母乳喂养期间不应使用比克恩丙诺片。 为避免将HIV传播给婴儿,建议HIV感染女性在任何情况下都不要进行母乳喂养。尚未确定比克恩丙诺片在18岁以下儿童中的安全性和疗效。尚无可用数据。关于比克恩丙诺片用于65岁以上的患者的数据有限。老年患者无需调整比克恩丙诺片剂量 (参见【药理毒理】和【药代动力学】)。
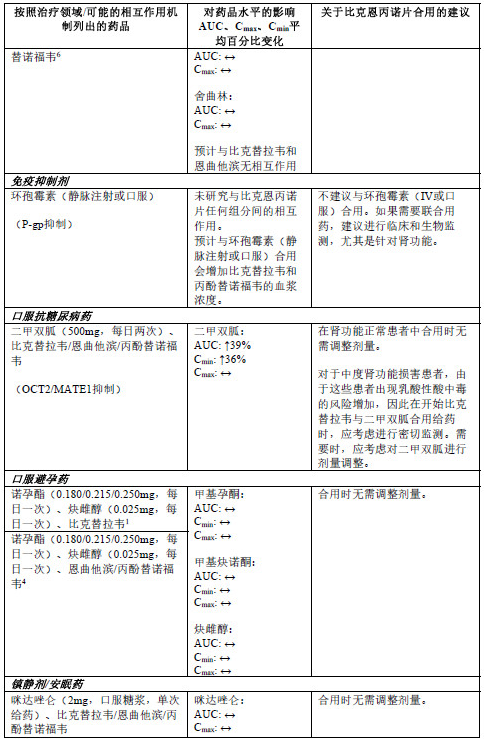
仅在成人中进行了相互作用研究。
比克恩丙诺片不应与用于HBV感染治疗的含丙酚替诺福韦、替诺福韦酯、拉米夫定或阿德福韦酯的药品伴随用药。
比克替拉韦
比克替拉韦是CYP3A和UGT1A1的底物。比克替拉韦与可强效诱导CYP3A和UGT1A1 的药品(如利福平或圣约翰草)合用可能会显著降低比克替拉韦的血浆浓度,从而导致比克恩 丙诺片失去疗效和产生耐药性,因此禁止合用(参见【禁忌】)。比克替拉韦与可同时强效抑制CYP3A和UGT1A1的药品(如阿扎那韦)合用可能会显著增加比克替拉韦的血浆浓度,因 此不建议合用。
比克替拉韦是P-gp和BCRP的底物。尚未确定此特点的临床相关性。因此,建议建议谨慎联用比克替拉韦与已知可抑制P-gp和/或BCRP的药品(例如大环内酯类、环孢霉素、维拉帕米、 决奈达隆、Glecaprevir/Pibrentasvir)(参见下表)。
在体外,比克替拉韦可抑制有机阳离子转运体2 (0CT2)及多药物和毒素排出转运蛋白1 (MATE1) 。比克恩丙诺片与0CT2和MATE1底物二甲双胍合用未导致二甲双呱暴露量出现具有临床意义的增加。比克恩丙诺片可与0CT2和MATE1的底物合用。
在体内,比克替拉韦不是CYP的抑制剂或诱导剂。
恩曲他滨
体外和临床药代动力学药物间相互作用研究显示,恩曲他滨与其他药品间出现CYP介导的 相互作用的可能性较低。恩曲他滨与由肾小管主动分泌进行清除的药品合用可能会增加恩曲他滨和/或合用的药品的浓度。降低肾功能的药品可能会升高恩曲他滨浓度。
丙酚替诺福韦
丙酚替诺福韦由P-糖蛋白(P-gp)和乳腺癌耐药蛋白(BCRP)转运。比克恩丙诺片与对 P-gp和BCRP活性具有较强影响的药品合用可能会导致丙酚替诺福韦的吸收发生改变。预计可以诱导P-gp活性的药品(例如利福布汀、卡马西平、苯巴比妥)会降低丙酚替诺福韦的吸收, 从而导致丙酚替诺福韦的血浆浓度下降,这可能导致比克恩丙诺片丧失疗效和产生耐药性。比克恩丙诺片与其他可抑制P-gp和BCRP的药品合用可能会增加丙酚替诺福韦的吸收量和血浆浓度。
在体内,丙酚替诺福韦不是CYP3A的抑制剂或诱导剂。
其他相互作用
下表2中列出了比克恩丙诺片或其单一组分与合用的药品之间的相互作用(“↑”表示增加, “↓”表示降低,“ ”表示无变化;所有无作用界限范围均为70%-143%)。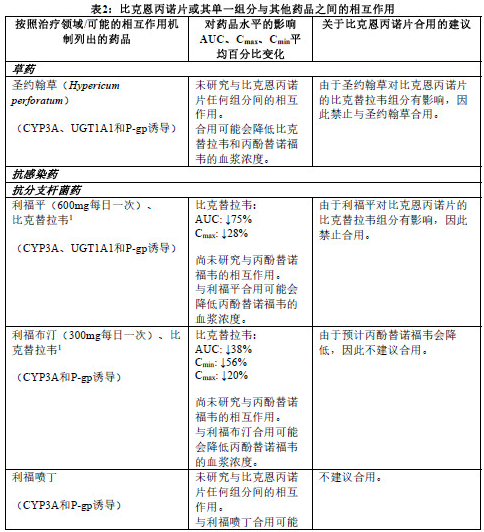
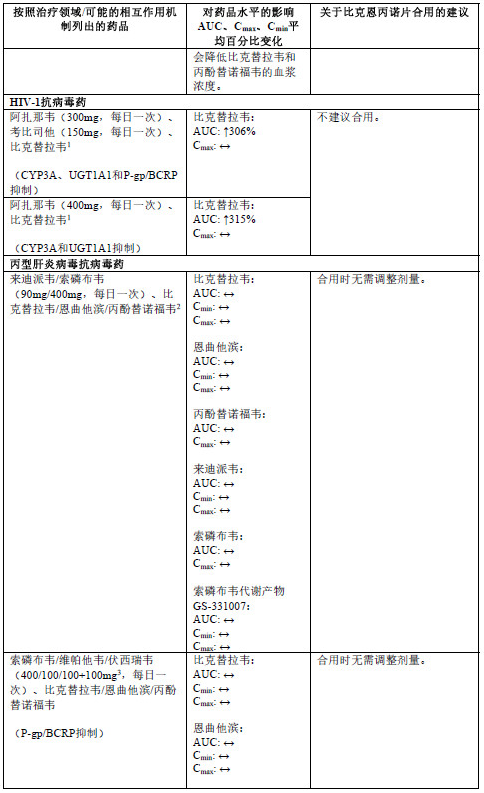
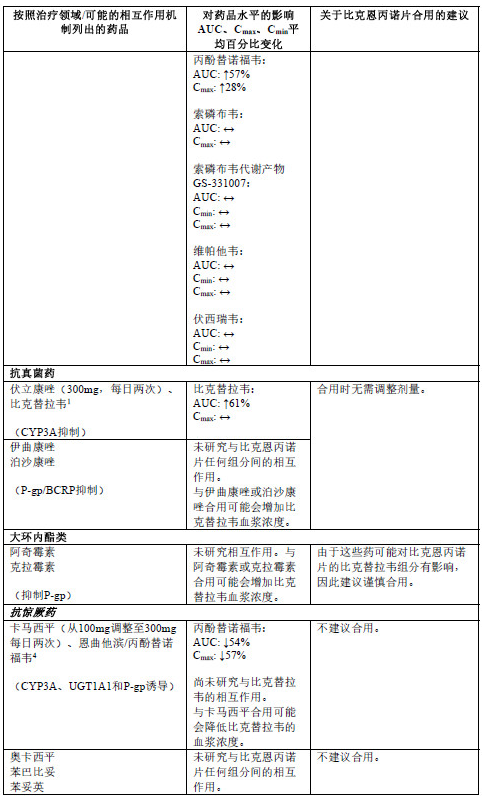
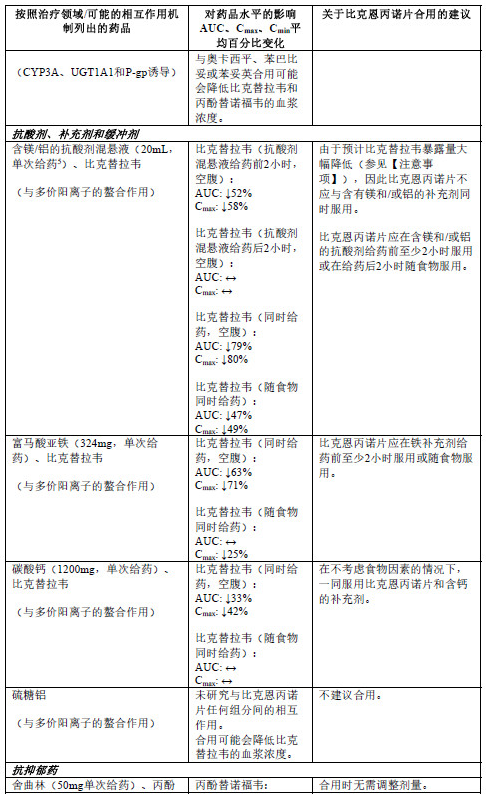
1 此研究使用比克替拉韦75mg单次给药开展。
2 此研究使用比克替拉韦/恩曲他滨/丙酚替诺福韦75/200/25mg每日一次给药开展。
3 额外使用伏西瑞韦lOOmg开展研究,以达到HCV感染患者中的预期伏西瑞韦暴露量。
4 此研究使用恩曲他滨/丙酚替诺福韦200/25mg每日一次给药开展。
5 每毫升最高含量抗酸剂中含80mg氢氧化铝、80mg氢氧化镁和8mg二甲基硅油。
6 此研究使用艾维雷韦/考比司他/恩曲他滨/丙酚替诺福韦150/150/200/10mg每日一次给药开展。
基于使用比克恩丙诺片或比克恩丙诺片组分开展的药物相互作用研究,预计与下列药物不存在具有临床意义的药物相互作用:氨氯地平、阿托伐他汀、丁丙诺啡、屈螺酮、泛昔洛韦、法莫替丁、氟替卡松、纳洛酮、去甲丁丙诺啡、奥美拉唑或瑞舒伐他汀。
Gilead Sciences Ireland UC
86982157000075
比克恩丙诺片在未接受过治疗的HIV-1感染成人中的疗效和安全性基于两项随机、双盲、活性对照研究GS-US-380-1489(n=629)和GS-US-380-1490(n=645)的48和144周数据确定。
比克恩丙诺片在病毒学特征达到抑制的HIV-1感染成人中的疗效和安全性基于一项随机、双盲、活性对照研究GS-US-380-1844(n=563)和一项随机、开放标签、活性对照研究GS-US-380-1878(n=577)的48周数据确定。在病毒学特征达到抑制的HIV-1感染女性中开展了一项随机、开放标签、活性对照研究GS-US-380-1961(n=470)。
未接受过治疗的HIV-l感染患者
在研究GS-US-380-1489中,按1:1的比例对患者进行随机分组,使之接受比克替拉韦/恩曲他滨/丙酚替诺福韦(B/F/TAF)(n=314)或阿巴卡韦/多替拉韦/拉米夫定(600/50/300mg)(n=315)每日一次给药。在研究GS-US-380-1490中,按1:1的比例对患者进行随机分组,使之接受B/F/TAF(n=320)或多替拉韦+恩曲他滨/丙酚替诺福韦(50+200/25mg)(n=325)每日一次给药。
研究GS-US-380-1489和GS-US-380-1490中,平均年龄为35岁(范围18-77),89%为男性,58%为白人,33%为黑人,3%为亚裔。24%的患者确定为西班牙裔/拉丁裔。三个治疗组之间不同亚型的发生率均相当,两个组均以亚型B为主;11%为非B亚型。平均基线血浆HIV-1RNA为4.41og10拷贝/mL(范围:1.3-6.6)。平均基线CD4+细胞计数是460细胞/mm3(范围为0-1636),11%的患者中CD4+细胞计数小于200细胞/mm3。18%的患者中基线病毒载量大于100,000拷贝/mL。在两项研究中,按照基线HIV-1RNA水平(小于或等于100,000拷贝/mL、大于100,000拷贝/mL至小于或等于400,000拷贝/mL或大于400,000拷贝/mL)、CD4+细胞计数(小于50个细胞/uL、50-199个细胞/uL或大于或等于200个细胞/uL)和地区(美国或美国以外地区)对患者进行了分层。
至第48和144周时研究GS-US-380-1489和研究GS-US-380-1490的治疗结果见表3。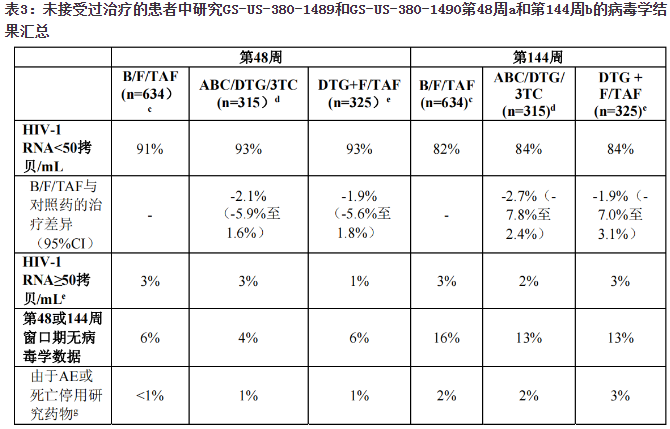
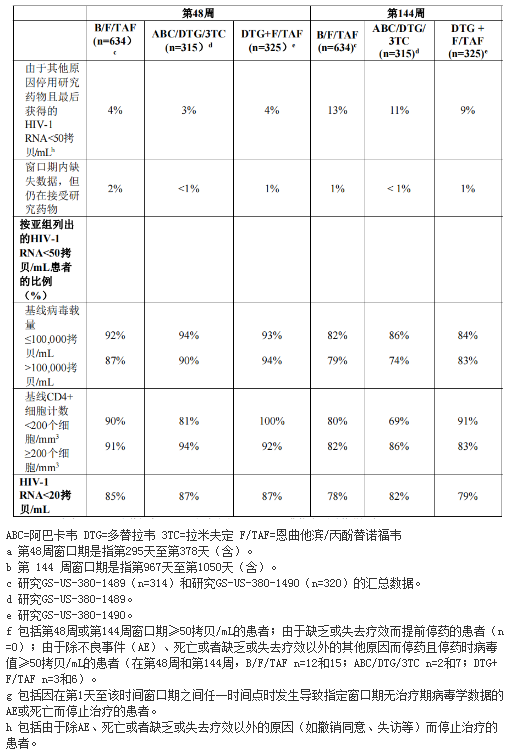
第48和144周时B/F/TAF组在实现HIV-1RNA<50拷贝/mL方面不劣于阿巴卡韦/多替拉韦/拉米夫定组和多替拉韦+恩曲他滨/丙酚替诺福韦组。按年龄、性别、种族、基线病毒载量、基线CD4+细胞计数和地区列出的各亚组间的治疗结果相似。
研究GS-US-380-1489和GS-US-380-1490中,第96周时,汇总B/F/TAF组、阿巴卡韦/多替拉韦/拉米夫定组和多替拉韦+恩曲他滨/丙酚替诺福韦组的CD4+细胞计数相对于基线的平均增幅分别为262、288和281个细胞/mm3。
病毒学特征达到抑制的HIV-l感染患者
在研究GS-US-380-1844中,通过在感染HIV-1且病毒学特征达到抑制(HIV-1RNA<50拷贝/mL)的成人患者(n=563)中开展一项随机、双盲研究,对从多替拉韦+阿巴卡韦/拉米夫定或阿巴卡韦/多替拉韦/拉米夫定治疗转为B/F/TAF治疗的有效性和安全性进行评估。进入研究前,患者必须已在其基线治疗期间实现稳定抑制(HIV-lRNA<50拷贝/mL)达至少3个月。以1:1的比例对患者进行随机分组,使之在基线时转为接受B/F/TAF治疗(N=282)或继续接受基线抗反转录病毒治疗方案(N=281)。患者平均年龄为45岁(范围为20至71岁),89%为男性,73%为白人,22%为黑人。17%的患者确定为西班牙裔/拉丁裔。治疗组之间不同HIV-1亚型的发生率均相当,两个组均以亚型B为主;5%为非B亚型。平均基线CD4+细胞计数为723个细胞/mm3(范围为124-2444)。
在研究GS-US-380-1878中,在一项针对病毒学特征达到抑制HIV-1感染成人(n=577)进行的随机、开放标签研究中评估了从阿巴卡韦/拉米夫定或恩曲他滨/富马酸替诺福韦二吡呋酯(200/300mg)阿扎那韦或达芦那韦(经考比司他或利托那韦增强)转为B/F/TAF的疗效和安全性。患者在接受基线治疗方案时必须已实现至少6个月的稳定抑制,且先前不得接受过任何INSTI治疗。以1:1的比例对患者进行随机分组,使之转为接受B/F/TAF治疗(N=290)或继续接受基线抗反转录病毒治疗方案(N=287)。患者平均年龄为46岁(范围为20至79岁),83%为男性,66%为白人,26%为黑人。19%的患者确定为西班牙裔/拉丁裔。平均基线CD4+细胞计数为663个细胞/mm3(范围为62-2582)。治疗组之间不同亚型的发生率均相当,两个组均以亚型B为主;11%为非B亚型。按既往治疗方案对患者进行分层。筛选时,15%的患者正在接受阿巴卡韦/拉米夫定+阿扎那韦或达芦那韦(经考比司他或利托那韦增强)治疗,85%的患者正在接受恩曲他滨/富马酸替诺福韦二吡呋酯+阿扎那韦或达芦那韦(经考比司他或利托那韦增强)治疗。
至第48周时研究GS-US-380-1844和研究GS-US-380-1878的治疗结果见表4。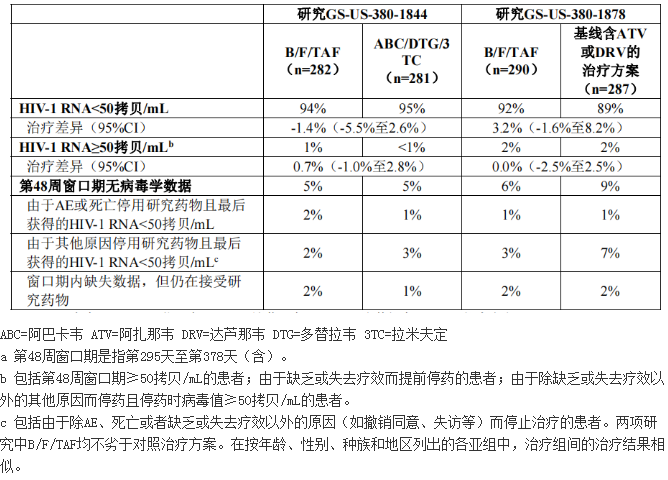
GS-US-380-1844中,转为B/F/TAF治疗的患者和继续接受阿巴卡韦/多替拉韦/拉米夫定治疗的患者在第48周时CD4+计数相对于基线的变化平均值分别为-31细胞/mm3和4胞/mm3。GS-US-380-1878中,转为B/F/TAF治疗的患者和继续接受其基线治疗的患者在第48周时CD4+计数相对于基线的变化平均值分别为25细胞/mm3和0细胞/mm3。
GS-US-380-1961中,一项随机、开放性研究评价了病毒学达到抑制的H1V-1感染女性从艾维雷韦/考比司他/恩曲他滨/丙酚替诺福韦(EVG/COBI/FTC/CAF)、艾维雷韦/考比司他/恩曲他滨/富马酸替诺福韦二吡呋酯(EVG/COBI/FTC/TDF)或阿扎那韦+利托那韦+恩曲他滨/富马酸替诺福韦二吡呋酯(ATV+RTV+FTC/TDF)转换为B/F/TAF的安全性和疗效。患者必须在其基线治疗方案中稳定达到抑制至少12周,并随机分配至B/F/TAF(n=234),或维持原基线治疗方案(n=236)。患者的平均年龄为40岁(范围为21-63),37%为黑人,28%为白人,22%为亚洲人。16%的患者确定为西班牙裔/拉丁裔。平均基线CD4+细胞计数为725个细胞/mm3(范围175-1703)。在第48周,与维持基线方案相比,转为B/F/TAF治疗方案非劣效;每组中1.7%的患者出现≥50拷贝/mL,转为B/F/TAF后维持HIV-1RNA<50拷贝/mL的患者比例为96%,而维持基线治疗方案的患者中该比例为95%。不同治疗组之间的疗效在年龄,种族和地区的亚组间相似。第48周时CD4+计数与基线相比,在转换为B/F/TAF的患者中平均变量为29个细胞/mm3在维持基线治疗方案的患者中平均变量为26个细胞/mm3。
HIV和HBV合并感染患者
接受B/F/TAF治疗的HIV和HBV合并感染患者人数有限。研究GS-US-380-1490中,8名基线HIV/HBV合并感染患者经过随机分组接受B/F/TAF治疗。第48周时,7名患者的HBV达到抑制(HBV DNA<29IU/mL)且HIV-1 RNA<50拷贝/mL。一名患者缺失第48周的HBV DNA
数据。第144周时,5名患者HBV被抑制且HIV-1 RNA < 50拷贝/mL。3名患者缺失第144周的HBV DNA数据(1名患者从第48周起失访、1名患者在第72周后失访、1名患者在第120周后失访)。
研究GS-US-380-1878中,第48周时,B/F/TAF组中100%(8/8)的基线HIV/HBV合并感染患者维持HBV DNA<29 IU/mL(缺失=排除分析)且HIV RNA<50拷贝/mL。
研究GS-US-380-1961中,在第48周,B/F/TAF治疗组中100%(5/5)在基线时已发生HIV/HBV共感染的患者可维持HBV DNA<29 IU/mL(缺失=排除分析)和HIV RNA<50拷贝/mL。
片剂
每片含比克替拉韦钠(以比克替拉韦计)50mg,恩曲他滨200mg,富马酸丙酚替诺福韦(以丙酚替诺福韦计)25mg。
配有带感应活性铝箔内衬的聚丙烯连续螺纹防儿童开启瓶盖的高密度聚乙烯(HDPE)瓶,内含30片薄膜衣片。每瓶均含硅胶干燥剂和聚酯棉塞。
30℃以下密闭保存。
36个月
H20190047