麟平Crysvita说明书
Burosumab injection
布罗索尤单抗
主要成份:布罗索尤单抗
布罗索尤单抗系采用中国仓鼠卵巢细胞(CHO)表达制备的全人源抗成纤维细胞生长因子 23(FGF23)单克隆抗体(IgG1)。
辅料:
L-组氨酸、D-山梨醇、聚山梨酯 80、L-蛋氨酸、盐酸 10%、注射用水。
本品为澄清至浅乳白色以及无色至浅棕黄色溶液。
用于成人和 1 岁及以上儿童患者的 X 连锁低磷血症(XLH)。
用于成人无法根治性切除或定位的磷酸盐尿性间充质肿瘤相关的肿瘤性骨软化症(TIO)中的 FGF23 相关性低磷血症。
本品皮下注射,应由医务人员操作。
在开始本品治疗前 1 周应停用口服磷酸盐和活性维生素 D 类似物。开始治疗前,空腹血磷浓度应低于各年龄段的参考值下限。不应在本品治疗期间给予口服磷酸盐和活性维生素 D 类似物。
皮下注射给药一般注意事项
应轮换注射部位(上臂、大腿上部、臀部或腹部的任何部位),每次在与前一次注射不同的解剖部位注射给药。请勿在痣、疤痕或脆弱、瘀血、发红、硬皮或不完整的皮肤区域注射给药。每次注射的最大容积为 1.5 ml。若需要多次注射,应在不同注射部位进行注射。
在给药之前,应目测检查本品中是否存在颗粒物质以及出现变色的情况。本品是一种皮下注射用无菌、不含防腐剂、澄清至浅乳白色以及无色至浅棕黄色溶液。如果溶液变色或混浊或溶液中含有任何颗粒或异物,请勿使用。
XLH 儿童患者(1 岁至 18 岁以下)
推荐的起始剂量方案是 0.8 mg/kg,四舍五入至最接近的 10 mg,每 2 周一次。
最低起始剂量为 10 mg,最大剂量为 90 mg。
在开始本品治疗后,在治疗的前 3 个月每 4 周测定一次空腹血磷,此后酌情进行测定。如果血磷高于各年龄段的参考值下限且低于 5 mg/dL,则继续使用相同剂量进行治疗。遵循以下剂量调整方案,以将血磷维持在各年龄段的参考范围内。
剂量调整
在剂量调整后 4 周重新评估空腹血磷水平。
本品剂量调整间隔不应小于每 4 周一次。
剂量增加
如果血磷低于各年龄段的参考值下限,则根据表 1 中所示的给药方案,剂量可逐步增加至最大剂量 2 mg/kg,每 2 周给药一次(最大剂量为 90 mg)。

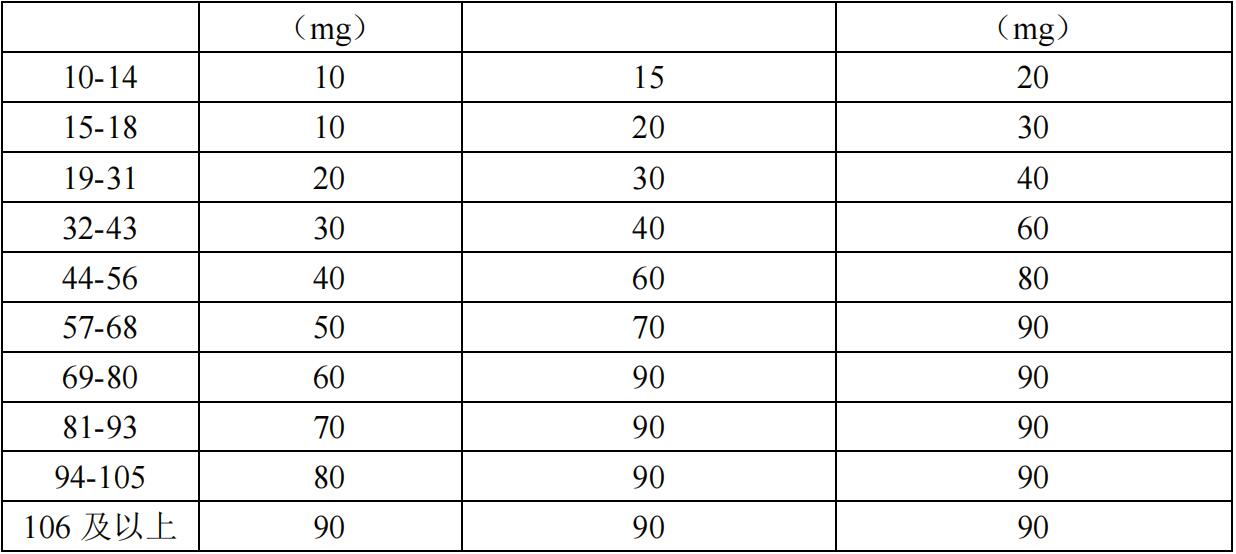
剂量降低
如果血磷高于 5 mg/dL,则停用下一剂,并在 4 周内重新评估血磷水平。患者的血磷水平必须降至各年龄段的参考值下限,才可重新开始本品治疗。一旦血磷低于各年龄段的参考值下限,则可根据表 2 中所示的给药方案重新开始治疗。
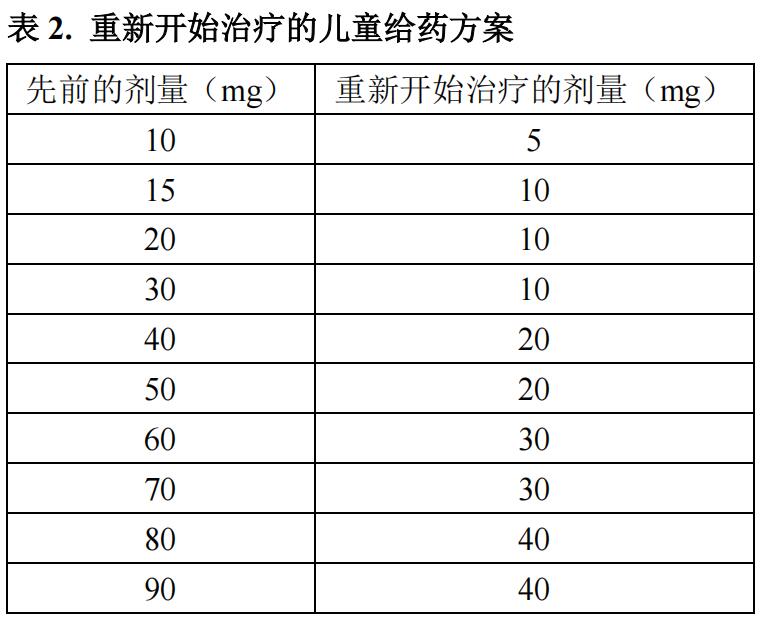
在剂量调整后 4 周重新评估血磷水平。如果重新开始给药后血磷水平仍低于各年龄段的参考值下限,则可以根据表 1 调整剂量。
XLH 成人患者(18 岁及以上)
成人的推荐剂量方案为 1 mg/kg,四舍五入至最接近的 10 mg,最大剂量为 90mg,每 4 周一次。
在开始本品治疗后,在治疗的前 3 个月每月评估一次空腹血磷(在给药后 2 周测定),此后酌情进行测定。如果血磷在正常范围内,继续使用相同剂量进行治疗。
剂量降低
在剂量调整后 2 周重新评估空腹血磷水平。
本品剂量调整间隔不应小于每 4 周一次。
如果血磷高于正常值上限,则停用下一剂,并在 4 周后重新评估血磷水平。患者的血磷必须低于正常值下限才能重新开始本品治疗。一旦血磷低于正常值下限,则可根据表 3 中所示的给药方案按大约一半的起始剂量(最大剂量为 40 mg)重新开始治疗,每 4 周一次。在剂量发生任何变化后 2 周重新评估血磷水平。
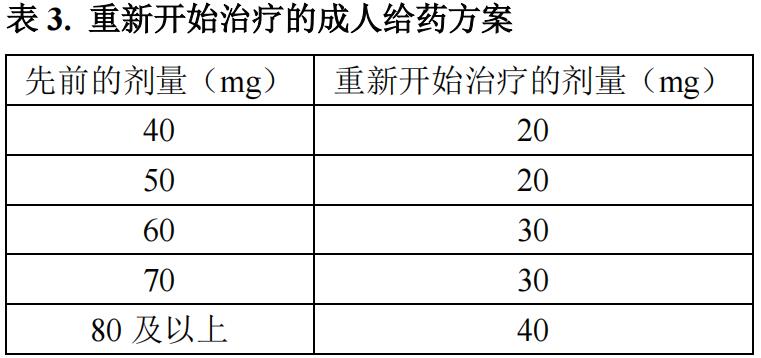
TIO 成人患者
一般情况下,本品给药剂量为 0.3 mg/kg,皮下注射,给药周期 4 周。
可根据血磷浓度和症状增加或减少剂量,最大剂量为 2 mg/kg。
本品的起始剂量和剂量调整参照表 4。根据体重计算本品的剂量,以 10mg 为单位进行四舍五入。
按照表 4 根据患者体重进行初始给药。此后,应根据血磷浓度和症状,增加或减少剂量。如果需要增加剂量,当血磷浓度低于参考范围的下限时,可在剂量范围内逐步增加剂量,最高可达每剂 2 mg/kg。(参照【临床试验】研究 7)
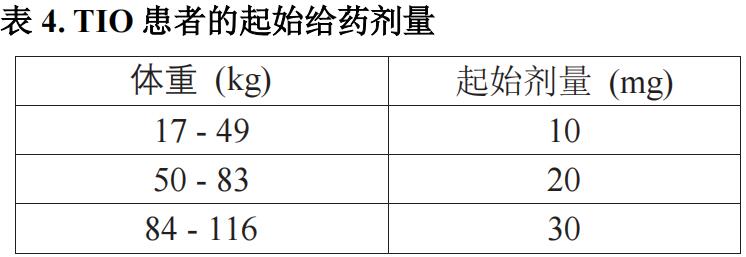
在开始使用本品并调整剂量后,每次给药时均应测量血磷浓度(每 2 周或 4 周 1次),直至血磷浓度稳定为止。
如果血磷浓度升高超过参考范围的上限,则应停药至血磷浓度低于参考范围的下限为止。
恢复给药时,剂量应减少到停药前剂量的一半左右。
忘记用药
如果患者忘记用药,请尽快按处方剂量恢复本品治疗。
为避免发生忘记用药,可在计划治疗日期±3 天内给药。
25-羟基维生素 D 补充剂
监测 25-羟基维生素 D 水平。补充胆钙化醇或麦角钙化醇以便将 25-羟基维生素D 水平维持在对应年龄的正常范围内。切勿在使用本品治疗期间给予活性维生素 D类似物。
肾功能不全患者
肾功能不全对于本品的药代动力学影响不详。
肾功能不全可诱发异常矿物质代谢,这将导致磷浓度升高,高于本品单药给药对应的预期浓度。该升高可能导致高磷血症,而高磷血症可能诱发肾钙质沉着症。
本品禁用于重度肾功能不全患者;重度肾功能不全患者定义包括:
• 肾小球滤过率(eGFR)估计值范围为 15 ml/min/1.73m2 - 29 ml/min/1.73m2 或伴有终末期肾病(eGFR <15 ml/min/1.73m2)的儿科患者
• 肌酐清除率(CLcr)范围为 15 ml/min - 29 ml/min 或伴有终末期肾病(CLcr<15 ml/min)的成人患者。
以下不良反应在下文以及其他地方描述:
超敏反应(参见【注意事项】)
高磷血症和肾钙质沉着症风险(参见【注意事项】)
注射部位反应(参见【注意事项】)
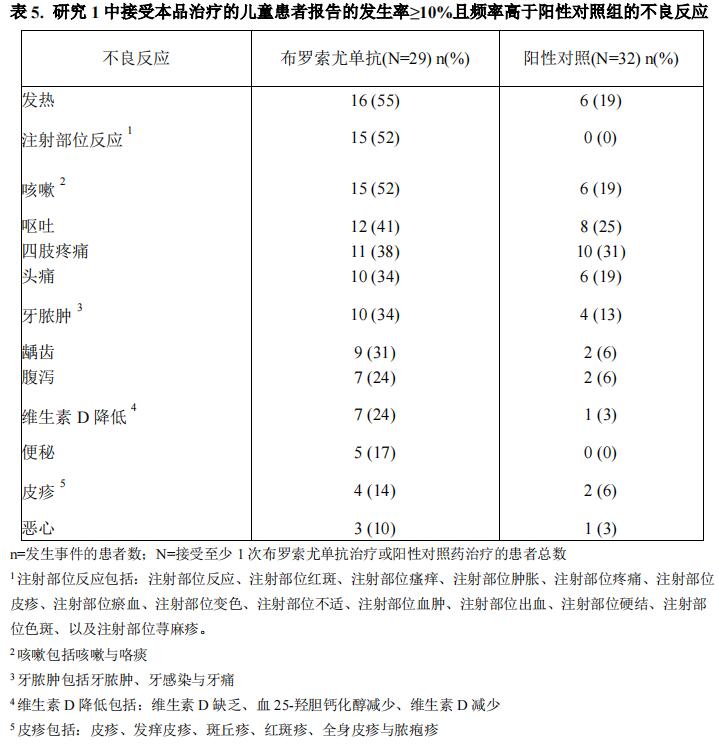
XLH 儿童患者的不良反应
本品已完成了 3 项 XLH 适应症的境外临床研究。研究 1 是以 1 到 12 岁 XLH 患者为研究对象的开放、随机对照的Ⅲ期研究。患者被随机分配至布罗索尤单抗治疗组或口服磷酸盐与活性维生素 D 的阳性对照组(布罗索尤单抗组=29 例,阳性对照组=32 例)。研究 2 是以 5 到 12 岁 XLH 患者为研究对象的开放的Ⅱ期研究(共 52 例)。
研究 3 是以 1 到小于 5 岁 XLH 患者为研究对象的开放的Ⅱ期研究(共 13 例)。上述3 项研究的患者人群在 1-12 岁之间(中位年龄为 7 岁),男性占 49%,白人占 88%。
在研究 1 中,被随机至布罗索尤单抗治疗组的患者接受了每两周 1 次的给药,平均剂量约为 0.90 mg/kg(剂量范围为 0.8-1.2 mg/kg)。试验组与阳性对照组的全部受试者均完成了 64 周的给药。
表 5 中列出了研究 1 布罗索尤单抗组在 64 周治疗期间发生率≥10%且高于阳性对照组的不良反应。
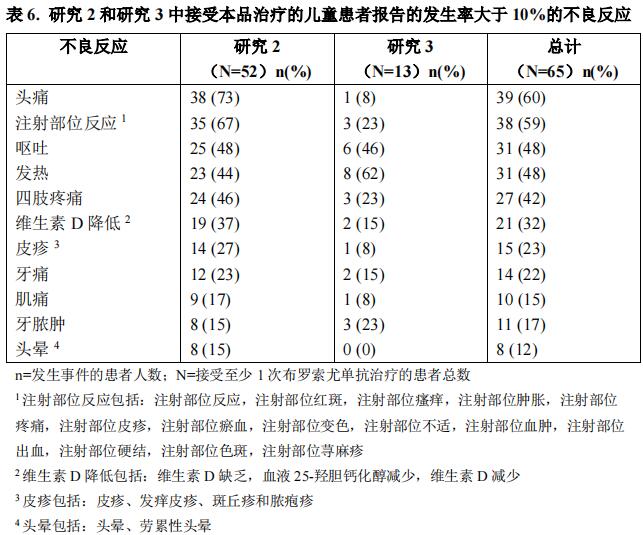
在研究 2 中,26 名患者接受每 2 周一次布罗索尤单抗治疗,第 64 周的平均剂量为 1.05mg/kg(范围 0.4–2.0 mg/kg);另外 26 名患者每 4 周接受一次布罗索尤单抗给药,平均暴露期为 124 周。在研究 3 中,患者接受每 2 周一次布罗索尤单抗治疗,第 40 周的平均剂量为 0.90 mg/kg(范围 0.8-1.2 mg/kg),平均暴露期为 45 周。研究2 和 3 中,接受布罗索尤单抗治疗的患者报告的发生率大于 10%的不良反应如表 6 所示。
超敏反应
在研究 1(布罗索尤单抗组 29 例患者)中,最常见的超敏反应为皮疹(10%),注射部位皮疹(10%)与注射部位荨麻疹(7%)。在研究 2 与研究 3(共 65 例患者)中,最常见的超敏反应事件为皮疹(22%),注射部位皮疹(6%)和荨麻疹(5%)。
高磷血症
在儿童研究中,未报告高磷血症事件。
注射部位反应
在研究 1(布罗索尤单抗组 29 例患者)中,52%的患者发生本品注射部位局部反应(例如注射部位荨麻疹、红斑、皮疹、肿胀、瘀血、疼痛、瘙痒和血肿)。在研究 2 和 3(布罗索尤单抗组 65 例患者)中,大约 58%的患者发生本品注射部位局部反应。注射部位反应的严重度通常为轻度,在注射后 1 天内发生,持续约 1 至 3 天,不需要治疗,几乎在所有患者中均消退。
XLH 成人患者的不良反应
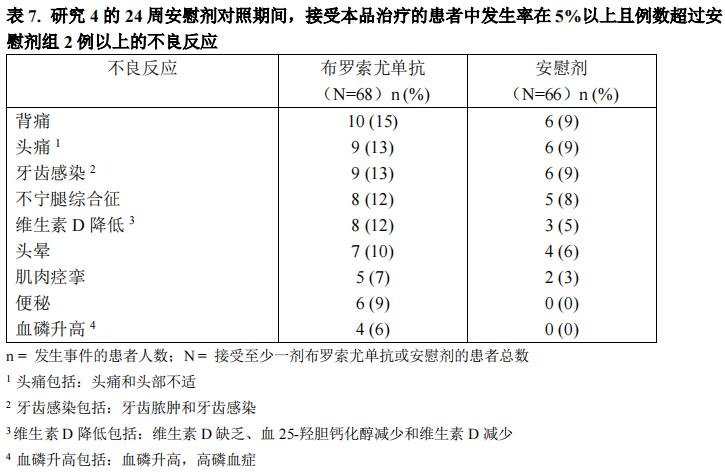
一项 134 例患者的随机双盲安慰剂对照研究(研究 4)确立了布罗索尤单抗在成年 XLH 患者中的安全性。该研究的受试者年龄为 20-63 岁(平均年龄 41 岁),其中大多数为白种人/高加索人(81%)和女性(65%)。共有 68 例受试者与 66 例受试者分别接受了至少 1 次的布罗索尤单抗或安慰剂给药。本品的平均剂量为 0.95 mg/kg(剂量范围为 0.3-1.2 mg/kg),每 4 周一次,皮下注射给药。研究 4 的 24 周安慰剂对照期间,接受布罗索尤单抗治疗的患者中报告的发生率在 5%以上且发生例数超过安慰剂组 2 例以上的不良反应如表 7 所示。
在为期 24 周的安慰剂对照研究之后,进行了 24 周的开放治疗,所有患者每 4周 1 次皮下注射本品给药。在开放治疗延长期内未发现新的不良反应。
超敏反应
在研究 4 的双盲期,本品和安慰剂治疗组中大约 6%的患者发生了超敏反应事件。这些事件为轻度或中度,不需要停药。
高磷血症
在研究 4 的双盲期,本品治疗组中 7%的患者出现了符合方案规定的剂量减少标准(单次血磷值大于 5.0 mg/dL 或两次血磷值大于 4.5 mg/dL[正常值上限])的高磷血症。高磷血症通过剂量减少得到控制。所有符合方案规定标准的患者的剂量均减少了50%。仅有一位患者由于存在持续性高磷血症需要第二次剂量减少。
注射部位反应
在研究 4 的双盲期,本品和安慰剂治疗组中大约 12%的患者发生注射部位局部反应(例如注射部位反应、红斑、皮疹、瘀血、疼痛、瘙痒和血肿)。注射部位反应的严重度通常为轻度,在注射后 1 天内发生,持续约 1 至 3 天,不需要治疗,几乎在所有患者中均消退。
不宁腿综合征(RLS)
在研究 4 的双盲期,本品治疗组中大约 12%的受试者发生基线不宁腿综合征(RLS)恶化或新发轻度至中度 RLS;这些事件并未导致给药中断。其他重复给药的成人 XLH 研究中也报告了非严重 RLS;在一个病例中,基线 RLS 恶化导致停药,随后事件缓解。
椎管狭窄
患有 XLH 的成人常伴有椎管狭窄,并有脊髓压迫报告。在 XLH 成年患者中进行的本品Ⅱ期和Ⅲ期研究中(共 176 例),总共有 7 名患者接受了脊柱手术。这些病例中的大多数涉及既往椎管狭窄进展。目前尚不清楚本品治疗是否会加剧椎管狭窄或脊髓压迫。
TIO 成人患者的不良反应
在两项单组临床研究(研究 6 和研究 7)中证实了布罗索尤单抗在 TIO 患者中的安全性,这两项研究共入组了 27 例患者。14 例患者为男性,年龄在 33 至 73 岁之间。布罗索尤单抗的平均剂量为每 4 周 0.77 mg/kg,平均暴露持续时间为 121 周。表8 所示为研究 6 和研究 7 汇总数据中 TIO 成人患者报告的不良反应。


超敏反应
在研究 6 和 7 的汇总数据中,22%的患者发生了超敏反应。最常见的超敏反应是湿疹(11%)和皮疹(11%)。该病例的严重程度为轻至中度。
高磷血症
在研究 6 和 7 的汇总数据中,2 例患者(7%)发生了高磷血症,并通过减少剂量进行管理。
注射部位反应
注射部位反应的频率是 15%(注射部位反应、注射部位疼痛和注射部位肿胀)。
注射部位反应的严重程度通常为轻度,无需治疗,且所有病例均消退。
不宁腿综合征
在研究 6 和 7 的汇总数据中,2 例患者(7%)发生了不宁腿综合征症状,症状轻微,不需要中断治疗。
免疫原性
与所有治疗性蛋白质一样,本品有产生免疫原性的可能。抗体的检测高度依赖于分析方法的敏感性和特异性。此外,测定中观察到的抗体(包括中和性抗体)阳性的发生率可能受到多种因素的影响,包括测定方法学、样品处理、样品采集时间、伴随药物和基础疾病。因此,将下述研究中的布罗索尤单抗抗体发生率与其他研究中或其他产品中的抗体发生率之间的比较可能会产生误导。
在 XLH 临床研究中,0%(0/13)的 1-4 岁患者、19%(10/52)的 5-12 岁患者和15%(20/131)的成人患者在接受布罗索尤单抗治疗后抗药抗体(ADA)检测呈阳性。
其中 3 例 5-12 岁患者中和抗体检测呈阳性。XLH 患者中 ADA 的存在与布罗索尤单抗的药代动力学、药效学、有效性和安全性的临床相关变化无显著相关性。
在一项 TIO 临床研究中,14%(2/14)的成人患者在接受布罗索尤单抗治疗后ADA 检测呈阳性。ADA 阳性患者中和抗体检测均未呈阳性。在另一项 TIO 临床研究中,13 例成人患者在接受布罗索尤单抗治疗后均未检测出 ADA 阳性。
上市后经验
布罗索尤单抗注射液批准后使用期间发现了以下不良反应:调查显示接受本品治疗的 XLH 儿童患者出现血磷升高。
这些反应是在人数不确定的人群中自发报告的,因此很难可靠地估计发生率或者确定与药物暴露的因果关系。
对活性成份或任何辅料过敏(参见【成份】)。
与口服磷酸盐、活性维生素 D 类似物(如骨化三醇、帕立骨化醇、度骨化醇、骨化二醇)合并给药,因为存在高磷血症风险(参见【药物相互作用】)。
高磷血症风险导致的空腹血磷浓度高于对应年龄的正常参考范围(参见【注意事项】)。
重度肾功能损害或终末期肾病患者。
超敏反应
接受本品治疗的患者中已报告超敏反应(例如皮疹、荨麻疹)。如果发生严重超敏反应则停止使用本品, 并给予适当的治疗。
高磷血症
由于存在高磷血症的风险, 应监测患者的空腹血磷水平。为了降低异位矿化的风险, 建议将空腹血磷控制在对应年龄的正常参考范围的下限。可能需要中断剂量和或减少剂量。建议定期检查餐后血磷。
异位矿化
XLH 患者经口服磷和维生素D类似物治疗后,观察到肾钙质沉着症引起的异位矿化。这些药品应该在开始本品治疗前至少1周停止使用。
建议在治疗开始时以及在治疗后12个月中每6个月一次以及此后每隔1年,通过肾脏超声检查等方法监测肾钙质沉着症的表现。建议每 6个月(1至2岁儿童每3个月)监测一次血浆碱性磷酸酶、钙、PTH 和肌酐或按提示监测。建议每3个月监测尿钙和磷酸盐。
注射部位反应
本品给药可能导致局部注射部位反应。如果发生严重注射部位反应则停止使用本品,并给予适当的治疗。(参见【不良反应】)
血清甲状旁腺激素
有些患者在使用本品治疗期间观察到血清甲状旁腺激素的升高。建议定期检测血清甲状旁腺激素水平。
已知可引起不良反应的辅料
本品每瓶含 45.91 mg(45.91 mg/ml)的山梨醇。
尚无关于本品用药过量的报告。在儿童临床试验中使用本品,无剂量限制性毒性,剂量高达 2 mg/kg,最大剂量为 90 mg,每 2 周一次。在成人临床试验中,使用高达 1 mg/kg 的剂量或 128 mg 的最大总剂量(每 4 周一次)时未观察到剂量限制性毒性。如果用药过量,建议立即测定血磷水平、血清钙水平和肾功能,并定期监测,直至恢复为正常/基线水平。在高磷血症的情况下,停用本品并给予适当的治疗。
妊娠期 目前关于孕妇使用本品的数据有限或尚无相关数据。 动物研究已证实本品具有生殖毒性。 不建议孕妇以及未采取避孕措施且具有生育能力的女性使用本品。 生育力 动物研究已表明本品对于雄性生殖器官具有影响。尚无有关本品对于人类生育力影响方面的临床数据。未在动物中专门开展本品的生育力研究。尚不清楚本品/代谢产物是否会分泌至人乳汁中。无法排除本品对新生儿/婴儿的风险。必须在权衡哺乳对于婴儿的获益以及治疗对于母亲的获益后决定是否停止哺乳或停止/放弃本品治疗。尚未在 1 岁以下 XLH 儿童患者中确认本品的安全性和有效性。 尚未在 TIO 儿童患者中确认本品的安全性和有效性。本品的临床研究并未包含足够数目的≥ 65岁患者,所以无法明确该人群的应答是否会与年轻患者存在差异。其他已报道的临床经验尚未发现老年患者和年轻患者之间的反应差异。总体上,老年患者的剂量选择应谨慎,通常从剂量范围的低剂量端开始,因为肝肾或心脏功能降低,合并疾病或其他药物治疗的频率更高。
本品与口服磷酸盐和/或活性维生素 D 类似物合并使用会导致血磷升高,高于本品单独给药对应的预期磷浓度。该升高可能导致高磷血症,而高磷血症可能诱发肾钙质沉着症。
禁止本品与口服磷酸盐和/或活性维生素 D 类似物合并使用。
Kyowa Kirin Co.,Ltd.,Takasaki Plant
86982988000022,86982988000046,86982988000039
成纤维细胞生长因子 23(FGF23)对磷酸盐在肾小管的重吸收和 1,25 二羟基维生素 D 在肾脏的生成具有抑制作用,过量的 FGF23 可引起 X 连锁低磷血症。布罗索尤单抗与 FGF23 结合并抑制 FGF23 的生物活性,恢复肾脏磷酸盐的重吸收,增加血清 1,25 二羟基维生素 D 浓度。
遗传毒性
未进行布罗索尤单抗遗传毒性研究。
生殖毒性
未进行布罗索尤单抗生育力和早期胚胎发育毒性研究。正常食蟹猴 40 周重复给药毒性研究中,给药暴露量为人暴露量(临床成人剂量按 1 mg/kg,每 4 周一次)的65 倍时,未见布罗索尤单抗对雌性动物生殖器官的明显影响,雄性动物给药暴露量为人暴露量的 11 至 37 倍时,可见与高磷血症相关的睾丸网或生精小管极轻微矿化,但精液分析未见明显异常。
正常食蟹猴妊娠第 20 天起至第 133 天(涵盖器官发生期)静脉注射布罗索尤单抗,每 2 周给药一次,胎仔血清中可检出布罗索尤单抗,提示可透过胎盘,暴露量为成年人暴露量的 1、7 和 64 倍时,未见对胎仔或子代生长发育的影响,为成年人暴露量的 64 倍时,可见晚期胎仔丢失增加、妊娠期缩短和早产发生率增加,母体动物可见高磷血症和胎盘矿化,胎仔和子代可见高磷血症,但未见异位矿化。未见布罗索尤单抗对围产期子代动物生长的影响,包括存活率。
致癌性
未进行布罗索尤单抗的动物长期致癌性试验。
其它毒性
兔和食蟹猴给予布罗索尤单抗,可通过抑制 FGF23,增加血清磷和 1,25 二羟基维生素 D 水平。正常动物给予布罗索尤单抗,在引起血磷酸盐超生理水平的剂量下,可导致多个组织和器官的异位矿化。与野生型(WT)小鼠比较,低磷血症 Hyp 小鼠(小鼠 XLH 模型)给予布罗索尤单抗后的异位矿化明显减少。
成年食蟹猴给予布罗索尤单抗暴露量为人暴露量 37 至 65 倍时,可见骨转换、骨矿含量和/或骨密度以及皮质厚度增加。成年雄性猴给予布罗索尤单抗暴露量为人暴露量的 37 至 47 倍时,可见对骨骼的不良影响,包括骨矿化密度降低、骨矿化减少以及骨强度降低。
幼年食蟹猴给予布罗索尤单抗暴露量为人暴露量(最大剂量为 2mg/kg,每 2 周一次)的 0.5 至 5 倍时,可导致骨转换、骨矿化含量和/或骨矿化密度和/或骨皮质厚度增加。幼年雄性猴给予布罗索尤单抗,暴露量为临床儿科给药暴露量的 5 倍时,可导致骨矿化减少,但对骨强度和骨骼发育未见不良影响。
儿童 X 连锁低磷血症
布罗索尤单抗的评价进行了 3 项研究,共招募了126 例儿童XLH患者。
研究1(NCT 02915705)是一项在61例1-1岁儿童 XLH 患者中进行的为期64周的随机、开放性研究,比较本品与阳性对照药物(口服磷酸盐和活性维生素 D)的治疗。在第一次给药时,患者平均年龄为6.3岁,且44%的患者为男性。所有患者在基线时均伴有佝偻病影像学体征,RSS 评分≥ 2.0,且其既往接受口服磷酸盐和活性维生素D类似物治疗,平均(SD)持续时间为 4(3.1)年。口服磷酸盐和活性维生素 D 类似物治疗在研究入组前停止7天洗脱期),然后在阳性对照组患者中恢复。患者随机接受本品起始剂量 0.8 mg/ g 每2周1次给药或接受口服磷酸盐(推荐剂量 20-60 mg/kg/d)和活性维生素 D(推荐的骨化三醇剂量:20-30 ng/kg/d;推荐的阿法骨化醇剂量:40-6 0 ng/kg/d)给药。随机分配至阳性对照药物治疗组的患者在第40周接受平均剂量约为 41 mg/kg/d(范围:18-110 mg/kgd)的口服磷酸盐给药,在第64周接受平均剂量约为 46 mg/kg/d(范围:18 mg/kg/d-166 mg/kg/d)的口服 磷酸盐给药。该组患者在第 40 周接受平均剂量为 26 ng/kg/d 的口服骨化三醇给药,在第 64 周接受平均剂量为 27 ng/g/d 的骨化三醇给药,或接受治 疗等效剂量的阿法骨化醇给药。布罗索尤单抗组中 8 例患者的剂量根据血磷 水平测定值滴定至 1.2 mg/kg 所有患者均至少完成 64 周研究治疗。
血磷
在研究1中,布罗索尤单抗导致平均(SD)血磷水平从基线时的2.4(0.24)mg/dL 增至第 40 周时的3.3(0.43)mg/dL 以及第 64 周时的3.3(0.42)mg/dL。在阳性对照组中,平均(SD)血磷浓度从基线时的2.3(0.26)mg/dL 增至第40周时的 2.5(0.34)mg/dL 以及第64周时的2.5(0.39)mg/dL 在接受本品治疗的患者中,通过 TmP/GFR 评估的平均(SD)肾磷重吸收率分布从基线时的2.2(0.3 7)mg/dL 增至第40周时的 3.4(0.67)mg/dL 和第64周时的3.3(0.65)mg/d 在阳性对照组中,平均(SD)TMP/GFR 从基线时的 2.0(0.33)mg/dL 降至第 40 周时的 1.8(0.35)mg/dL,且在第 64 周时维持在低于基线值的水平,即 1.9(0.49)mg/dL。
图 1.研究 1 中 1-12 岁儿童组中血磷浓度以及较基线的变化(mg/dL)(平均值±SD)(按治疗组分层)
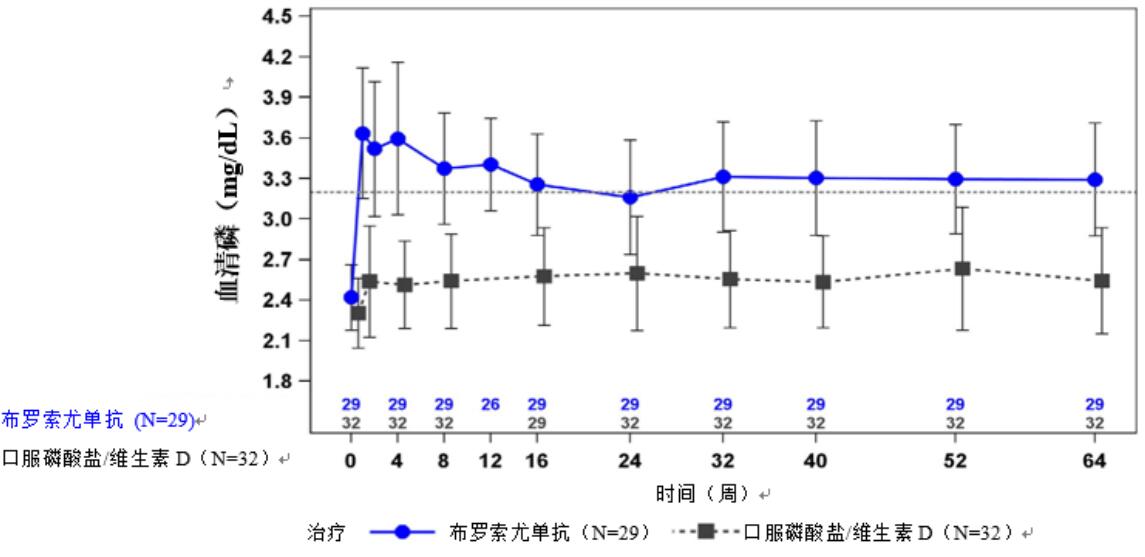
虚线代表研究 1 中患者的正常值下限(3.2 mg/dL)。
佝偻病影像学评价
检查影像学照片以便使用下述量表评估 XLH 相关佝偻病:10 分 Thacher 偻病严重程度评分(RSS)和 7 分影像学总体变化印象(rgcrSS 评分根据单个时间点的腕关节和膝关节图像分配,评分越高则佝偻病严重程度越高。RGI-C 评分根据两个时间点的腕关节和膝关节光照片逐项比较予以分配,评分越高则佝偻病 X 光照片证据中的改善幅度越高。 + 2.0 的 RGI-C 评分定义为实质性好转的 X 光照片证据。
在研究1中,布罗索尤单抗组中基线平均(SD)总RSS为3.2(0.98),阳性对照组为 3.2(1.14)。在40周本品治疗后,平均总 RSS 从3.2 降至1.1(0.72),阳性对照组从3.2 降至2.5(1.09)。在第40周,布罗索尤单抗组的LS均值(SE)rg-C 总评分为+ 1.9(0.11),阳性对照组为+ 0.8(011)(见表 9)。在第40周,布罗索尤单抗组29例患者中的21例,和阳性对照组32例患者中的2例实现 RGI-C总评分≥ + 2.0。这些结果维持到第64周,如表9所示。
下肢骨骼异常
在研究 1 中,RGI-C 评分使用站立长腿 X 光照片为根据,评估下肢骨骼异常。在第 64 周,布罗索尤单抗组的改善幅度高于阳性对照组(LS 均值[SE]: + 1.25[0.17]vs + 0.29[0.12];差异为 + 0.97(95Cl: + 0.57 + 1.37,GEE 模型)。
血清碱性磷酸酶活性
在研究 1 中,在第 64 周布罗索尤单抗组平均(S 血清碱性磷酸酶活性从基线时的 511(125)降至 337(86)U/L(平均变化:-33%),而阳性对照组从基线时的 523(154)降至 495(182)U/L(平均变化:-5%)。
生长
在研究 1 中,布罗索尤单抗治疗 64 周导致站立平均(SD)身高 Z 评分从基线时 的-2.32(1.17)增至第 64 周时的-2.11(1.11(LS 均值变化(SE)为 + 0.17(0.0 7)。在阳性对照组中,平均(SD)身高 Z 评分从基线时的-2.05(0.87)mg/dL 增至第 64 周时的-2.03(0.83)mg/dL(LS 均值(E)变化为 + 0.02(0.04))第 64 周时治疗组间差异为 + 0.14(95%Cl:0.00, + 0.29)。
研究 2(NCT 02163577)是一项在 52 名 5 至 12 岁 XLH 青春期前患者中进行的一项随机、开放标签研究,比较了本品每 2 周一次与每 4 周一次给药。在最初的 16 周剂量调整阶段之后,患者完成 48 周的本品治疗期,每 2 周一次给药。所有 52 名患者完成至少 64 周的研究;没有患者停药。基于给药当天的 空腹血磷水平调整本品剂量,以达到 3.5 至 5.0 mg/dL 的目标空腹血磷浓度。52 名患者中的 26 名接受本品每 2 周一次给药,最大剂量为 2 mg/kg 第 16 周时平均剂量为 0.73 mg/kg(范围:0.3,.5),第 40 周时为 0.98 mg/kg (范围:0.4,2.0),第 60 周时为 1.04 mg/kg(围:0.4,2.0)其余 26 名患者接受本品每 4 周一次给药。在参与研究时,患者的平均年龄为 8.5 岁,46% 为男性。96% 的患者曾接受口服磷酸盐和活性维生素 D 类似物,平均(SD)持续时间为 7(2.4)年。在研究入组之前停用口磷酸盐和活性维生素 D 类似物。
94% 的患者在基线时有佝偻病的影像学证据。
研究 3(NCT 02750618)是一项在 13 名 1 至 4 岁 LH 儿童患者中进行的为期 64 周的开放标签研究。患者按 0.8 mg/kg 的剂量每 2 周接受一次本品给药,有 3 例患者根据血磷测定值将剂量上调至 1.2 mg/g 所有患者均完成至少 40 周的研究;没有患者停药。在参与研究时,患者的平均年龄为 2.9 岁,69% 为 男性。所有患者在基线时均有佝偻病的影像学证据,12 名患者曾接受口服磷酸盐和活性维生素 D 类似物,平均(SD)持续时间为 16.7(14.4)个月在研究入组之前停用口服磷酸盐和活性维生素 D 类似物。
血磷
在研究2中,在接受本品每2周一次给药的患者中,平均(SD)血磷水平从基 线时的2.4(0.40)增加至第40周和第64周时的 3.3(0.40)和 3.4(0.45)mg/dL。这些患者的肾小管磷酸盐最大重吸收率与肾小球滤过率的比值(Tmp/gfr) 均值(SD)从基线时的 2.2(0.49)增加至第 40 周和第 64 周时的 3.3(0.60)和 3.4 0.53)mg/dL。
在研究3中,本品使平均(SD)血磷水平从基线时的 2.5(0.28)mg/dL 增加至第 40 周时的 3.5(0.49)mg/dL。
佝偻病的影像学评价
在研究2中,在接受本品每2周一次给药的患者中,基线平均(SD)SS 总评分为 1.9(1.17)。40周治疗后,平均总RSS从 1.9 降至 0.8(参见表 10)。40 周治疗后,接受本品每2周一次给药的患者的平均 RGC 整体评分为 + 1.726 名患者中的18名患者 RG-C 评分 ≥ + 2.0。在第 64 周时这些结果持续存在,如表 10 所示。
在研究3中,13 名患者的基线平均(SD)总 RSS 为 2.9(1.37)在接受本品40周治疗之后,平均总RSS从2.9降至1.2,平均(SE)RGI-C 整体评分为 + 2.3(0.08) (参见表10)。所有13名患者的 RGI-C 整体评分均≧2 + 2.0。
下肢骨骼异常
在研究3中,使用站立长腿X光照片通过RGI-C评估的第40周下肢畸形平均(SE)变化为1.3(0.14)。
清碱性磷酸酶活性
对于研究2,在接受本品每 2 周一次给药的患者中,平均(SD)血清总碱性磷酸酶活性在基线时为 462(110)U/L,在第64周时降至354(73)u/L(-23%,p <0.0001)。
对于研究3,平均(SD)血清总碱性磷酸酶活性在基线时为549(194)UL,在 第 40 周时降至335(88)U/L(平均变化:-36%)。
生长
在研究2中,在接受本品每2周一次给药的患者中,持续64周的治疗使平均(SD)站立身高Z评分从基线时的-1.72(1.03)增加至-1.54(1.13)(LS平均变化+ 0.19(95%Cl:0.09 至 0.29)。
成人X连锁低磷血症
研究4(NCT 02526160)是在134名 XLH 成年患者中进行的一项随机、双盲、 安慰剂对照研究。该研究包括24周的安慰剂对照治疗期继以 24 周开放性治 疗期。按 1 mg/kg 的剂量每 4 周一次给予本品。在参与研究时,患者的平均年龄为 40 岁(范围为19至66岁),35% 为男性。所有患者在基线时均有与 XLH/骨软化症相关的骨骼疼痛。基线平均(D)血磷浓度低于正常值下限,为1.98(0.31)mg/dL。研究期间不允许接受口服磷酸盐和活性维生素D类似 物。在入组研究的134名患者中,布罗索尤单抗组的1名患者在 24 周安慰剂 对照治疗期内停止治疗,7名患者在开放性治疗期内停止本品治疗。
研究 5(NCT 02537431)是一项为期48周在 14XLH 成年患者中进行的开放标签、单臂研究,旨在评估本品对骨软化症改善的影响,通过髂嵴骨活检的组织学和骨形态计量学评价确定。患者接受本品 1 mg/kg 每 4 周一次给药。在参与研究时,患者的平均年龄为 40 岁(围为25至52岁),43% 为男性。研究期间不允许接受口服磷酸盐和活性维生素D类似物。
血磷
在研究4中在基线时,安慰剂组和布罗索尤单抗组的平均(SD)血磷分别为 1.9(0.32)和 2.0(0.30)mg/dL。在最初的24周双盲、安慰剂对照期间,安慰剂组和布罗索尤单抗组在给药间隔中点(给药后周)的平均(SD)血磷分别为 2.1(0.30)和 3.(0.53)mg/dL,在给药间隔结束时的平均(SD)血磷为 2.0(0.30)和 2.7(0.45)mg/dL。
到第24周,布罗索尤单抗组共有94% 的患者的血磷水平高于正常值下限(LLN),而安慰剂组则为8%(表11)

在开放性治疗期内,在本品连续治疗期间可以维持血磷水平,截至第 48 周没有证据表明本品疗效降低。
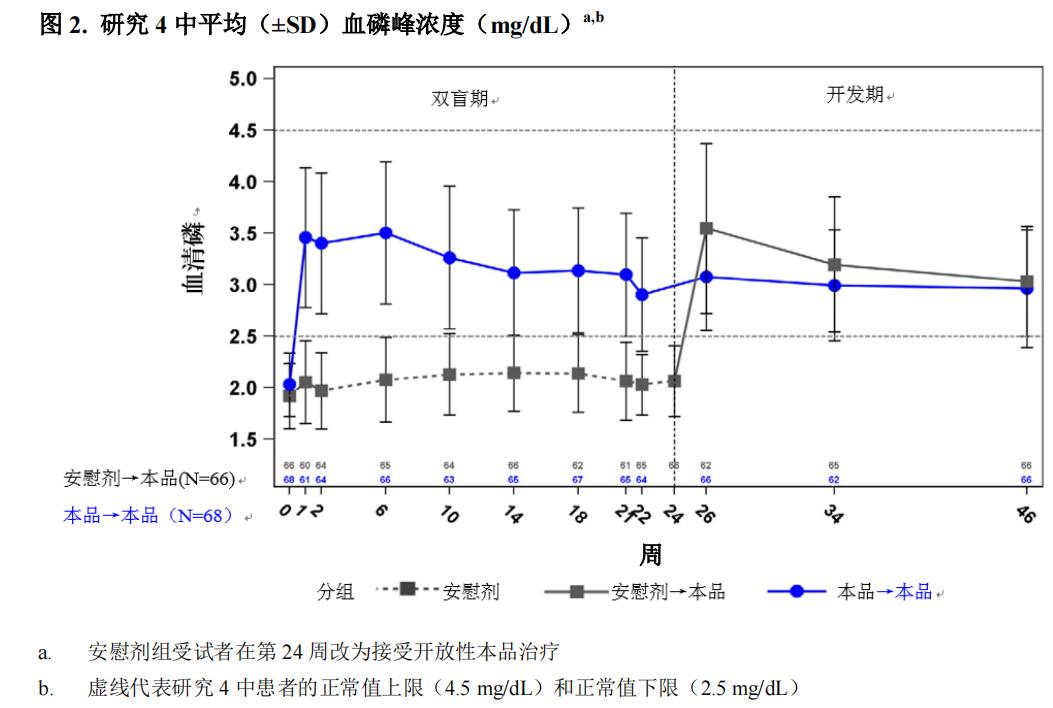
安慰剂组和布罗索尤单抗组在基线的肾小管磷酸盐最大重吸收率与肾小球滤过率的平均(SD)比值(TmP/GFR)分别为1.60(0.37)和1.68(0.40)mg/dL。在第22周(给药间隔中点),安慰剂组和布罗索尤单抗组的平均(SD)TmP/GFR为1.69(0.37)和2.73(0.75)mg/dL。在第24周(给药间隔结束),安慰剂组和布罗索尤单抗组的平均(SD)TmP/GFR为1.73(0.42)和2.21(0.48)mg/dL。在开放性治疗期,本品连续治48周内,TmP/GFR维持稳定。
骨软化症的影像学评价
在研究4中,在基线进行了骨骼检查,以确定骨软化症相关骨折和假性骨折。骨软化症相关骨折定义为穿过两个骨皮质的非创伤性透亮影,假性骨断定义为穿过一个皮质的非创伤性透亮影。52%的患者在基线时存在活动性(未愈合)骨折(12%)或活动性假性骨折(47%)。活动性骨折和假性骨折主要位于股骨、胫骨/腓骨和足跖骨。如表12所示,在第24周对这雪活动性骨折/假性骨折部位进行的评估表明,与安慰剂组相比,布罗索尤单抗组的完全愈合奉更高。在24周治疗期间,68名接受本品的患者中共有6例新发骨折或假性骨折,而66名接受安慰剂的患者中则有8例新发异常(见表12)。
在开放性治疗期内,持续接受本品治疗的患者在第48周表现出骨折持续愈合[活动性骨折(n=8,57%);活动性假性骨折(n=33,65%)]。在“安慰剂切换至布罗索尤单抗”组中,在第48周观察到骨折愈合:活动性骨折(n=6,46%);活动性假性骨折(n=26,33%)。
患者报告结果
研究4评价患者报告的XLH相关症状(疼痛、关节僵硬和身体机能)。
在第24周,布罗索尤单抗组在僵硬严重程度评分(-7.9)方面相较安慰剂组(+0.3)表现出改善(范围:0-100;评分较低反映症状改善)。在第24周,布罗索尤单抗组和安慰剂组之间在患者报告的疼痛强度或身体机能评分方面不存在显著差异。
组织形态计量法
在研究5中,在治疗48周后,在10名患者中观察到骨软化症愈合,通过类骨质体积/骨体积(OV/BV)平均(SD)评分从基线时的26%(12.4)降至11%(6.5)证明,变化为-57%。11名患者的类骨质厚度(0.Th)均值(SD)从17(4.1)微米下降至12(3.1)微米,变化为-33%。6名患者的矿化延迟时间(MLt)均值(SD)从594(675)天降至156(77)天,变化为-74%。
成人肿瘤性骨软化症
已在2项研究中对本品进行了评价,这2项研究共入组了27例TIO患者。
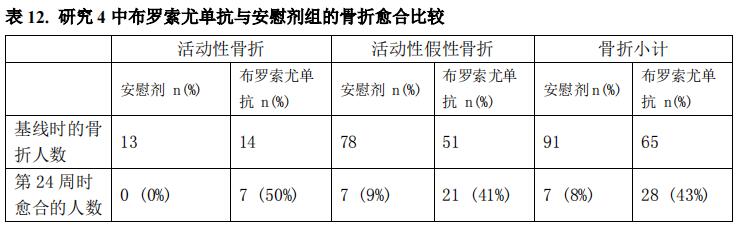
研究6(NCTO2304367)是一项单臂、开放标签研究,入组了14例被确诊为由不适合手术切除或无法定位的潜在的肿瘤引起的FGF23相关低磷血症成人患者。在入组的14例TIO患中,8例为男性,年龄在33岁至68岁之间(中位年龄为59.5岁)。在研究入组之前2周停用口服磷酸盐和活性维生素D类似物。患者每4周接受一次本品,起始剂量为0.3mg/kg体重,滴定至达到空腹血磷水平2.54.0mg/dL。在第20周时的平均剂量为0.83mg/kg,第48周时为0.87mg/kg,第96周时为0.77mg/kg,第144周时为0.71mg/kg。
研究7(NCTO2722793)是一项单臂、开放标签研究。13例被确诊为TIO的成人患者接受了本品治疗。在接受治疗的13例TIO患者中,6例为男性,年龄在41岁至73岁之间(中位年龄为58.0岁)。本品起始剂量0.3mg/kg,4周后根据需要以0.2mg/kg增幅进行调整(但,仅限起始剂量0.3mg/kg开始后的首次剂量增至0.6mg/kg),剂量调整范围为0.1~2mg/kg,88周、4周1次时,血清磷浓度的变化如(图4)所示。在研究入组之前2周停用口服磷酸盐和活性维生素D类似物。患者每4周接受一次本品,基于体重的起始剂量为0.3mg/kg体重,滴定至空腹血磷水平为2.5-4.0mg/dL。第48周时的平均(SD)剂量为0.91(0.59)mg/kg,第88周时为0.96(0.70)mg/kg。
血磷
在研究6中,本品使平均(SD)血磷水平从基线时的1.60(0.47)mg/dL增加至给药间隔中值为第24周时的平均水平2.64(0.76)mg/dL,50%的患者(7/14)在第24周给药间隔中点达到高于LLN平均值的平均血磷水平。截至第144周,平均血磷浓度的增加维持在LLN附近或之上(图3)。这些患者的TmP/GFR比值有所增加,从基线时的平均值(SD)1.12(0.54)mg/dL增加至第48周时的2.12(0.64)mg/dL,并在第144周之前保持稳定。
图 3. 研究 UX023T-CL201 中血磷浓度和相对于基线的变化(mg/dL)
在研究7中,本品使平均(SD)血磷水平从基线时的1.62(0.49)mg/dL增加至给药间隔中值为第24周时的平均水平2.63(0.87)mg/dL,69%的患者(9/13)平均血磷水平在给药间隔中值为第24周时达到高于平均LLN。截至第88周,平均血磷浓度维持在LLN以上。肾脏磷酸盐重吸收能力(通过TmP/GFR进行评估)从基线时的平均(SD)1.15(0.43)mg/L增加到第48周时的2.30(0.48)mg/dL(图4)。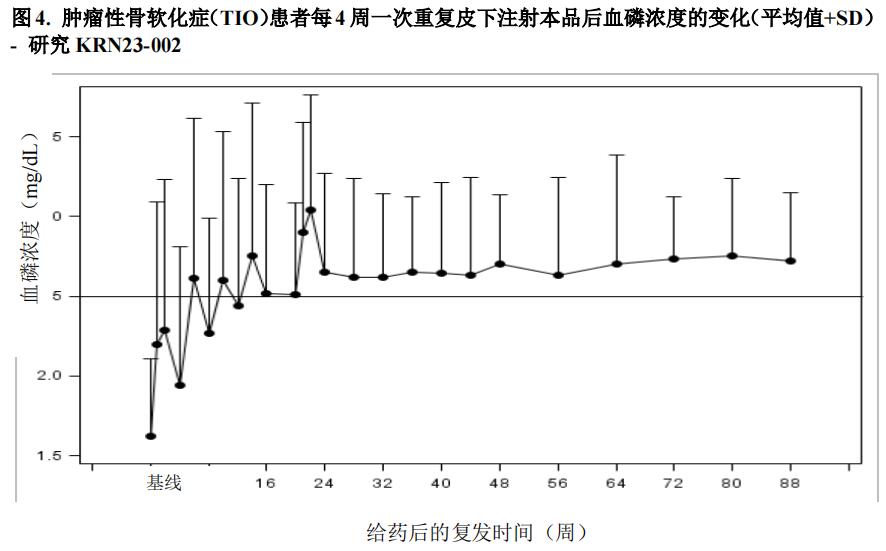
骨组织形态计量法
在研究6中,对11例患者进行配对骨活检,其中9例在基线时存在骨软化症,治疗48周后被评估为正在愈合。在基线时存在骨软化症的这9例患者中,OV/BV从基线时的平均(SD)评分21.2%(19.9)下降至13.9%(16.7),变化为-34%。0.Th从平均(SD)18.9(11.9)微米下降至12.1(10.1)微米,变化为-36%。3例患者的MLt有所下降,平均值(SD)从667(414)天降至331(396)天,变化为-50%。
在研究7中,3例成对骨活检患者在基线时都存在骨软化症,治疗48周后被评估为正在愈合。在这3例患者中,oV/BV从基线时的平均(SD)评分14.0%(15.2)下降至9.2%(5.5),变化为-34%。0.Th从平均(SD)16.0(13.7)微米下降至13.5(7.1)微米,变化为-16%。
骨软化症的影像学评价
在研究6中,在基线和研究期间的随后时间点对所有14例患者进行了9m得标记的全身骨扫描。骨扫描允许在包括骨软化症在内的多种骨疾病中评估示踪剂摄取增加的部位。在TIO患者中,骨扫描中示踪剂摄取增加被认为是非创伤性骨折和假性骨折。基线时,所有患者都有示踪剂摄取区域,14例患者共有249处骨异常。从第48周到第144周,示踪剂摄取区域的数量有所减少,表明骨异常的治愈。
在给予经批准的推荐起始剂量(基于患者的体重为 70 kg,另有说明除外)的 XLH患者中观察到以下药代动力学参数。群体 PK 分析表明,在 XLH 和 TIO 患者之间,本品的 PK 特征相似。在 0.1 至 1 mg/kg(0.08 至 0.8 倍最大批准推荐剂量,基于 XLH患者体重为 70 kg)的剂量范围内皮下注射给药之后,布罗索尤单抗显示线性药代动力学。
成年 XLH 患者中布罗索尤单抗的稳态平均(±SD)谷浓度为 5.8(±3.4)µg/ml。
吸收
布罗索尤单抗平均 Tmax值范围为 8 至 11 天。
分布
布罗索尤单抗的表观分布容积为 8 L。
消除
表观清除率为 0.290 L/天。布罗索尤单抗的半衰期约为 19 天。
代谢
尚未表征确切的布罗索尤单抗代谢途径。预计布罗索尤单抗会通过分解代谢途径降解为小分子肽和氨基酸。
特殊人群
未观察到布罗索尤单抗药代动力学基于年龄的临床显著差异。肾或肝损伤对布罗索尤单抗药代动力学的影响尚不清楚。
儿童患者
5-12 岁 XLH 患者中的稳态谷浓度为 15.8(±9.4)µg/ml,1-4 岁 XLH 患者为11.2(±4.6)µg/ml。
体重
布罗索尤单抗的清除率和分布容积随体重增加而增加。
注射剂
西林瓶装:30mg(1ml)/瓶;西林瓶装:20mg(1ml)/瓶;西林瓶装:10mg(1ml)/瓶
1 瓶/盒。
2~8℃避光保存和运输,禁冻结,禁剧烈震荡。
24 个月
国药准字SJ20210001,国药准字SJ20210002,国药准字SJ20210003

