华纳大药厂 左奥硝唑片说明书
Levornidazole Tablets
左旋奥硝唑
本品的主要成份为左奥硝唑,其化学名称为:S-(-)-1-(3-氯-2-羟丙基)-2-甲基-5-硝基咪唑。
化学结构式: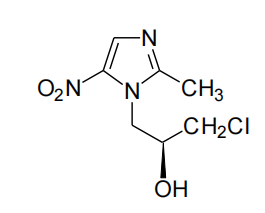
分子式:C7H10ClN3O3
分子量:219.63
本品为白色至微黄色片。
依据左奥硝唑目前完成的临床试验数据,左奥硝唑用于治疗由敏感厌氧菌(脆弱拟杆菌、狄氏拟杆菌、卵园拟杆菌、多形拟杆菌、普通拟杆菌、梭状芽胞杆菌、真杆菌、消化球菌和消化链球菌、幽门螺杆菌、黑色素拟杆菌、梭杆菌、CO2 噬织维菌、牙龈类杆菌等)和泌尿生殖道毛滴虫感染引起的感染性疾病,包括:1、口腔感染:牙周炎、根尖周炎、冠周炎。2、滴虫性阴道炎。
1.治疗厌氧菌感染:口服。成人,一次 1.5g,每晚一次顿服,根据病情连续用药 1-3 天;或者一次 0.5g-1.0g,每 12 小时一次,根据病情连续用药 3-10 天。
2.治疗毛滴虫病:口服。成人,一次 1.5g,每晚一次顿服,根据病情连续用药 1-2 天。
1、临床试验
依据本品(包括左奥硝唑分散片、左奥硝唑片和左奥硝唑胶囊)目前已经完成的临床试验数据(健康人体耐受性试验、药代动力学试验、临床确证性治疗研究)可知:滴虫性阴道炎和口腔厌氧菌感染 A 组(奥硝唑分散片组)共 144 人中有 10人发生不良事件,发生率 6.94%;B 组(左奥硝唑片组)144 人中有 8 人发生不良事件,发生率 5.56%,两组比较 A 组弱高于 B 组,但差异无统计学意义(P>0.05)。A 组 144 人中有 9 人发生不良反应,发生率 6.25%;B 组 144 人中有 7 人发生不良反应,不良反应发生率为 4.86%,两组比较 A 组弱高于 B 组,但差异无统计学意义(P>0.05)。
发生中枢神经系统不良反应及不良事件的 A 组嗜睡 3 例(2.08%)、头晕 2 例 (1.39%)、恶心 1 例(0.69%)。B 组嗜睡 3 例(2.08%)、头晕 2 例(1.39%)、头昏 1 例(0.69%)、恶心 1 例(0.69%)。比较 A、B 两组嗜睡、头晕、头昏、恶心
等不良反应发生率的情况,组间差异均无统计学意义(P>0.05)。所有不良反应及不良事件均未采取措施,治疗结束时都自行缓解。本品临床试验安全性评价其不良反应主要表现为:嗜睡、头痛、头晕、恶心、胃痛及困倦等,但所有不良反应均未采取措施,治疗结束时可自行缓解。
2、本品为奥硝唑的左旋体,下述为文献报道的奥硝唑临床使用时的主要不良反应情况,为安全使用左奥硝唑,请予以注意并参考相关信息:
奥硝唑通常具有良好的耐受性,奥硝唑片的不良反应一般与服用剂量有关,其发生情况如下:
血液和淋巴系统:
偶尔(0.1%<几率为<1%)会引起骨髓抑制和中性粒细胞减少。
免疫系统:
偶尔(0.1%<几率<1%)会引起过敏反应。
神经系统:
罕有(0.01%<几率<0.11%):震颤,僵硬,动作不协调,癫痫发作,意识障碍和敏感型或混合型周围神经病变。
可能会产生头晕或嗜睡等轻微副反应。
胃肠道反应:通常(3%的几率)为恶心、呕吐或有口腔金属异味。
1、本品禁用于用于对左奥硝唑、奥硝唑或其他咪唑类衍生药物过敏者。
2、本品禁用于患有中枢神经系统疾病的患者。
3、本品禁用于癫痫及各种器官硬化症患者。
4、本品禁用于血液恶性疾病或其他血像异常的患者。
1、本品为奥硝唑的左旋体,临床使用时应注意的问题如下:
1)使用过程中,如有异常神经症状反应即停药,并进一步观察治疗。
2)本品为奥硝唑的拆分药物,目前仅完成了治疗抗厌氧菌感染(具体病牙周炎、冠周炎、根尖周炎)和滴虫性阴道炎的临床试验。
3) 本品应餐后服用,若空腹服用,可能会导致胃部不适。
4)本品需放至儿童不能接触到的位置。
2、本品为奥硝唑的左旋体,下述为文献报道的奥硝唑临床使用时应注意的问题,为安全使用左奥硝唑,请予以注意并参考相关信息:
1) 高剂量治疗或治疗时间超过 10 天时,应定时进行实验和临床监测。
2)对于有既往血液病史或重复治疗的患者应检查其治疗前后的白血球数量。
3)对于患有严重中枢神经系统和周围神经系统疾病的患者,采用本品进行治疗时可能导致病情恶化。若出现周围神经病变,运动失调,眩晕或精神错乱等情况,应停止治疗。
4)使用本品进行的治疗可能加重现有的念珠菌感染。如有必要,必须采取相应的治疗措施。
5)血液透析患者,在药物半衰期内需进行检测,血液透析之前或后需适当调节剂量。
6)对接受锂离子治疗的患者,咪唑类药物达到一定浓度时,必须监测锂离子浓度以及肌酐值和电解质水平。
7) 服药期间患者会产生嗜睡、头晕、震颤、僵硬、动作不协调、癫痫发作或短暂的意识障碍等反应。用药前应提醒患者注意,特别是车辆驾驶员和机器操作人员等予以注意。
8)本品影响谷丙转氨酶和谷草转氨酶的测定,测定值通常偏低。
过量服用本品可增加不良反应的发生率或加重不良反应程度。目前尚未发现本品的特效解毒药,但可考虑采用洗胃或血液透析等方法排除体内的左奥硝唑。若出现抽搐,建议静脉注射安定。
本品为奥硝唑的左旋体,目前尚缺乏详细的妊娠期妇女使用本品的安全性数据。 基于妊娠早期(妊娠前三个月)妇女不宜使用奥硝唑,因此,妊娠早期(妊娠前三个月)妇女不宜/建议使用。 对已过了前三个月妊娠期的孕妇需使用左奥硝唑,医生必须慎重考虑使用本品对孕妇的治疗作用以及对胎儿可能造成的不良影响。本品为奥硝唑的左旋体,目前尚缺乏详细的哺乳期妇女使用本品的安全性数据。 基于哺乳期妇女不宜使用奥硝唑,因此,哺乳期妇女不宜/建议使用。目前尚缺乏详细的研究数据。目前尚缺乏详细的研究数据。
本品为奥硝唑的左旋体,目前尚缺乏详细的药物相互作用研究数据。下述为文献报道的奥硝唑的药物相互作用研究结果,为安全使用左奥硝唑,请予以注意并参考相关信息:
奥硝唑与其它硝基咪唑类药物不同,奥硝唑对乙醛脱氢酶无抑制作用,对乙醇耐受。
奥硝唑能加强香豆素化合物类口服抗凝药的抗凝血作用。通过调节所服抗凝血药物的剂量而可两药合用。
奥硝唑可延长维库溴铵的肌肉松弛作用。
苯巴比妥类药和其他酶诱导剂可降低奥硝唑的血浆清除半衰期。
酶抑制剂(如西咪替丁)会提高奥硝唑的血浆清除半衰期。
奥硝唑能抑制抗凝药华法林的代谢,使其半衰期延长,增强抗凝药的药效,当与华法林同用时,应注意观察凝血酶原时间并调整给药剂量。
奥硝唑与呋布西林钠、萘夫西林钠、奥美拉唑、沃必唑、注射用炎琥宁、阿洛西林钠存在配伍禁忌。
湖南华纳大药厂股份有限公司
86904929000731
左奥硝唑为奥硝唑的左旋体,属硝基咪唑类衍生物。奥硝唑抗微生物作用的可能机理是:通过其分子中的硝基,在无氧环境中还原成氨基或通过自由基的形成,与细胞成分相互作用,而导致微生物死亡。
重复给药毒性:大鼠连续3个月灌胃给予左奥硝唑500mg/kg/日,Beagle犬连续3个月给予左奥硝唑50mg/kg/日,均未见对动物的寿命的影响,也未引起严重的功能或形态学改变。
奥硝唑的毒理研究结果如下:
遗传毒性:与其它硝基咪唑类药物类似,奥硝唑对多种菌株具有致突变作用,但是人淋巴细胞和小鼠显性致死试验显示,奥硝唑对哺乳类动物细胞染色体无影响。
生殖毒性:在所进行的大鼠、小鼠和家兔的高剂量研究中,对胎仔和围产期无明显影响。大鼠和小鼠给药剂量达400mg/kg/日,家兔剂量达100mg/kg/日时,未见致畸作用。经口给药可抑制雄性大鼠的生殖能力,但是与其它的5-硝基咪唑化合物不同的是,奥硝唑不抑制精子的生成。目前尚无充分和严格对照的孕妇临床研究资料,由于动物生殖研究并不能完全预测药物对人的影响,只有当确实需要时才可以在妊娠期间使用奥硝唑。
致癌性:大鼠连续2年给药剂量达400mg/kg/日时,未见奥硝唑有致瘤性。
左奥硝唑片、左奥硝唑分散片及左奥硝唑胶囊为左奥硝唑的口服制剂,根据目前已有的研究数据,左奥硝唑片完成了完整的单次及连续给药的健康志愿者人体耐受性研究、单次及连续给药的健康志愿者药代动力学研究饮食对吸收的影响研究、绝对人体生物利用度研究和随机对照临床试验,左奥硝唑分散片剂完成了单次及连续给药的健康志愿者人体耐受性研究、单次及连续给药的健康志愿者药代动力学研究和饮食对吸收的影响研究以及以左奥硝唑片为参比制剂的人体生物等效性研究,胶囊剂完成了以左奥硝唑片为参比制剂的人体生物扥等效性研究。
左奥硝唑健康志愿者耐受性研究表明,左奥硝唑口服制剂总体耐受情况良好,未发现明显异常;生命体征的变化在临床正常值范围内,未见有临床意义;实验室检查结果表明检查值的变化在在临床正常值范围内,未见有临床意义。本品随机对照临床试验为多中心、随机、双盲、阳性药平行对照临床试验,研究目的为评价左奥硝唑片治疗口腔厌氧菌感染性疾病及滴虫性阴道炎的有效
性和安全性。观察对象为口腔厌氧菌感染(牙周炎、牙根尖周炎、冠周炎),需进行抗厌氧菌药物治疗的患者;以及临床症状及病原学检查却真的滴虫性阴道炎患者。
本研究中,临床试验的例数计划为 288 例,每个适应症 144 例,其中试验组144 例(B 组),对照组 144 例(A 组)。左奥硝唑片剂的用法用量:每次 2 片,每日 2 次,口服;口腔厌氧菌感染性疾病疗程为 3~5 天、滴虫性阴道炎疗程为5 天。奥硝唑分散片剂的用法用量:每次 2 片,每日 2 次,口服;口腔厌氧菌感染性疾病疗程为 3~5 天、滴虫性阴道炎疗程为 5 天。
本研究共随机入组受试者 288 例,脱落 14 例(4.86%),剔除 3 例(1.04%)。SAS 和 FAS 数据集均为 288 例,其中 A 组 144 例,B 组 144 例。进入 PPS 样本量共 271 例,A 组 134 例,B 组 137 例。经二次揭盲显示 A 组为:对照组(奥硝唑分散片)、B 组为:试验组(左奥硝唑片)。本研究脱落 14 例病例中,口腔病种 8例,阴道炎病种 6 例;A 组 9 例, B 组 5 例,脱落原因中失访占 9 例,自行停药 2例,以及要求退出、受试者依从性差和不能按规定时间复诊各 1 例。剔除 3 例均为口腔病种,A 组 1 例, B 组 2 例,剔除原因均为 ALT 过高不符合入组条件。
本研究的疗效观察结果为:
滴虫性阴道炎
临床疗效:
FAS 分析结果:144 例滴虫性阴道炎患者经治疗后临床疗效表明,A 组 72 例中痊愈 67 例,无效 5 例,痊愈率 93.06%;B 组 72 例中痊愈 69 例,无效 3 例,痊愈率为 95.83%。两组痊愈率比较差异无统计学意义(P>0.05)。
PPS 分析结果:138 例滴虫性阴道炎患者经治疗后临床综合疗效表明,A 组68 例中痊愈 67 例,无效 1 例,痊愈率 98.53%;B 组 70 例中痊愈 69 例,无效 1例,痊愈率为 98.57%。两组痊愈率比较差异无统计学意义(P>0.05)。
细菌学疗效:
FAS 分析结果:144 例滴虫性阴道炎患者用药后病原学检查表明,A 组 72 例中病原菌清除 67 例,清除率 93.06%;B 组 72 例中病原菌清除 69 例,清除率为95.83%。两组清除率比较差异无统计学意义(P>0.05)。
PPS 分析结果:138 例滴虫性阴道炎患者用药后病原学检查共清除 136 例,其中 A 组 67 例清除,
B 组 69 例清除, 两组清除率比较差异无统计学意义(P>0.05)。
综合疗效:
FAS 数据集:144 例滴虫性阴道炎患者经治疗后 A 组 72 例中痊愈 67 例,无效 5 例,痊愈率 93.06%;B 组 72 例中痊愈 69 例,无效 3 例,痊愈率为 95.83%。
两组痊愈率比较差异无统计学意义(P>0.05)。
PPS 数据集:138 例滴虫性阴道炎患者经治疗后 A 组 68 例中痊愈 67 例,无效 1 例,痊愈率 98.53%;B 组 70 例中痊愈 69 例,无效 1 例,痊愈率为 98.57%。
两组痊愈率比较差异无统计学意义(P>0.05)。
口腔厌氧菌感染
临床疗效:
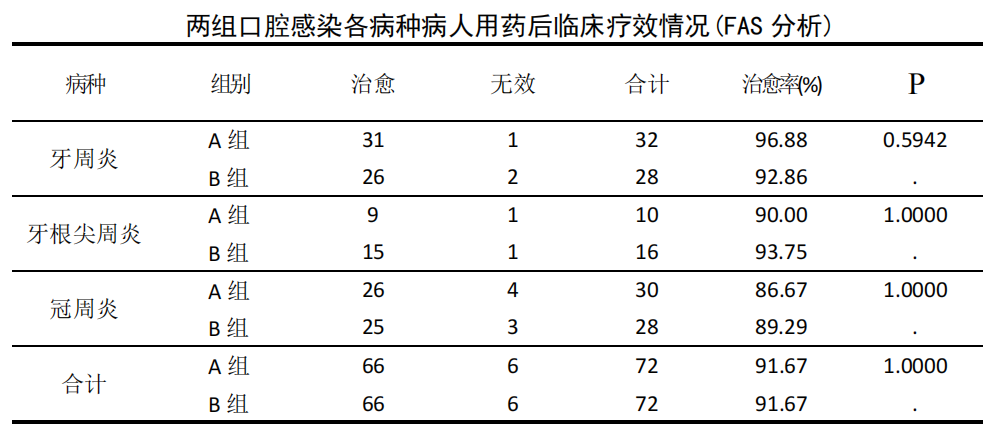
FAS 数据集:144 例口腔厌氧菌感染患者经治疗后临床疗效表明,A 组 72 例中痊愈 66 例,无效 6 例,痊愈率 91.67%;B 组 72 例中痊愈 66 例,无效 6 例,痊愈率为 91.67%。两组痊愈率相同,比较差异无统计学意义(P>0.05)。按病种分类为牙周炎 60 例、牙根尖周炎 26 例、冠周炎 58 例,经治疗后临床疗效表明,各病种两组间治愈率比较差异无统计学意义(P>0.05)。详见下表。
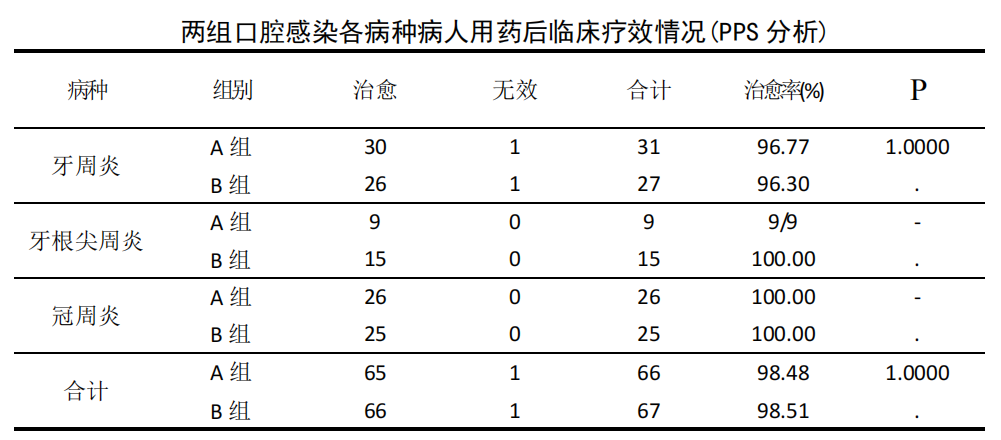
PPS 数据集:133 例口腔感染患者经治疗后临床疗效表明,A 组 66 例中痊愈65 例,无效 1 例,痊愈率 98.48%;B 组 67 例中痊愈 66 例,无效 1 例,痊愈率为 98.51%。两组痊愈率比较差异无统计学意义(P>0.05)。按病种分类为牙周炎 58例、牙根尖周炎 24 例、冠周炎 51 例,经治疗后临床疗效表明,各病种两组间治愈率比较差异无统计学意义(P>0.05),详见下表。
细菌学疗效:
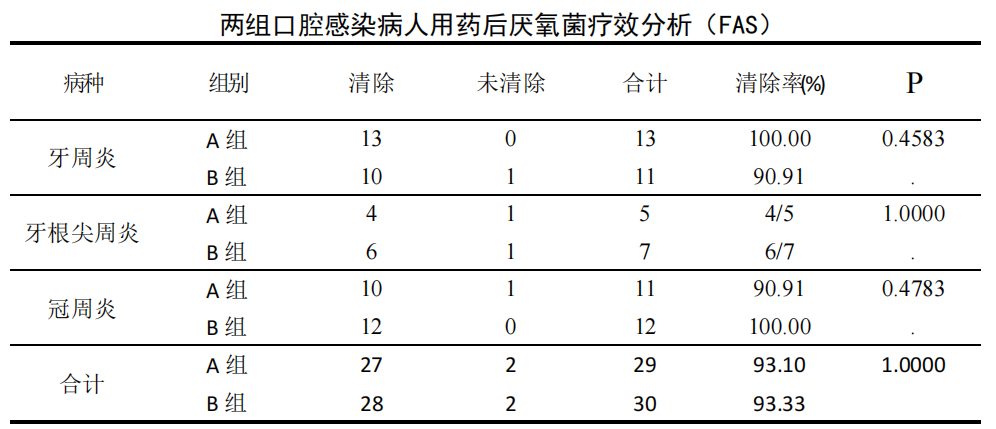
FAS 数据集:59 例治疗前口腔感染厌氧菌培养阳性患者中牙周炎 24 例、牙根尖周炎 12 例、冠周炎 23 例。治疗后 A 组 30 例厌氧菌在用药后清除 28 例,清除率 93.10%;B 组 30 例厌氧菌在用药后清除 28 例,清除率为 93.33%,各病种 A、B 组间细菌清除率比较差异无统计学意义(P>0.05)。
PPS 数据集:56 例治疗前口腔感染厌氧菌培养阳性患者中牙周炎 23 例、牙根尖周炎 11 例、冠周炎 22 例。治疗后 A 组 27 例厌氧菌在用药后清除 27 例,清除率 100%;B 组 29 例厌氧菌在用药后清除 28 例,清除率为 96.55%,各病种 A、B 组间细菌清除率比较差异无统计学意义(P>0.05)。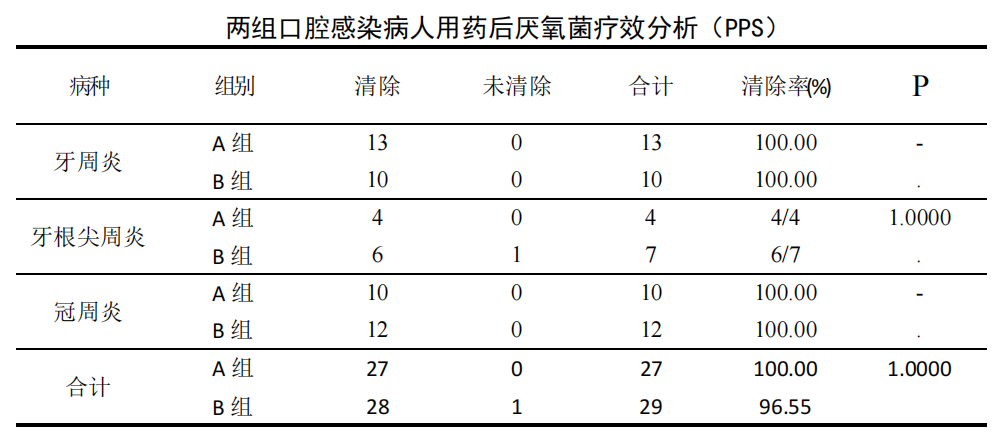
综合疗效:
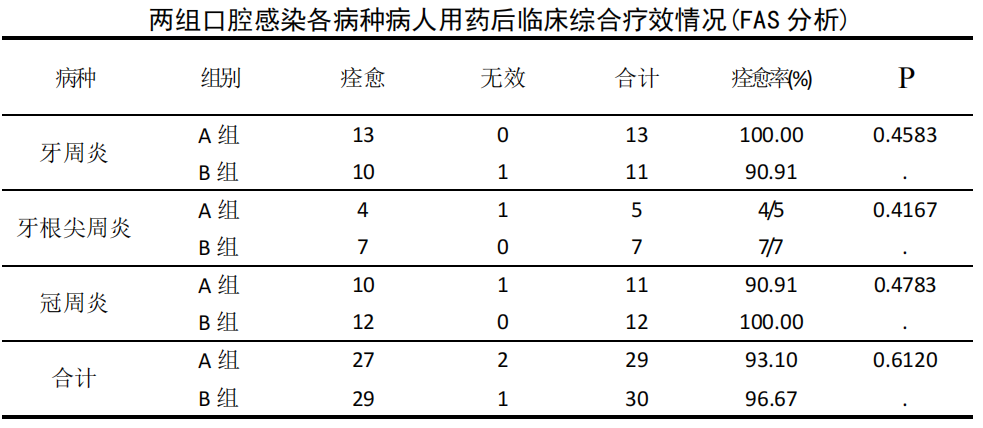
FAS 数据集:59 例治疗前口腔厌氧菌培养阳性患者中经治疗后临床综合疗效表明,A 组 29 例中痊愈 27 例,2 例无效,痊愈率 93.10%;B 组 30 例中痊愈 29例,1 例无效,痊愈率为 96.67%。两组痊愈率比较差异无统计学意义(P>0.05)。
按病种分类分别为牙周炎 24 例、牙根尖周炎 12 例、冠周炎 23 例,经治疗后各
病种两组痊愈率比较差异无统计学意义(P>0.05)。
PPS 数据集:56 例治疗前口腔厌氧菌培养阳性患者中经治疗后临床疗综合效表明,A 组 27 例中痊愈 27 例,痊愈率 100%;B 组 29 例中痊愈 29 例,痊愈率为 100%。两组痊愈率比较差异无统计学意义(P>0.05)。按病种分类分别为牙周炎23 例、牙根尖周炎 11 例、冠周炎 22 例,经治疗后各病种两组痊愈率比较差异无统计学意义(P>0.05)。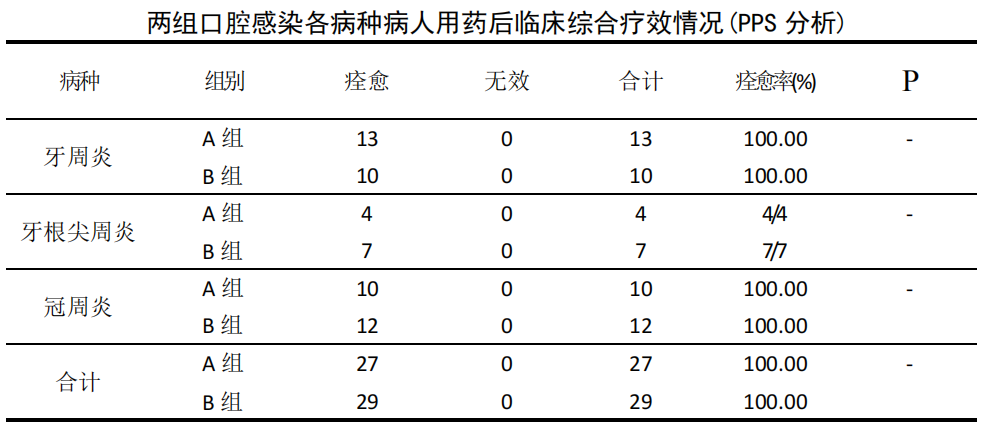
本研究的不良事件与不良反应情况:
滴虫性阴道炎和口腔厌氧菌感染 A 组共 144 人中有 10 人发生不良事件,发生率 6.94%;B 组 144 人中有 8 人发生不良事件,发生率 5.56%,两组比较 A 组弱高于 B 组,但差异无统计学意义(P>0.05)。A 组 144 人中有 9 人发生不良反应,发生率 6.25%;B 组 144 人中有 7 人发生不良反应,不良反应发生率为 4.86%,两组比较 A 组弱高于 B 组,但差异无统计学意义(P>0.05)。
发生中枢神经系统不良反应及不良事件的 A 组嗜睡 3 例(2.08%)、头晕 2 例(1.39%)、恶心 1 例(0.69%)。B 组嗜睡 3 例(2.08%)、头晕 2 例(1.39%)、头昏 1 例(0.69%)、恶心 1 例(0.69%)。比较 A、B 两组嗜睡、头晕、头昏、恶心等不良反应发生率的情况,组间差异均无统计学意义(P>0.05)。所有不良反应及不良事件均未采取措施,治疗结束时都自行缓解。
1、药代动力学研究
单次给药药物动力学试验:单次给药药动学试验采用3×3拉丁方随机交叉试验设计,12名健康受试者,男女各半,随机分为6组,每组2人,男女各1人。按照试验设计分别接受不同剂量的药物,剂量设定为250、500、1000 mg,周期间洗脱时间为7天。采用二室模型、权重1/c,对数据进行参数求算,各剂量组的平均药物动力学参数分别见表1: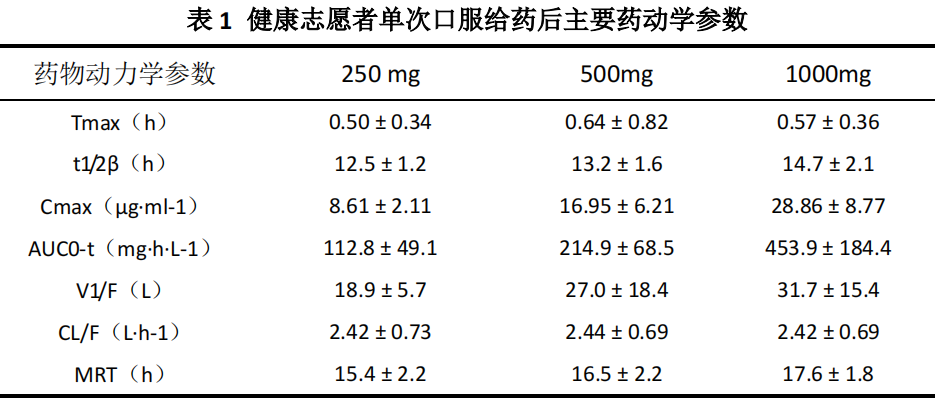
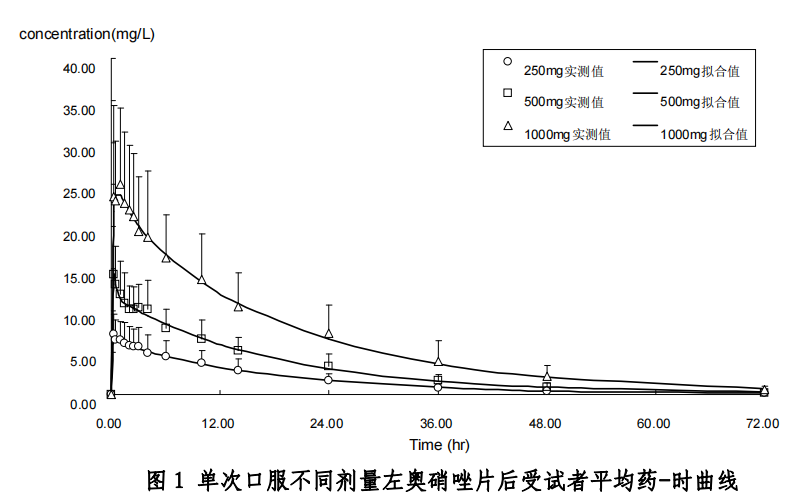
连续多次给药药动学:完成单次给药动学研究后,洗脱 7 天,所有受试者参与连续多次给药药动学试验。给药方法为每天给药 2 次,每次 500 mg,连续给药 5 天。采用二室模型、权重 1/c,对数据进行参数求算,平均药物动力学参数见表 2: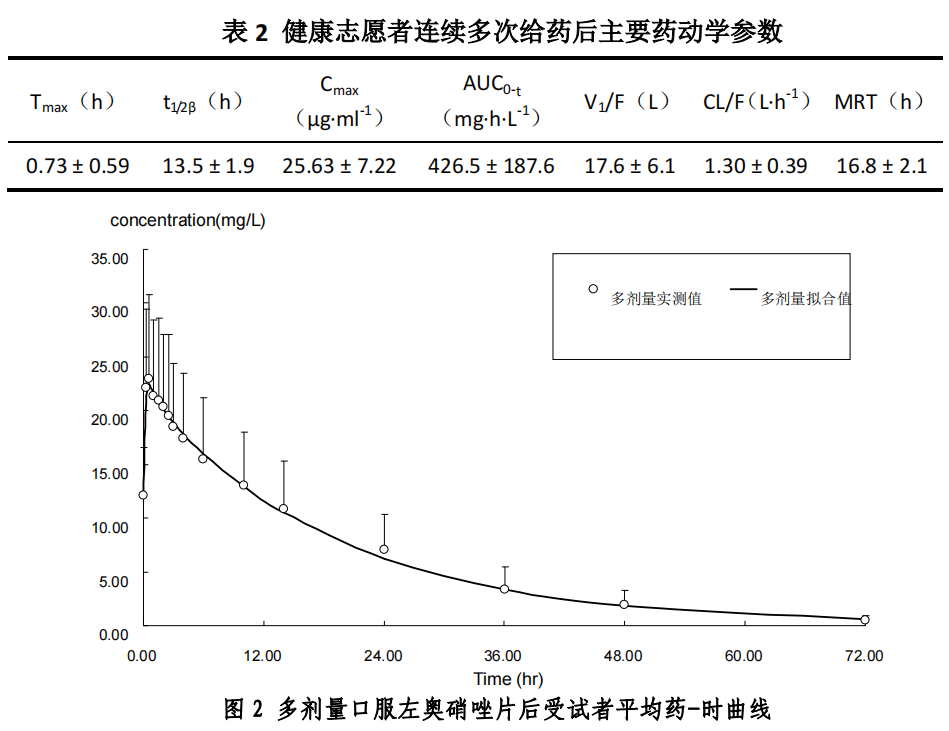
进食对药动学影响:采用开放、随机、自身交叉试验设计,筛选 12 位健康受试者,男女各半,每组 6 人,男女各 3 人,分为进食组和空腹组,交叉服药,周期间洗脱时间为 7 天。采用二室模型、权重 1/c,对数据进行参数求算。进食组与空腹组的平均药物动力学参数见表 3: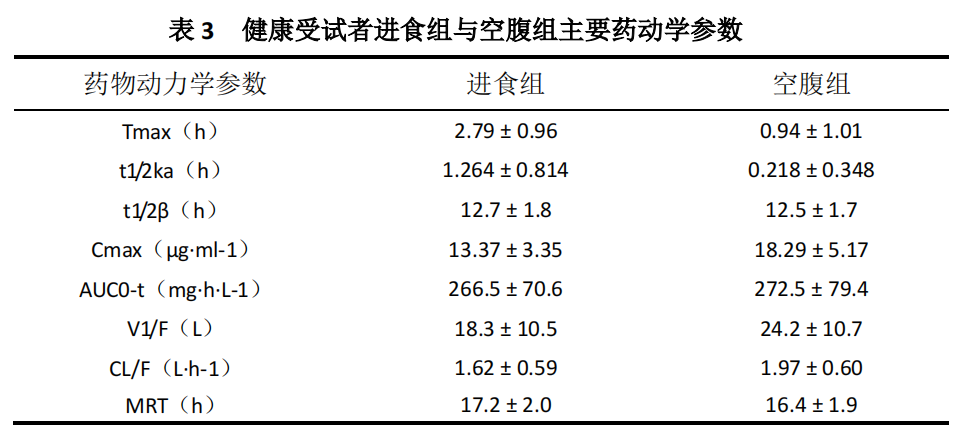
以上结果显示:本品与高脂、高蛋白食物同时服用时可降低人体对药物的吸收速度,延长达峰时间;药物的峰浓度略有降低,但药物的吸收总量无明显变化。即食物影响药物的吸收速度但不影响吸收程度。
2、生物利用度研究
左奥硝唑片剂、左奥硝唑片剂和左奥硝唑胶囊剂的人体生物等效性研究采用随机、开放、三周期交叉、单次口服给药的试验设计,三周期间的清洗期均为 7天。共入组 24 名健康男性志愿者,采用液相色谱法测受试者定口服左奥硝唑分散片和左奥硝唑胶囊与参比制剂后血浆样品中左奥硝唑的浓度,以塞克硝唑为内标。采用 DAS2.1 计算药代参数和统计分析,主要药代动力学参数 Cmax、Tmax、T1/2、AUC0-48、AUC0-∞如下: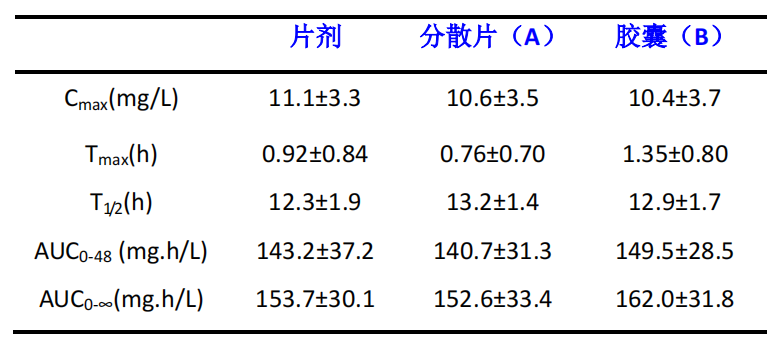
以 AUC0-48 计算,左奥硝唑分散片和左奥硝唑胶囊相对于左奥硝唑片的相对生物利用度分别为 98.3±12.0%和 104.4±9.5%。将左奥硝唑分散片和左奥硝唑胶囊 AUC0-48、AUC0-∞及实测的 Cmax 作双单侧 t 检验和置信区间法的检验,结果显示,左奥硝唑分散片和左奥硝唑胶囊和左奥硝唑片 AUC0-48 和 AUC0-∞ 90%可信区间均未超出参比制剂的 80-125%的范围;且 Cmax 的 90%可信区间也未超出参比制剂的 80-125%范围内。Tmax 经非参数检验,不同制剂间无显著性差异。
左奥硝唑片剂与左奥硝唑氯化钠注射液的人体绝对生物利用度研究采用随机、两周期、自身交叉试验设计,共入组 12 名健康志愿者,男女各半,分析方法同前。研究结果如下: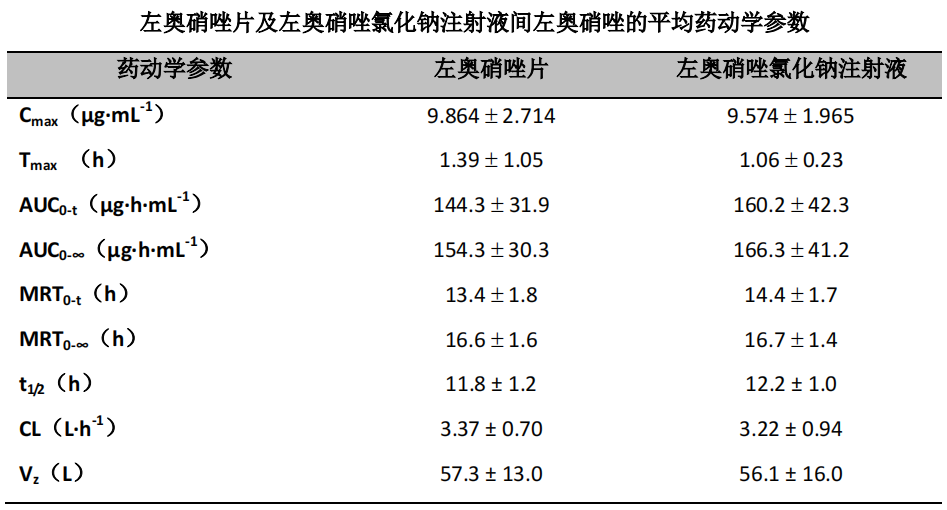
根据 AUC0-t 计算,受试制剂的绝对生物利用度为 93.2 ±14.1%。对受试者接受受试制剂(左奥硝唑片)和参比制剂(左奥硝唑氯化钠注射液)后的药代动力学主要参数,Cmax 和 AUC0-t经对数转换后进行方差分析,并进一步借鉴生物等效性方法(采用双单侧 t 检验和 90%置信区间法)进行评价。受试制剂与参比制剂Cmax、AUC0-t的几何均值比值 90%置信区间分别为 89.3%~114.9%、84.3%~98.3%。
片剂
0.25g
铝塑复合包装:12 片/板×1 板/盒,12 片/板×2 板/盒。
遮光,密闭保存。
24 个月
国药准字H20170018

