择捷美®(Cejemly ®)说明书
Sugemalimab Injection
舒格利单抗
活性成份:舒格利单抗(全人源抗程序性死亡配体-1单克隆抗体)。
辅料:组氨酸、盐酸组氨酸、甘露醇、氯化钠(供注射用)、聚山梨酯80(II),注射用水。
无色或淡黄色澄明液体,可带轻微乳光
本品联合培美曲塞和卡铂用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的转移性非鳞状非小细胞肺癌(NSCLC)患者的一线治疗;本品联合紫杉醇和卡铂用于转移性鳞状非小细胞肺癌(NSCLC)患者的一线治疗。
本品须在有肿瘤治疗经验的医生指导下用药。
推荐剂量
本品推荐剂量为1200 mg/次,静脉输注每3周给药1次,每次输注时间为60分钟或以上,直至出现疾病进展或产生不可耐受的毒性。
根据个体患者的安全性和耐受性,可能需要暂停给药或永久停药。不建议增加或减少剂量。有关暂停给药和永久停药的指南,请见表1所述。有关免疫相关不良反应管理的详细指南,请参见【注意事项】。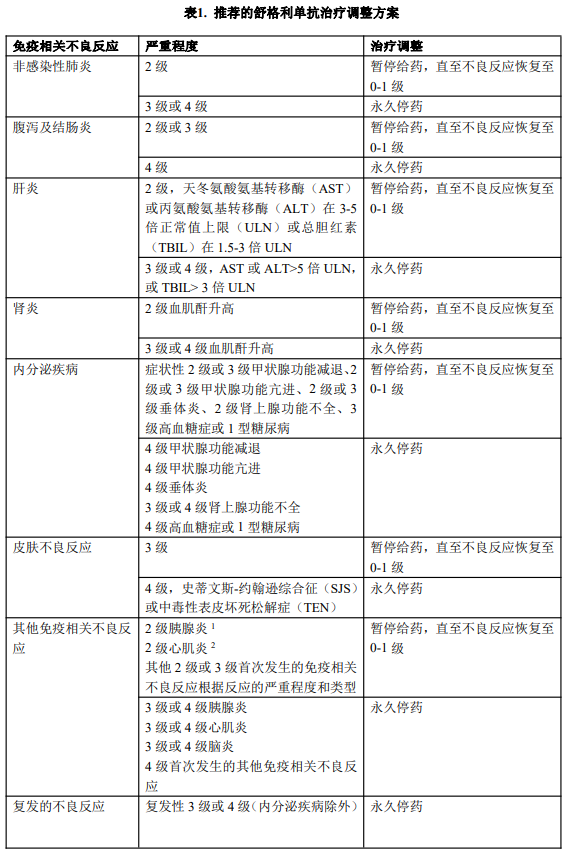
特殊人群
肝功能不全
目前本品尚无针对中重度肝功能不全患者的研究数据,中度或重度肝功能不全患者不推荐使用。
轻度肝功能不全患者应在医生指导下慎用本品,基于群体药代动力学结果(参见【临床药理学】),如需使用,无需进行剂量调整。
肾功能不全
目前本品尚无针对中重度肾功能不全患者的研究数据,中度或重度肾功能不全患者不推荐使用。
轻度肾功能不全患者应在医生指导下慎用本品,基于群体药代动力学结果(参见【临床药理学】),如需使用,无需进行剂量调整。
儿童人群
本品尚无在18岁以下儿童及青少年中的安全性和有效性数据。
老年人群
老年患者(≥65岁)建议在医生的指导下慎用,基于群体药代动力学结果(参见【临床药理学】),如需使用,无需进行剂量调整。
给药方法
本品应该由专业卫生人员采用无菌技术稀释后才可输注。本品须采用静脉输注的方式给药,输注应在60分钟或以上完成。
使用、处理、处置的特殊说明:
• 不能采用静脉内推注或快速注射(Bolus)。
• 药物配置前确保药物溶液是澄清、透明、无肉眼可见微粒。
• 以注射器抽取舒格利单抗注射液,注射液体积一共 40 mL(20 mL/瓶:2 瓶)。注入至 250mL 生理盐水(0.9%氯化钠溶液)静脉输液袋中。
• 混合时轻轻颠倒混匀,禁止震摇。
• 输注应在 60 分钟或以上完成,若出现输液反应,则输液时长可适当延长。不得使用同一输注静脉置管同时输注其他药物。
• 建议药物应在配制完成后立即给予患者,以避免配制好的药物暴露于室温超过推荐的 6小时限制。其中,6 小时的时间限制包括药物室温贮存、静脉输液袋中输注液贮存和输注持续时间。如果需要推迟使用配制好的药物,则可将其置于 2~8°C 冰箱中,不超过 24 小时。
本说明书描述了在临床研究中观察到的判断为可能与舒格利单抗相关的不良反应及其近似的发生率。由于临床研究是在不同条件下进行的,不同临床研究中观察到的不良反应的发生率不能直接比较,也可能不能反映临床实践中的实际发生率。
安全性特征总结
舒格利单抗的安全性数据来自于5项临床研究共计540例接受舒格利单抗单药治疗及联合含铂化疗治疗的患者。其中单药治疗临床研究为4项,共计220例患者,包括:CS1001-101(N=89)、CS1001-102(N=12)、CS1001-201(N=38)、CS1001-202(N=81)。纳入研究的肿瘤类型包括:经典型霍奇金淋巴瘤(N=85),NK/T细胞淋巴瘤(N=42),胆管癌或胆囊癌(N=31),高度微卫星不稳定(MSI-H)或错配修复基因缺失(dMMR)表型的肿瘤(N=21),肝细胞癌(N=19),肠癌(N=6),卵巢癌(N=2),胃肠道间叶源性肿瘤(N=2),浸润性导管癌(N=2),肉瘤(N=2),胃癌、食管癌、宫颈癌、前列腺癌、鼻咽癌、阑尾粘液腺癌、食管恶性黑色素瘤、回肠原始神经外胚瘤各1例。舒格利单抗联合含铂化疗治疗的临床研究1项:CS1001-302,为非小细胞肺癌患者(N=320)。上述研究中540例患者接受的舒格利单抗用药均为1200 mg固定剂量每3周一次。
接受舒格利单抗单药治疗的220例患者中所有级别的不良反应发生率为78.6%,最常见(发生率≥10%)的不良反应包括:发热、丙氨酸氨基转移酶升高、天门冬氨酸氨基转移酶升高、贫血、甲状腺功能减退症、蛋白尿。3 级及以上不良反应发生率为14.5%,其中发生率≥1%的包括:贫血、甲状腺功能减退症、低钠血症。
接受舒格利单抗联合含铂化疗的320例患者中所有级别的不良反应发生率为79.1%,最常见(发生率≥10%)的不良反应包括:天门冬氨酸氨基转移酶升高、皮疹、骨骼肌肉疼痛、腹痛、低钠血症、疲乏、高血糖症。3级及以上不良反应发生率为12.8%,其中发生率≥1%的包括:低钠血症、高甘油三酯血症、肝功能异常和糖尿病。
临床研究中的不良反应
CS1001-302: 舒格利单抗联合含铂化疗用于一线晚期非小细胞肺癌患者的随机双盲研究
CS1001-302研究是一项比较舒格利单抗联合含铂化疗与安慰剂联合含铂化疗在一线晚期非小细胞肺癌患者中的疗效与安全性的多中心、随机对照、双盲的III期注册临床研究。研究共入组479例患者,按照2:1的比例随机分组:其中有320例患者接受了4个周期的1200 mg舒格利单抗与含铂化疗每3周1次的联合治疗,后继续接受1200 mg舒格利单抗每3周1次给药的维持治疗,159例患者接受了4个周期的安慰剂与含铂化疗每3周1次的联合治疗,后继续接受安慰剂每3周1次给药的维持治疗。对于接受培美曲塞治疗的患者,允许患者在维持治疗期接受培美曲塞联合舒格利单抗/安慰剂的维持治疗。舒格利单抗的中位持续时间为5.95个月(范围:0.2-17.4月)。舒格利单抗联合化疗组有77.8%的患者完成4个周期的含铂化疗治疗。
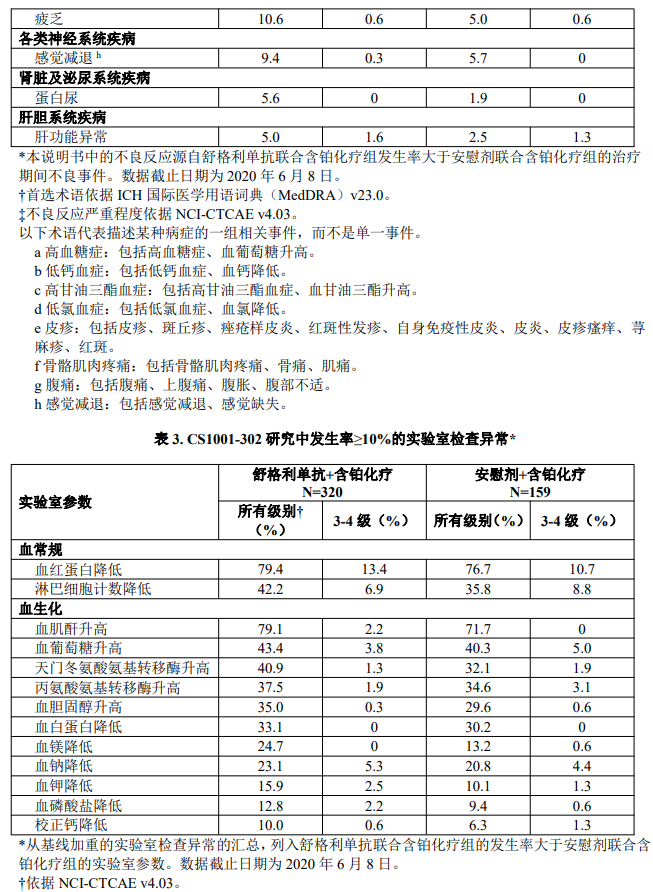
该研究中,接受舒格利单抗联合含铂化疗的患者中不良反应(发生率≥5%)汇总见表2,实验室检查异常(发生率≥10%)见表3。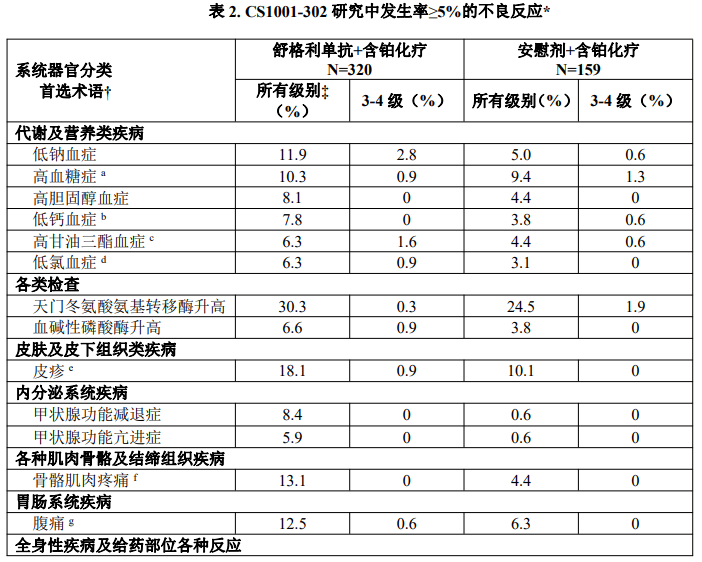
特定不良反应描述
本品的特定不良反应来自于上述的5项临床研究共计540例患者的免疫相关不良反应数据。免疫相关不良反应管理指南详见【注意事项】。 免疫相关性内分泌疾病
甲状腺功能减退
接受舒格利单药治疗的220例患者中,总计30例(13.6%)患者发生了免疫相关性甲状腺功能减退,其中1级为22例(10.0%),2级为5例(2.3%),3级为3例(1.4%)。至首例事件发生的中位时间为83.5天(范围:11-500天),中位持续时间尚未达到(范围:8-490天)。1例(0.5%)患者终止治疗,3例(1.4%)患者暂停给药。10例患者接受甲状腺激素替代治疗。30例患者中,6例患者病情已恢复。
接受舒格利单抗联合含铂化疗的320例患者中,总计25例(7.8%)患者发生了免疫相关性甲状腺功能减退,1级为15例(4.7%),2级为10例(3.1%)。至首例事件发生的中位时间为91.0天(范围:19-214天),中位持续时间为143.0天(范围:7-336天)。4例(1.3%)患者暂停给药。25例患者中,有16例患者接受了甲状腺激素替代治疗。总计有6例患者的病情已恢复,10例患者病情缓解。
甲状腺功能亢进
接受舒格利单药治疗的220例患者中,总计15例(6.8%)患者发生了免疫相关性甲状腺功能亢进。
其中1级为13例(5.9%),2级为1例(0.5%),3级为1例(0.5%)。至首例事件发生的中位时间为63.0天(范围:11-750天),中位持续时间为44.0天(范围:10-456天)。1例(0.5%)患者暂停给药。15例患者中,10例患者病情已恢复。
接受舒格利单抗联合含铂化疗的320例患者中,总计18例(5.6%)患者发生了免疫相关性甲状腺功能亢进,1级为17例(5.3%),2级为1例(0.3%)。至首例事件发生的中位时间为48.0天(范围:41-240天),中位持续时间为44.0天(范围:7-233天)。18例患者中,有3例患者接受了抗甲状腺药物治疗。总计14例患者的病情已恢复,2例患者病情缓解。
甲状腺炎
接受舒格利单药治疗的220例患者中,总计4例(1.8%)患者发生了免疫相关性甲状腺炎,均为1级。至首例事件发生的中位时间为63.0天(范围:40-176天),中位持续时间尚未达到(范围:22-344天)。2例患者接受甲状腺激素替代治疗。4例患者中,2例患者病情已恢复。
接受舒格利单抗联合含铂化疗的320例患者中,总计2例(0.6%)患者发生了免疫相关性甲状腺炎,均为1级。至首例事件发生的中位时间为133.0天(范围:99-167天),中位持续时间未达到(范围:117-204天)。1例发生了免疫介导性甲状腺炎的患者在接受甲状腺治疗后,病情缓解,另1例发生了抗甲状腺抗体阳性的患者未接受甲状腺治疗,病情尚未缓解。
垂体炎
接受舒格利单药治疗的220例患者中,总计2例(0.9%)患者报告了免疫相关性垂体炎,均为1级。至首例事件发生的中位时间为168.0天(范围:42-294天),2例患者的垂体炎持续时间均为22.0天。无患者接受系统性皮质类固醇治疗,2例患者均已恢复。
接受舒格利单抗联合含铂化疗的 320 例患者中,未发生免疫相关性垂体炎。
糖尿病
接受舒格利单药治疗的220例患者中,总计2例(0.9%)患者发生了免疫相关性糖尿病,1级和2级各1例(0.5%)。至首例事件发生的中位时间为268.5天(范围:126-411天),中位持续时间尚未达到(范围:30-367天)。2例患者中,1例患者病情缓解。
接受舒格利单抗联合含铂化疗的320例患者中,总计2例(0.6%)患者发生了免疫相关性糖尿病,均为1级。至首例事件发生的中位时间为33.5天(范围:23-44天),中位持续时间为32.0天(范围:5-44天)。2例患者均未接受降糖药物治疗。1例患者的病情已恢复。 免疫相关性皮肤不良反应
非严重皮肤不良反应
接受舒格利单药治疗的220例患者中,总计8例(3.6%)患者发生了免疫相关性非严重皮肤不良反应。其中1级为5例(2.3%),2级为3例(1.4%)。至首例事件发生的中位时间为46.5天(范围:7-358天),中位持续时间为273.0天(范围:77-476天)。无患者接受系统性皮质类固醇治疗。8例患者中,5例患者病情已恢复。
接受舒格利单抗联合含铂化疗的320例患者中,总计14例(4.4%)患者发生了免疫相关性非严重皮肤不良反应,1级为8例(2.5%),2级为6例(1.9%)。至首例事件发生的中位时间为21.0天(范围:6-284天),中位持续时间为12.0天(范围:4-113天)。2例(0.6%)患者暂停给药。6例患者接受了全身皮质类固醇治疗,1例患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。
14例患者中,12例患者的病情已恢复,1例患者病情缓解。
严重皮肤不良反应
接受舒格利单药治疗的220例患者中,总计1例(0.5%)患者发生了免疫相关性严重皮肤不良反应。该患者于3天和29天分别出现3级瘙痒症和3级斑丘疹,并分别持续了342和316天。该患者因严重皮肤不良反应(瘙痒症)而导致暂停给药,未因严重皮肤不良反应接受系统性皮质类固醇治疗。该患者瘙痒症和斑丘疹尚未缓解。
接受舒格利单抗联合含铂化疗的320例患者中,总计2例(0.6%)患者发生了免疫相关性严重皮肤不良反应(首选术语 PT:皮疹),均为3级事件。至首例事件发生的中位时间为38.5天(范围:19-58天),中位持续时间为19.0天(范围:12-26天)。2例(0.6%)患者均因严重皮肤不良反应而暂停给药。2例患者中,有1例患者接受了全身皮质类固醇治疗。2例患者病情均已恢复。 免疫相关性肝炎
接受舒格利单药治疗的220例患者中,总计4例(1.8%)患者发生了免疫相关性肝炎。其中2级为1例(0.5%),3级为3例(1.4%)。至首例事件发生的中位时间为98.5天(范围:22-190天),中位持续时间尚未达到(范围:38-331天)。1例(0.5%)患者终止治疗,1例(0.5%)患者暂停给药。2例患者接受了高剂量(每天≥40 mg强的松等效剂量)系统性皮质类固醇治疗。4例患者中,1例患者病情已恢复,1例患者病情缓解。
接受舒格利单抗联合含铂化疗的320例患者中,总计5例(1.6%)患者发生了免疫相关性肝炎,3级为4例(1.3%),4级为1例(0.3%)。至首例事件发生的中位时间为106.0天(范围:18-127天),中位持续时间未达到(范围:5-260天)。3例(0.9%)患者终止治疗,2例(0.6%)患者暂停给药。
5例患者均接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。5例患者中,4例患者病情缓解。 免疫相关性肺炎
接受舒格利单药治疗的220例患者中,总计3例(1.4%)患者报告了免疫相关性肺炎。其中2级为1例(0.5%),3级为2例(0.9%)。至首例事件发生的中位时间为126.0天(范围:72-342天),中位持续时间尚未达到(范围:2-511天)。1例(0.5%)患者终止治疗,1例(0.5%)患者暂停给药。2例患者接受了高剂量(每天≥40 mg强的松等效剂量)系统性皮质类固醇治疗。3例患者中,1例患者病情缓解。
接受舒格利单抗联合含铂化疗的320例患者中,总计4例(1.3%)患者发生了免疫相关性肺炎,2级为2例(0.6%),3级为1例(0.3%),5级为1例(0.3%)。至首例事件发生的中位时间为84.5天(范围:78-165天),中位持续时间为113.0天(范围:18-122天)。3例(0.9%)患者终止治疗,2例(0.6%)患者暂停给药。4例患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗。其中2例患者病情已恢复,1例患者病情缓解。 其它发生率<1%的免疫相关不良反应总结如下:
免疫相关性胰腺炎
接受舒格利单药治疗的220例患者中,未发生免疫相关性胰腺炎。
接受舒格利单抗联合含铂化疗的320例患者中,总计1例(0.3%)患者发生了免疫相关性胰腺炎。
该患者发生的免疫相关性胰腺炎以PT划分为脂肪酶升高(4级)和淀粉酶升高(3级)。该患者于第148天出现了脂肪酶升高和淀粉酶升高,并因此暂停给药。该患者未接受皮质类固醇治疗。脂肪酶升高的事件降为1级,淀粉酶升高已恢复,事件持续时间为32天。
免疫相关性肌炎
接受舒格利单药治疗的220例患者中,总计2例(0.9%)患者发生了免疫相关性肌炎。1例(0.5%)为1级,1例(0.5%)为4级。至首例事件发生的中位时间为42.5天(范围:21-64天),中位持续时间尚未达到(范围:57-392天)。2例(0.9%)患者均因免疫相关性肌炎终止治疗,且接受了高剂量(每天≥40 mg强的松等效剂量)系统性皮质类固醇治疗。2例患者中,1例病情已恢复,1例尚未缓解。
接受舒格利单抗联合含铂化疗的320例患者中,未发生免疫相关性肌炎。 免疫相关性全血细胞减少症/双系血细胞减少症
接受舒格利单药治疗的220例患者中,总计2例(0.9%)患者报告了免疫相关性全血细胞减少症/双系血细胞减少症。1例为3级的全血细胞减少症,1例为4级的自身免疫全血细胞减少症。至首例事件发生的中位时间为109.5天(范围:106-113天),中位持续时间尚未达到(范围:57-239天)。1例(0.5%)患者因全血细胞减少症而终止治疗。2例患者均未接受系统性皮质类固醇治疗,2例患者均尚未缓解。
接受舒格利单抗联合含铂化疗的320例患者中,未发生免疫相关性全血细胞减少症/双系血细胞减少症。 免疫相关性肾炎
接受舒格利单药治疗的220例患者中,未发生免疫相关性肾炎。
接受舒格利单抗联合含铂化疗的320例患者中,总计1例(0.3%)患者发生了免疫相关性肾炎(PT:急性肾损伤),为3级事件。至急性肾损伤发生的时间为241天,持续时间为72天。该患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗,病情已恢复。 免疫相关性溶血性贫血接受舒格利单药治疗的220例患者中,总计1例(0.5%)患者发生了免疫相关性溶血性贫血,为4级事件。至溶血性贫血发生的时间为45天,该事件的持续时间为49天。该患者未终止治疗或暂停给药。该患者未接受系统性皮质类固醇治疗,病情已恢复。
接受舒格利单抗联合含铂化疗的320例患者中,未发生免疫相关性溶血性贫血。 免疫相关性心肌炎
接受舒格利单药治疗的220例患者中,总计1例(0.5%)患者发生了免疫相关性心肌炎,为2级事件。至事件发生的时间197天,已持续缓解112天。患者因心肌炎而终止治疗,并接受了高剂量(每天≥40 mg强的松等效剂量)系统性皮质类固醇治疗。该例患者病情缓解。
接受舒格利单抗联合含铂化疗的320例患者中,总计1例(0.3%)患者发生了免疫相关性心肌炎,为2级事件。至事件发生的时间为63天,并因该事件暂停给药。该患者接受了高剂量(每天≥40 mg强的松等效剂量)皮质类固醇治疗,已降为1级。 免疫相关性关节炎
接受舒格利单药治疗的220例患者中,未报告免疫相关性关节炎。
接受舒格利单抗联合含铂化疗的320例患者中,总计1例(0.3%)患者发生了免疫相关性关节炎,为2级事件。至免疫介导性关节炎发生的时间为140天。该患者因该事件暂停用药。该患者接受了全身皮质类固醇治疗,病情缓解。 输液相关反应
在接受舒格利单药治疗的220例患者中,总计15例(6.8%)患者报告了输液相关反应。在接受舒格利联合含铂化疗的320例患者中,总计14例(4.4%)患者报告了输液相关反应,安慰剂联合含铂化疗的159例患者中,总计有8例(5.0%)患者报告了输液相关反应。 免疫原性所有治疗用蛋白质均有发生免疫原性的可能。抗药物抗体(ADA)发生率的高低和检测方法的灵敏性及特异性密切相关,并且受多种因素的影响,包括分析方法、样本的处理方法、样本的收集时间、合并用药,以及患者的其他基础疾病等。因此比较不同产品的ADA发生率时应慎重。III期NSCLC研究共收集免疫原性样品1471个(患者309例)。在该项研究中与舒格利单抗相关的ADA阳性患者28例(9%),其中出现药物诱导的阳性患者26例(8.4%),药物增强的阳性患者2例(0.6%);药物不相关阳性患者25例(8.1%)。对所有药物相关/不相关ADA阳性样本进行中和抗体(NAb)检测,其中中和抗体阳性患者5例(1.6%),4例(1.3%)来自药物相关ADA阳性患者,1例(0.3%)来自药物不相关ADA阳性患者。基于现有数据,ADA未显示出对本品药代动力学特性造成显著影响,亦未显示出对安全性和有效性的影响。
对【成份】所列的活性成份或任何辅料存在超敏反应的患者。
免疫相关不良反应
接受本品治疗的患者可发生免疫相关不良反应,包括严重和致死病例。免疫相关不良反应可发生在本品治疗期间及停药以后,可能累及任何组织器官。
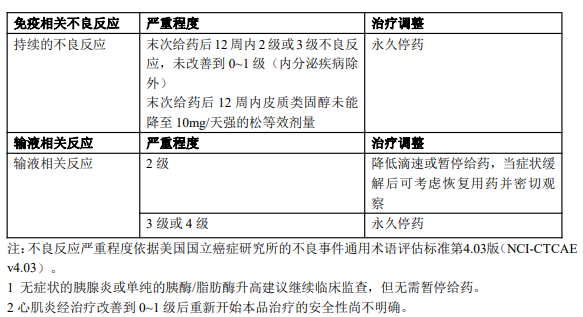
对于疑似免疫相关不良反应,应进行充分的评估以确定病因或排除其他病因。大多数免疫相关不良反应是可逆的,并且可通过中断本品治疗、给予皮质类固醇治疗和/或支持治疗来处理。整体而言,对于大部分2级以及某些特定的3级和4级免疫相关不良反应需暂停给药。对于4级及某些特定的3级免疫相关不良反应需永久停药(参见【用法用量】)。对于3级和4级及某些特定的2级免疫相关不良反应,根据临床指征,给予1~2mg/kg/天强的松等效剂量及其他治疗,直至改善到≤1级。皮质类固醇需至少一个月的时间逐渐减量直至停药,快速减量可能引起不良反应恶化或复发。如果不良反应在皮质类固醇治疗后继续恶化或无改善,则应增加非皮质类固醇类别的免疫抑制剂治疗。
本品给药后任何复发性3级或4级免疫相关不良反应(内分泌疾病除外),末次给药后12周内2级或3级免疫相关不良反应未改善到0~1级(内分泌疾病除外),以及末次给药后12周内皮质类固醇未能降至≤10mg/天强的松等效剂量,应永久停药。 免疫相关性内分泌疾病
甲状腺疾病
在接受本品治疗的患者中有甲状腺功能紊乱的报告,包括甲状腺功能亢进,甲状腺功能减退,甲状腺炎(参见【不良反应】)。应密切监测患者甲状腺功能的变化及相应的症状和体征。对于症状性2级或3级甲状腺功能减退,应暂停本品治疗,并根据需要开始甲状腺激素替代治疗。对于症状性2级或3级甲状腺功能亢进,应暂停本品治疗,并根据需要给予β-受体阻滞剂或糖皮质激素治疗。
如果怀疑有甲状腺急性炎症,可考虑暂停本品治疗并给予皮质类固醇治疗。当甲状腺功能减退或甲状腺功能亢进的症状改善及甲状腺功能检查恢复,可根据临床需要重新开始本品治疗。对于4级甲状腺功能亢进或甲状腺功能减退,须永久停止本品治疗。应持续监测甲状腺功能,确保恰当的治疗。
垂体炎
接受本品治疗的患者报告了垂体炎(参见【不良反应】)。应对垂体炎患者的症状和体征进行监测(包括垂体功能减退和继发性肾上腺功能不全),并排除其他病因。监测和评估垂体相关的激素水平,必要时进行功能试验,考虑垂体MRI检查和自身免疫性抗体检查。发生症状性2级或3级垂体炎时应暂停本品治疗,并根据临床需要给予激素替代治疗。如果怀疑急性垂体炎,可给予皮质类固醇治疗。发生4级垂体炎时须永久停止本品治疗。应持续监测垂体功能、肾上腺功能和激素水平,根据临床指征给予皮质类固醇和其他激素替代疗法(参见【用法用量】)。
糖尿病
接受本品治疗的患者报告了高血糖症(参见【不良反应】)。应对患者的血糖水平或其他糖尿病症状和体征进行监测。根据临床需要给予胰岛素替代治疗。对于血糖控制不好的1型糖尿病,应暂停本品,给予胰岛素替代治疗直至症状缓解。对于危及生命的1型糖尿病,须永久停用本品。应持续监测血糖水平,确保适当的胰岛素替代治疗(参见【用法用量】)。 免疫相关性皮肤不良反应在接受本品治疗的患者中有免疫相关性皮肤不良反应的报告(参见【不良反应】)。对于1级或2级皮疹,可继续本品治疗,并对症治疗或进行局部皮质类固醇治疗。发生3级皮疹时应暂停本品治疗,并对症治疗或进行局部皮质类固醇治疗。发生4级皮疹、确诊SJS或TEN时应永久停止本品治疗(参见【用法用量】)。 免疫相关性肝炎
在接受本品治疗的患者中有免疫相关性肝炎的报告(参见【不良反应】)。应定期(每个月)监测患者肝功能的变化及肝炎相应的症状和体征,并排除感染及与基础疾病相关的病因。如发生免疫相关性肝炎,应增加肝功能检测频率。对于2级免疫相关性肝炎,应暂停本品治疗。对于3级或4级免疫相关性肝炎,应永久停止本品治疗(参见【用法用量】)。 免疫相关性肺炎在接受本品治疗的患者中有免疫相关性肺炎的报告(参见【不良反应】)。应监测患者是否有肺炎症状和体征,如呼吸困难、缺氧表现、咳嗽、胸痛等,以及放射学改变(例如局部毛玻璃样混浊、斑块样浸润)。疑似免疫相关性肺炎的病例应采用影像学、肺功能、动脉血氧饱和度等检查进行评估和确认,并排除感染、疾病相关等其他病因。对于2级免疫相关性肺炎,应暂停本品治疗。对于3级或4级免疫相关性肺炎,应永久停止本品治疗(参见【用法用量】)。 免疫相关性心肌炎在接受本品治疗的患者中有免疫相关性心肌炎的报告(参见【不良反应】)。应对心肌炎的症状和体征进行监测,对于疑似免疫相关性心肌炎,应进行充分的评估以确认病因或排除其他病因,并进行心肌酶谱等相关检查。发生2级心肌炎时,应暂停本品治疗,并给予皮质类固醇治疗,心肌炎恢复至0-1级后能否重新开始本品治疗的安全性尚不明确。发生3级或4级心肌炎时,应永久停止本品治疗,并给予皮质类固醇治疗。应密切监测心肌酶谱、心功能等(参见【用法用量】)。 免疫相关性结肠炎在接受本品治疗的患者中未观察到免疫相关性结肠炎的报告,但其属于其他PD-1/PD-L1产品较常报告的免疫相关不良反应。应监测患者是否有免疫相关性结肠炎相关症状和体征,如腹痛、腹泻、粘液便或血样便,并排除感染和基础疾病相关性病因。对于2级或3级免疫相关性腹泻或结肠炎,应暂停本品治疗。对于4级免疫相关性腹泻或结肠炎,应永久停止本品治疗(参见【用法用量】)。应考虑肠穿孔的潜在风险,必要时行影像学和/或内镜检查以确认。 其他免疫相关不良反应
在本品临床试验中,还在小于1%的患者中报告了包括胰腺炎、肌炎、全血细胞减少/双系血细胞减少、肾炎、溶血性贫血、关节炎的免疫相关不良反应(参见【不良反应】)。其他抗PD-1/PD-L1抗体也报告了未曾在本品治疗中观察到的发生率较低的其他免疫相关不良反应。
对于其他疑似免疫相关不良反应,应进行充分的评估以确认病因或排除其他病因。根据不良反应的严重程度,须暂停本品治疗或永久停药。并根据临床指征,给予皮质类固醇或其他治疗(参见【用法用量】)。 输液相关反应
在接受本品治疗的患者中有输液相关反应的报告(参见【不良反应】)。本品用药后需密切观察患者的症状和体征,包括寒战,发热,胸闷,瘙痒,皮疹,低血压等。出现2级输液相关反应时,应降低滴速或暂停给药,可考虑给予解热镇痛类抗炎药和抗组胺药治疗,当症状缓解后可考虑恢复用药并密切观察。如果出现3级或4级输液相关反应,须立即停止输液并永久停止本品治疗,并给予适当的药物治疗(参见【用法用量】)。 对驾驶和操作机器能力的影响
基于本品可能出现疲乏等不良反应(参见【不良反应】),建议患者在驾驶或操作机器期间慎用本品,直至确定本品不会对其产生不良影响。 配伍禁忌
在没有进行配伍性研究的情况下,本品不得与其他医药产品混合。本品不应与其它医药产品经相同的静脉通道合并输注。
尚无关于舒格利单抗药物过量的数据。如果发生药物过量,必须密切监测患者不良反应的症状或体征,并进行适当的对症治疗。
尚无妊娠女性使用本品的安全性数据。根据文献数据,在啮齿类动物模型中,通过保持母体对胎仔的免疫耐受来维持妊娠是PD-1/PD-L1通路的主要功能之一,阻断PD-L1信号通路可破坏母体对于胎仔的耐受性,增加胎仔流产的风险。已知人源性IgG可通过胎盘屏障,而本品属于IgG4类型的一种重组抗PD-L1完全人源化单克隆抗体,因此可能会通过母体被转运到发育中的胎儿体内。基于目前对于其作用机制的理解,PD-1/PD-L1阻断性抗体具有潜在的胚胎胎儿毒性,妊娠期暴露本品不仅可能会增加自然流产及胎儿死亡的风险,并且也可能会增加胎儿发生免疫相关性疾病或者正常免疫应答被改变的风险。除非临床获益大于潜在风险,不建议在妊娠期间使用本品治疗。 避孕 育龄女性在接受舒格利单抗治疗期间,以及最后一次舒格利单抗给药后至少6个月内应采取有效避孕措施。 生育力 尚无关于舒格利单抗对于生育力潜在影响的临床数据,本品对男性和女性生育力的影响尚不明确。目前尚不清楚本品是否会经人乳分泌,以及本品对母乳喂养的婴幼儿及母乳产量的影响。由于许多抗体可在人乳汁中分泌,人IgG也会分泌到母乳中,本品对母乳喂养的婴幼儿可能存在潜在的风险,故建议哺乳期妇女在接受本品治疗期间及末次给药后至少6个月内停止哺乳。舒格利单抗用于儿童和青少年(<18岁)的安全性和有效性尚不明确。本品在540例接受舒格利单抗单药及联合含铂化疗治疗的临床研究人群中≥ 65岁老年患者占151例(28.0%),临床研究中没有对该人群进行特殊剂量调整。目前临床试验中没有纳入> 75岁的非小细胞肺癌患者,在该人群中的安全性和有效性尚不明确。
舒格利单抗是一种全人源单克隆抗体,由于单克隆抗体不通过细胞色素CYP450酶或其他药物代谢酶代谢,也不主要以转运体介导的方式摄取和外排,所以合并使用对常见代谢酶或转运体的抑制或诱导作用预期不会影响本品的药代动力学特征。
因可能影响本品的药效学活性,应避免在开始本品治疗前使用全身性皮质类固醇及其他免疫抑制剂。如果为治疗免疫相关不良反应,可以在开始本品治疗后使用全身性皮质类固醇及其他免疫抑制剂(参见【注意事项】)。
基石药业(苏州)有限公司
86981453000048
程序性死亡配体-1(PD-L1)可表达在肿瘤细胞和肿瘤浸润性免疫细胞上,有助于在肿瘤微环境中的抑制抗肿瘤免疫应答。当 PD-L1 与 T 细胞及抗原递呈细胞上的 PD-1 和 B7.1 受体结合时,可抑制细胞毒性 T 细胞活性、T 细胞增殖和细胞因子释放。
舒格利单抗是一种可直接结合 PD-L1 的人免疫球蛋白 G4(IgG4)单克隆抗体,可抑制 PD-L1与程序性细胞死亡因子-1(PD-1)及白细胞分化抗原 CD80(B7.1)的结合。舒格利单抗未明显诱导抗体依赖性细胞介导细胞毒性(ADCC)及补体依赖性细胞毒性(CDC)。在同源小鼠肿瘤模型中,腹腔注射舒格利单抗可减慢肿瘤生长。
遗传毒性
舒格利单抗尚未开展遗传毒性研究。
生殖毒性
舒格利单抗未开展生殖毒性试验。
通过文献评估对生殖的影响,PD-L1/PD-1 信号通路的主要功能是通过保持母体对胎儿的免疫耐受以维持妊娠。在妊娠小鼠模型中,阻断 PD-L1 信号可破坏对胎儿的免疫耐受,并增加胎仔流产。因此,妊娠期给予舒格利单抗的潜在风险包括流产率或死胎率增加。文献报道,未见与 PD-L1/PD-1 信号通路阻断相关的胎儿畸形,但在 PD-1 与 PD-L1 基因敲除小鼠中可见免疫介导的疾病。基于其作用机制,胎儿暴露于舒格利单抗可能会增加发生免疫介导紊乱或改变正常免疫反应的风险。
致癌性
舒格利单抗尚未进行致癌性研究。
其他毒性
食蟹猴重复给药 4 周、26 周(每周一次)毒性试验中,部分动物可见眼部不良反应,包括视网膜色素变性,局灶性角膜浑浊。
文献资料显示,在动物模型中,抑制 PD-L1/PD-1 信号通路可导致某些感染的严重程度增加,以及炎症反应增强。与野生型对照组相比,PD-1 基因敲除小鼠感染结核分枝杆菌后可见生存期明显缩短,该结果与这些动物体内细菌增殖和炎症反应增加有关。研究还显示,PD-L1 和 PD-1 敲除小鼠、接受 PD-L1 阻断抗体的小鼠在感染淋巴细胞性脉络丛脑膜炎病毒后存活率降低。
非小细胞肺癌
CS1001-302: 舒格利单抗联合含铂化疗用于一线晚期非小细胞肺癌患者的随机双盲研究 CS1001-302研究为一项多中心、随机对照、双盲的III期注册临床研究,旨在评价舒格利单抗联 合含铂化疗对比安慰剂联合含铂化疗,在未经系统性治疗的、IV期非小细胞肺癌患者中的有效性和 安全性。该研究入组患者包含组织学检查证实为非鳞状非小细胞肺癌(EGFR敏感性突变阴性)或鳞 状非小细胞肺癌的患者。符合入组标准的患者,按照2:1的比例随机分组,预设的随机的分层因素包 括:PD-L1表达(PD-L1≥1% vs. PD-L1<1%)、ECOG评分(0 vs. 1)、肿瘤组织学(鳞状vs.非鳞状)。
研究中非鳞状NSCLC患者接受的治疗如下: 舒格利单抗1200 mg +培美曲塞500 mg/m2 +卡铂AUC=5 mg/mL/min,静脉输注,每21天为 一个给药周期,每周期第1天,共4个给药周期;4个给药周期后舒格利单抗1200 mg+培美 曲塞500 mg/m2 静脉滴注,每3周1次,维持治疗。 安慰剂+培美曲塞500 mg/m2 +卡铂AUC=5 mg/mL/min,静脉输注,每21天为一个给药周期, 每周期第1天,共4个给药周期;4个给药周期后安慰剂+培美曲塞500 mg/m2 静脉滴注,每3 周1次,维持治疗。 研究中鳞状NSCLC患者接受的治疗如下: 舒格利单抗1200 mg+紫杉醇175 mg/m2+卡铂AUC=5 mg/mL/min,静脉输注,每21天为一个 给药周期,每周期第1天,共4个给药周期;4个给药周期后舒格利单抗1200 mg静脉滴注, 每3周1次,维持治疗。 安慰剂+ 紫杉醇175 mg/m2+卡铂AUC=5 mg/mL/min,静脉输注,每21天为一个给药周期, 每周期第1天,共4个给药周期;4个给药周期后安慰剂静脉滴注,每3周1次,维持治疗。 共479例患者随机分组,接受试验药物(舒格利单抗或安慰剂)和化疗药物的治疗,直至疾病进 展、不能耐受、撤回知情同意、死亡、方案规定的其他原因,舒格利单抗治疗疗程满2年或研究结束, 以先发生者为准。本研究的主要有效性终点是研究者根据RECIST v1.1评估的无进展生存期(PFS)。 次要终点包括盲态独立中心审阅委员会(BICR)根据RECIST v1.1评估的PFS,总生存期(OS), 客观缓解率(ORR)和缓解持续时间(DOR)等。治疗期,在第1年内:首次给药后第6周、第12周 各进行一次影像学评估,此后每9周进行一次影像学评估;1年之后:每12周进行一次影像学评估, 直至疾病进展、失访、死亡、或研究结束,以先发生者为准。 两组间的基线特征均衡,符合晚期NSCLC人群特征。在479例患者中,所有患者均为IV亚裔 NSCLC患者,80%为男性,38.8%年龄≥65岁(中位年龄为63岁[范围29-75]),40.1%为鳞状NSCLC 患者,59.9%为非鳞状NSCLC患者,60.8%患者的PD-L1表达水平≥1%,11.8%的患者在基线发生了肝 转移,14.0%的患者在基线发生了脑转移。 研究结果表明,较安慰剂联合含铂化疗,舒格利单抗联合含铂化疗作为一线治疗延长了晚期 NSCLC患者的无进展生存期(PFS),研究结果达到统计学显著性,且具有临床意义。亚组分析结 果显示,研究者评估的PFS在各个亚组中的PFS获益趋势跟意向治疗人群中PFS获益基本一致,在组 织分型亚组(鳞状,非鳞状)和PD-L1表达水平(<1%,≥1%)亚组中均显示临床获益,舒格利单抗 联合含铂化疗相较于安慰剂联合含铂化疗降低患者疾病进展或死亡的风险,延长患者PFS。 BICR评价的PFS结果与主要研究终点一致。其他次要终点数据也支持主要研究终点结果。总生 存期显示出获益趋势。 CS1001-302研究有效性结果总结在表4、图1和图2。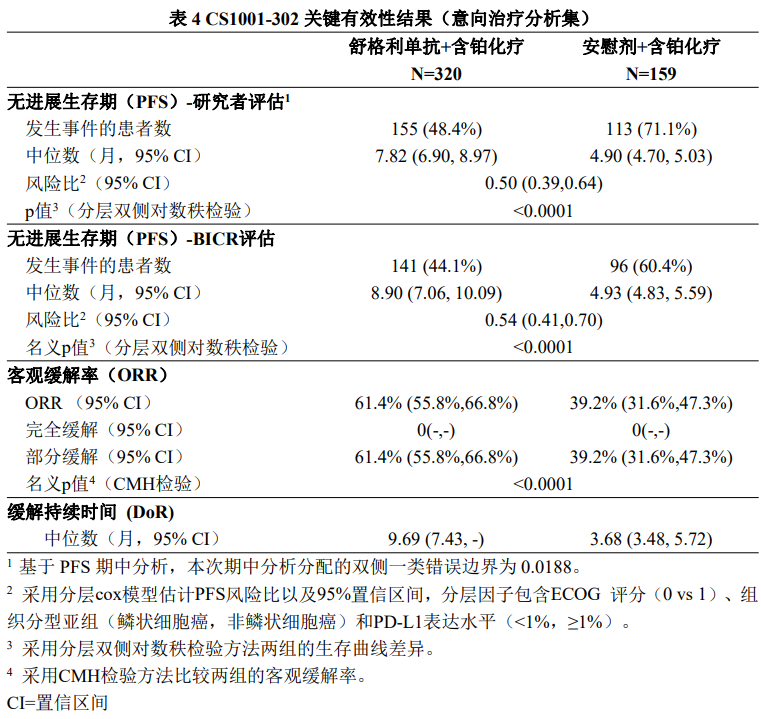
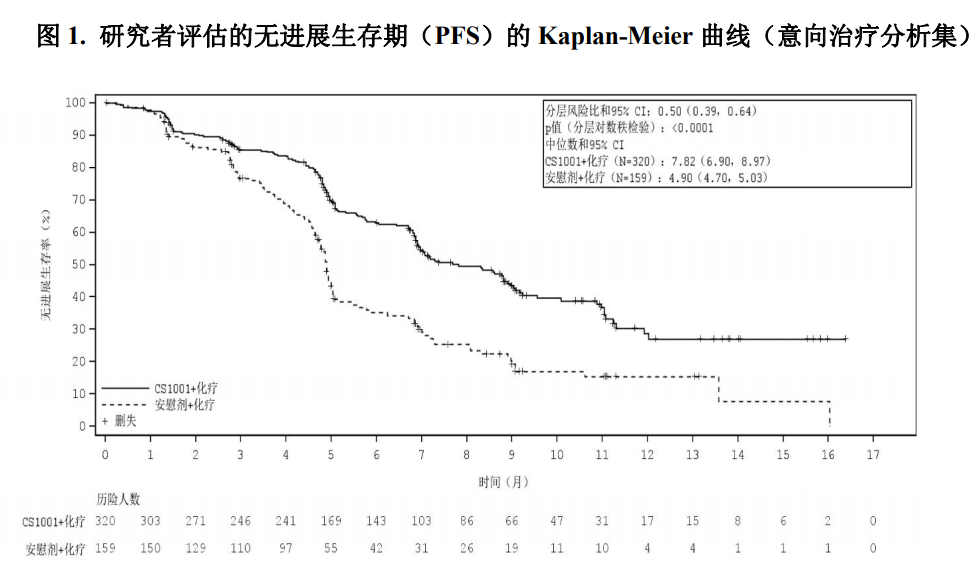
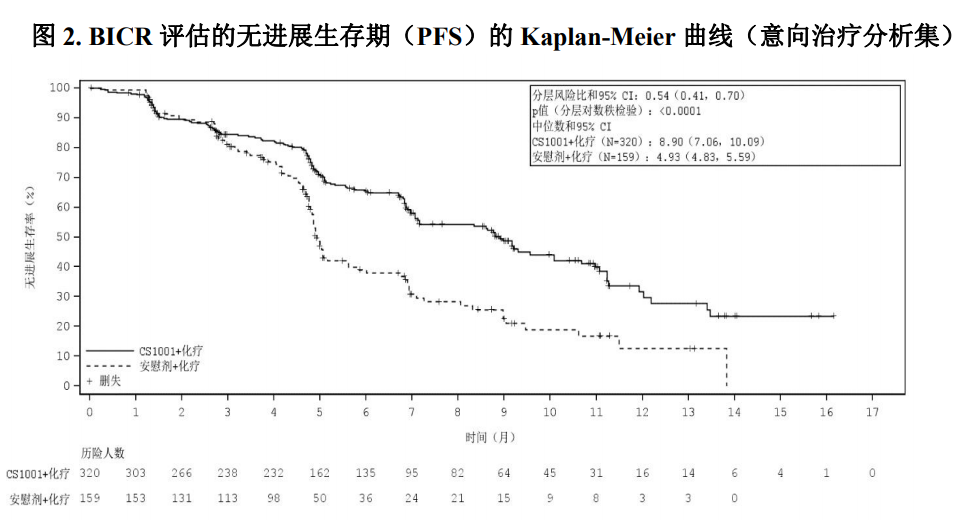
药效动力学
受体占有率生物分析
受体占有率(RO)分析旨在定量舒格利单抗与细胞表面PD-L1的结合率。在1001-102研究中,在给药前(第1天)、第2周期给药前(第21天)和第4周期给药前(第63天)采集肝素钠抗凝全血样本。
使用外周全血样本中的CD3 + T细胞作为替代物,通过流式细胞仪检测新鲜血样中舒格利单抗的RO水平。采集3例患者(10 mg/kg组)和4例患者(1200 mg组)的血样进行RO分析。在C2D1给药前时间点,7例可评价患者的CD3 + T细胞显示100% RO。值得注意的是,与1200 mg剂量组相比,3例较低剂量组(10 mg/kg)患者的RO已显示饱和。在C4D1给药前时间点,3例患者的RO保持在较高水平(76%-100%)。 药代动力学
在29例中国晚期实体瘤患者进行的每3周1次给药舒格利单抗进行了不同剂量单次和多次给药研究。研究结果显示,舒格利单抗的暴露量(AUC和Cmax)在3 mg/kg至40 mg/kg的剂量范围内(包括1200 mg固定剂量)接近剂量线性相关性增加。每3周1次给药,在4次给药后,药物基本达到稳态浓度。吸收
本品为静脉滴注给药,于给药结束后达到药物峰浓度。晚期实体瘤患者(n=16)单次给药1200 mg后,药物峰浓度(几何变异系数)为422.59μg/ml(22.76%)。
分布
晚期实体瘤患者(n=16)单次给药后表观分布容积(几何变异系数)为4.25 L(24.18%)。 代谢抗体药物并非通过代谢酶代谢途径分解。 消除
晚期实体瘤患者(n=16)单次给药1200 mg后舒格利单抗的平均清除率(几何变异系数)为0.176L/天(32.98%),消除半衰期(几何变异系数)为17.56天(6.24%)。一项基于晚期实体瘤、复发难治NK/T细胞淋巴瘤、复发难治经典型霍奇金淋巴瘤及一线晚期转移性非小细胞肺癌的群体药代动力学分析显示,体重、白蛋白、性别、肿瘤类型是清除率和中央室分布容积的协变量,肌酐清除率是药物清除率随时间变化的相关参数的协变量,但根据协变量对舒格利单抗药代动力学特征的影响程度,认为协变量对舒格利单抗的系统暴露量的影响没有显著临床意义。其余因素包括基线年龄、性别、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、美国东部肿瘤协作组体力状态(ECOG)、最佳总体疗效(BOR)对舒格利单抗药代动力学特征没有显著影响。基于群体药代动力学模型,舒格利单抗的消除率随时间变化而降低,稳态时的清除率相比基线清除率(相对标准误差)0.259L/天(2.32%)下降约30.85%,研究认为降低的清除率不具备显著临床意义。基于模型预测,药物在非小细胞肺癌患者中的消除半衰期约为20.4天。
注射剂
600 mg(20.0 ml)/瓶。
中硼硅玻璃管制注射剂瓶装,1瓶/盒。
本品在2~8℃避光保存与运输,不得冷冻。
36个月。
国药准字S20210053

