畅皓说明书
Artemisia Annua Allergens Sublingual Immunotherapy Drops
黄花蒿花粉变应原蛋白提取物
黄花蒿(Artemisia Annua)花粉变应原蛋白提取物。
本品为无色至微黄色澄明液体。
本品是一种变应原提取物,作为特异性免疫治疗用于经过敏原检测为黄花蒿/艾蒿花粉过敏引起的变应性鼻炎(或伴有结膜炎)的成年患者。
本品不适用于过敏症状的快速对症处理。
本品应在具有专业诊疗经验的医生指导下使用。
本品应舌下给药。将本品滴于舌下,保持含服至少 1 分钟后方可吞咽。每日一次。请勿将本品与食物或饮料一起服用。在服用本品后的 5 分钟内请勿饮食。本品推荐在每年预期的黄花蒿/艾蒿花粉季(通常于每年 6、7 月开始,各地区不等)开始前至少 4 个月开始治疗,并在整个花粉季期间持续使用,治疗为期32 周。
本品给药分为递增阶段和维持阶段。在递增阶段,按下表所示依次使用本品的 1-5 号作为递增剂量;在维持阶段,按下表所示持续使用本品 5 号作为维持剂量。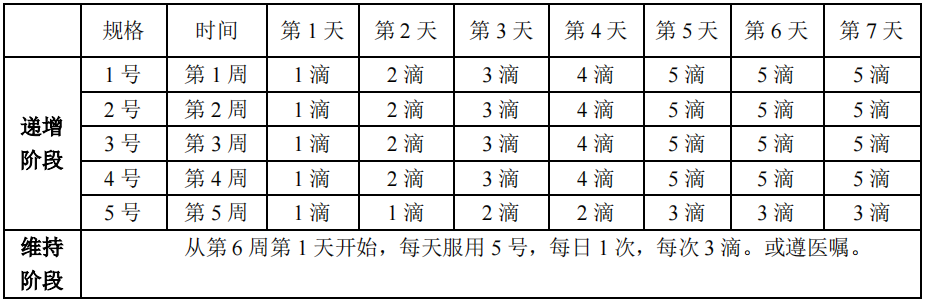
本品应在医疗机构内由具有过敏性疾病诊断和治疗经验的医生监督下进行首次给药,给药后应医学监测至少 30 分钟,观察是否有严重的全身或局部过敏反应的体征或症状:1)如果首次给药即出现严重或可能危及生命的过敏反应,不建议继续使用。2)如果首次给药患者耐受,则本品后续剂量可以在家中给药。使用过程中应严格观察患者用药的耐受性,医生可根据患者的耐受情况调整剂量:1)对于使用本品出现全身性过敏反应的患者,应停止给药并对症处理。2)对于使用本品出现间断或持续的局部过敏反应的患者,医生应在重新评估后指导患者逐步降低剂量直至患者可耐受,并将可耐受剂量作为患者的维持剂量,持续
服用直至治疗结束,也可考虑终止使用本品。尚未进行本品停药后重新开始治疗、或在黄花蒿/艾蒿花粉季期间开始治疗的临床研究,不推荐使用。
本品的安全性分析数据来自于 972 例受试者,其中 674 例受试者应用本品。
在应用本品的受试者中共有 427 例(63.35%)发生不良反应,大多数不良反应的严重程度为轻度或中度,在未采取任何措施的情况下自行消失;27 例(4.01%)发生重度不良反应,重度不良反应包括口腔溃疡、胃食道反流、舌水疱、舌水肿、舌痒、呕吐、变应性鼻炎、变应性结膜炎、喘息、荨麻疹、流泪;3 例(0.45%)因不良反应终止研究,导致终止研究的不良反应为喘息、咳嗽、胃食道反流、变应性鼻炎。
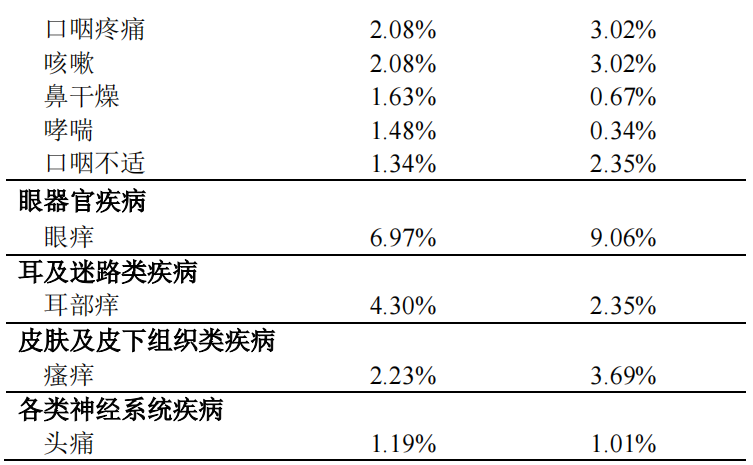
按照如下不良反应发生率定义:十分常见(>1/10)、常见(>1/100,<1/10)、偶见(>1/1,000,<1/100)、罕见(>1/10,000,<1/1,000)、十分罕见(<1/10,000),在本品临床研究中,十分常见的不良反应包括口腔感觉减退、变应性鼻炎、变应性结膜炎。常见的不良反应在本品组和安慰剂组发生率的对比详见下表。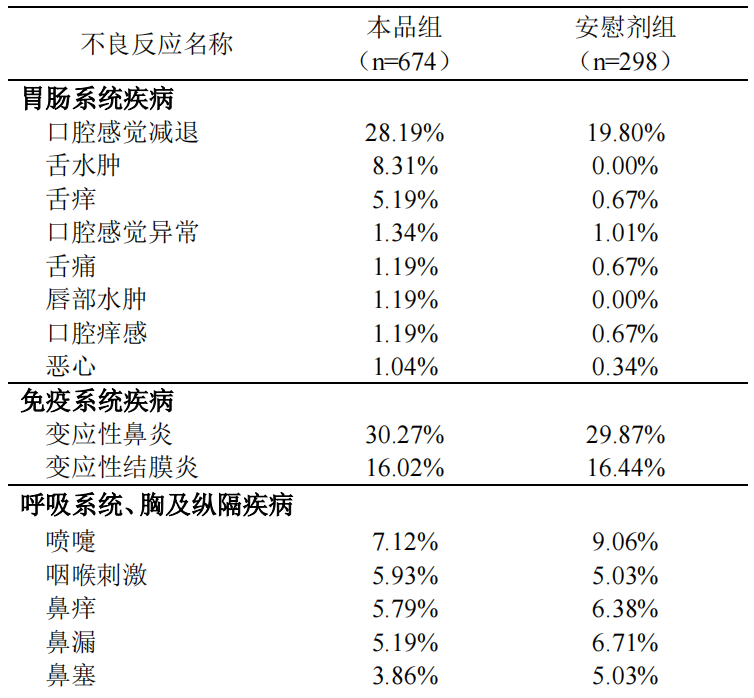
1. 有任何严重的全身过敏反应史,嗜酸性食管炎病史,进行舌下变应原(过敏原)免疫治疗后有任何严重的局部反应史的患者。
2. 对本品所含的任何非活性成份过敏者。
警示语:严重的过敏反应 1. 本品可能引起危及生命的过敏反应,例如严重过敏和严重的咽喉肿胀(见[注意事项])。 2. 本品应在医疗机构内由具有过敏性疾病诊断和治疗经验的医生监督下进行首次给药,给药后应医学监测至少 30 分钟,观察是否有严重的全身或局部过敏反应的体征或症状(见[用法用量])。 3. 本品不建议用于严重的或未控制的哮喘(见[注意事项])。 4. 本品不建议用于患有可能降低严重过敏反应生存能力疾病的患者(见[注意事项])。 5. 本品不建议用于对肾上腺素或吸入性支气管扩张药无反应的患者,例如正在服用 β-肾上腺素受体阻滞剂的患者(见[药物相互作用])。
本品不建议用于常年性变应性鼻炎、慢性鼻炎或鼻窦炎、鼻息肉、严重的或未控制的哮喘、不可逆的呼吸道阻塞性疾病,或者有免疫抑制疾病史、恶性肿瘤病史、自身免疫性疾病史、近期接受过花粉变应原特异性免疫治疗的患者。
本品应在医疗机构内由具有过敏性疾病诊断和治疗经验的医生监督下进行首次给药,给药后应医学监测至少 30 分钟,观察是否有严重的全身或局部过敏反应的体征或症状。
本品可能引起全身过敏反应,包括可能危及生命的过敏反应。对于使用本品出现全身性过敏反应的患者,应停止给药并对症处理。
如果本品引起过敏反应,可能需要使用肾上腺素治疗。本品不建议用于患有某些可能降低严重过敏反应生存能力、或增加肾上腺素给药后不良反应风险的疾病的患者,包括但不限于:肺功能明显受损(慢性或急性)、不稳定的心绞痛、新发的心肌梗塞、严重的心律不齐和不受控制的高血压。
本品可能引起严重的局部反应,包括咽喉肿胀,有可能损害呼吸并危及生命。
对于使用本品出现间断或持续的局部过敏反应的患者,医生应在重新评估后指导患者逐步降低剂量直至患者可耐受,并将可耐受剂量作为患者的维持剂量,持续服用直至治疗结束,也可考虑终止使用本品。
当患者出现口腔炎症(如口腔溃疡或鹅口疮)或口腔创伤(如口腔外科手术
或拔牙后的伤口)时,应暂停使用本品,以促进口腔炎症或口腔创伤的愈合。
尚未在患有中度或重度哮喘的受试者中研究本品的安全性。如果哮喘患者处 在急性发作期,应停止使用本品。对反复发作的哮喘患者,医生应再次评估。
其他舌下免疫制剂曾报道可以引起嗜酸性食管炎不良反应。使用本品出现严重或持续性胃食管症状(包括吞咽困难或胸痛)的患者应停止给药并考虑嗜酸性食管炎的可能性。
用药期间如果患者健康状况有变化,如感染传染性疾病、出现全身性疾病、怀孕等应及时告知医生,由医生判断是否需要调整治疗方案。
在黄花蒿/艾蒿花粉季(于每年 6、7 月开始,维持 1-3 个月,各地区不等)开始后再服用本品,不良反应的风险可能会增加,不推荐使用。
高剂量的黄花蒿/艾蒿花粉变应原可能加重过敏症状。若因本品药物过量发生过敏症状或症状加剧,应及时采取措施,降低本品剂量或暂停使用本品,并考虑进行对症治疗。
本品在黄花蒿/艾蒿花粉过敏患者中开展了 20000BU/天,连续给药 8 天的耐受性研究。研究中未观察到剂量相关的毒性反应,不良事件严重程度均为轻度。
本品尚未在孕妇中进行安全性和有效性研究。本品尚未在哺乳期妇女中进行安全性和有效性研究。本品尚未在 18 岁以下儿童患者中进行安全性和有效性研究。本品尚未在 60 岁以上患者中进行安全性和有效性研究。
本品尚未开展药物相互作用研究。本品与其他过敏原免疫制剂同时给药可能会增加舌下过敏原免疫疗法的局部或全身不良反应的可能性。
本品不建议用于正在服用可增强或抑制肾上腺素作用药物的患者。这些药物包括:
β-肾上腺素受体阻滞剂:服用 β-肾上腺素受体阻滞剂的患者可能对通常用于治疗严重全身反应(包括过敏反应)的肾上腺素无反应,尤其是 β-肾上腺素受体阻滞剂能拮抗肾上腺素的心脏刺激和支气管扩张作用。
α-肾上腺素受体阻滞剂、麦角生物碱:肾上腺素可用于治疗严重的全身性反应,包括过敏反应,而服用 α-肾上腺素受体阻滞剂的患者可能对通常剂量的肾上腺素无反应。α-肾上腺素受体阻滞剂能拮抗肾上腺素的血管收缩作用和高血压作用。麦角生物碱可以逆转肾上腺素的升压作用。
三环类抗抑郁药、左甲状腺素钠、单胺氧化酶抑制剂和某些抗组胺药(如氯苯那敏和苯海拉明):服用此类药物的患者使用肾上腺素后可能加重不良反应。
心脏糖苷类、利尿剂:服用肾上腺素同时服用心脏糖苷类或利尿剂的患者,应密切观察其是否出现心律不齐。
使用全身皮质类固醇药,会抑制免疫系统,可能导致本品无法发挥作用。
浙江我武生物科技股份有限公司
86904730000043
本品为黄花蒿花粉的提取物,作为特异性免疫治疗用于黄花蒿/艾蒿花粉过敏引起的变应性鼻炎。
SD 大鼠连续 6 个月经口给予黄花蒿花粉变应原 800、4000、20000 和 100000 BU/kg/天,可引起大鼠调节性 T 细胞比例升高、脾脏 T、B 淋巴细胞增殖率及 T细胞依赖性抗体反应(TDAR)降低等免疫抑制作用。本品对免疫抑制的 NOAEL为 4000BU/kg。
本品在经过敏原检测为黄花蒿/艾蒿花粉过敏引起的成人变应性鼻炎(或伴有结膜炎)的患者中开展了一项多中心、随机、双盲、安慰剂对照的 III 期临床研究。根据受试者所在地区定义花粉季前 16 周开始给药,为期 32 周,前 5 周1.25BU/天至 2400BU/天剂量递增,第 6 周至第 32 周给予 2400BU/天剂量维持治疗。主要通过花粉季 8 周的日均鼻炎症状-对症用药组合评分评价本品的安全性和有效性。
在此项研究中,全分析集共纳入 660 例患者(本品组 439 例,安慰剂组 221例),本品组与安慰剂组的主要疗效指标日均鼻炎症状-对症用药组合评分最小二乘均数分别为 1.224 分和 1.415 分,两组差值及 95% CI 为 0.19(0.07,0.31);基于最小二乘均数的日均鼻炎症状-药物组合评分差异比率及 95% CI 为 13.5%(5.0%,21.1%)。其他次要指标日均鼻炎症状评分(DSS)、日均对症用药评分(DMS)等,也呈现本品组优于安慰剂组的趋势。
本品是包含了高分子量蛋白质类黄花蒿花粉变应原的复杂混合物。经舌下含服后,药物的活性成分首先由舌下黏膜上皮层的朗格罕细胞摄取和处理,之后再呈递给了 T 淋巴细胞和 B 淋巴细胞。经过机体一系列细胞间的信号传导,抑制Th2 细胞相关的免疫反应,促进阻断性抗体 IgG4 的产生以及降低炎性细胞的募集,从而让患者对该变应原产生免疫耐受。
滴剂
黄花蒿花粉变应原舌下滴剂1号:总变应原活性25BU/ml,装量为2ml;黄花蒿花粉变应原舌下滴剂2号:总变应原活性128BU/ml,装量为2ml;黄花蒿花粉变应原舌下滴剂3号:总变应原活性640BU/ml,装量为2ml;黄花蒿花粉变应原舌下滴剂4号:总变应原活性3200BU/ml,装量为2ml;黄花蒿花粉变应原舌下滴剂5号:总变应原活性16000BU/ml,装量为2ml。
低密度聚乙烯药用滴眼剂瓶,1 瓶/包装。
于 2-8°C 密闭保存。请将本品置于儿童不能随意触摸到的地方。
自生产之日起 24 个月。
国药准字S20210001

