恒曲说明书
Herombopag Olamine Tablets
海曲泊帕乙醇胺
本品主要成份为海曲泊帕乙醇胺
化学名称:(Z)-5-(2-羟基-3-(2-(3-甲基-5-氧代-1-(5,6,7,8-四氢萘-2-基)-1H-吡唑-4(5H)-亚基)肼基)苯基)呋喃-2-羧酸乙醇胺盐(1∶2)。
化学结构式:
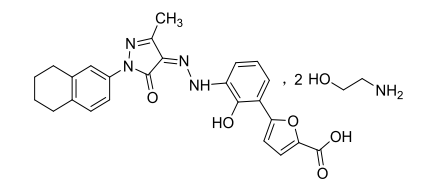
分子式:C25H22N4O5•2C2H7NO
分子量:580.64
本品为薄膜衣片,除去包衣后显浅棕色至棕色
1. 本品适用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(ITP)成人患者,使血小板计数升高并减少或防止出血。本品仅用于因血小板减少和临床条件导致出血风险增加的 ITP 患者。
2. 本品适用于对免疫抑制治疗(IST)疗效不佳的重型再生障碍性贫血(SAA)成人患者。基于一项Ⅱ期单臂临床试验的结果附条件批准本适应症。该适应症的完全批准将取决于正在进行的确证性临床试验的结果。
本品空腹口服,口服 2 小时后方可进餐,避免与餐同服。以下产品应在服药后至少 2 小时使用,包括乳制品(例如牛奶、酸奶、乳酪和冰淇淋等)或者含多价阳离子(例如铝、钙、镁、铁、硒和锌)的矿物质补充剂。
成人原发免疫性血小板减少症(ITP)患者:
应采用能使血小板计数达到并维持≥50×109/L 的最低剂量。基于用药后血小板反应情况进行个体化剂量调整。不得为了使患者血小板计数达到正常而使用本品。在临床试验中,血小板计数通常在本品治疗开始后 1-2 周内升高,在治疗终止后 1-2 周内下降。
初始剂量:
本品在 ITP 患者中建议的初始剂量为 2.5 mg,每日一次。
监测和剂量调整:
在治疗过程中,应监测血小板计数,根据血小板计数情况,采用能使血小板计数达到并维持≥50×109/L 的最低剂量,最高剂量不可超过每日 7.5 mg。具体参照表 1 所列的血小板计数情况进行剂量调整。
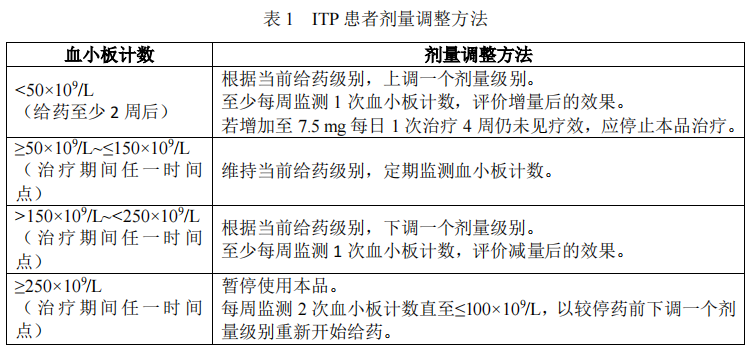
本品在 ITP 患者中,无论增量还是减量,请参照表 2 的剂量调整级别依次增减。
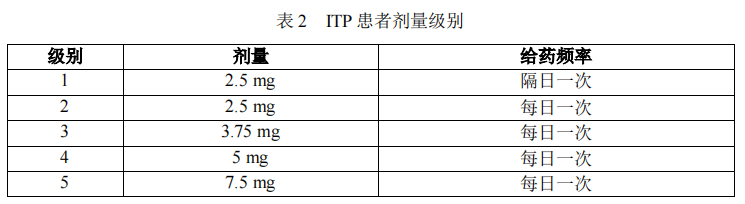
24 小时内使用本品的次数不应超过 1 次。若患者使用本品时合并其他 ITP 药物治疗,经医生判断后,可以调整所合并的药物剂量,以避免本品治疗期间血小板计数过高。在本品的首次给药以及任何剂量调整过后,应监测血小板计数,至少每周一次,监测 2~3 周,观察患者血小板计数的变化情况,考虑是否进一步调整剂量。若患者达到剂量稳定(剂量维持 3 周不变),可适当降低血小板监测频率(如 2~4周一次)。
停药
对于 ITP 患者,本品以 7.5 mg 每日一次剂量治疗 4 周后,如血小板计数仍未升高至足以避免临床严重出血的水平,应停止本品治疗。停药后应继续监测包括血小板计数在内的血常规,每周一次,至少 4 周。
如出现血小板过度升高或重要的肝功能检测异常(参见表 1 和【注意事项】),需停止本品治疗。
重型再生障碍性贫血(SAA)患者:
应采用能使血小板计数达到并维持应答的最低剂量,后续根据血小板计数调整剂量。开始治疗时需由低至高滴定治疗剂量。在临床试验中,通常需达到 15mg/日剂量水平时可发生血液学应答。
初始剂量:
本品在 SAA 患者中建议的初始剂量为 7.5 mg,每日一次。
监测和剂量调整:
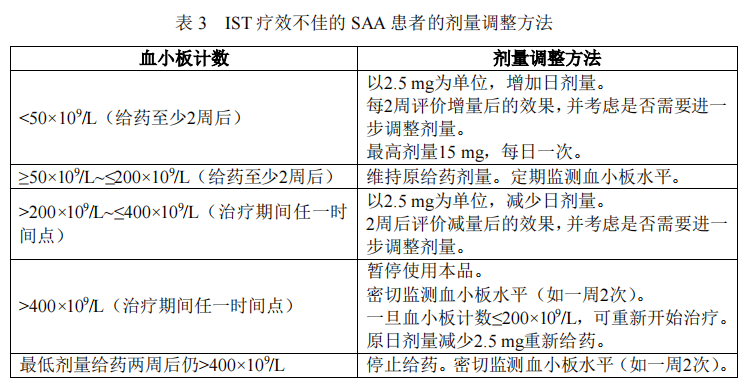
在治疗过程中,应定期监测血小板计数,根据血小板计数情况,每 2 周调整一次剂量,直至达到维持血小板应答的最低剂量。最高剂量不可超过每日 15 mg。
具体参照表 3 所列的血小板计数情况进行剂量调整。
停药
对于 IST 疗效不佳的 SAA 患者,本品治疗 24 周后,如未发生血液学应答(应答标准参见【临床试验】),建议停止本品治疗。如果观察到新的细胞遗传学异常,请考虑停用本品(参见【注意事项】)。如出现血小板过度升高或重要的肝功能检测异常,则需停止本品治疗(参见表 3 和【注意事项】)。
特殊人群
肝功能不全:
目前尚无针对肝功能不全患者进行的药代动力学研究及临床试验数据,建议肝功能损害患者慎用本品。
建议开始本品治疗前,测定血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和胆红素水平。如患者在开始用药前伴随重要的肝功能检测异常(参见【注意事项】),不建议使用本品治疗。
治疗期间,应监测肝功能指标(参见【注意事项】)。
肾功能不全:
目前尚无针对肾功能不全患者进行的药代动力学研究及临床试验数据。建议肾功能损害患者慎用本品。
老年人:
老年患者无需进行剂量调整(参见【老年用药】)。
儿童:
尚无本品用于 18 岁以下患者的临床试验资料。
临床试验经验
海曲泊帕乙醇胺的安全性特征总结数据来自 2 项在 ITP 患者中的Ⅰ期临床试验(SHR-TPOPⅠd、HR-TPO-Ⅰe-ITP)、1 项在 SAA 患者中的Ⅱ期临床试验(HR-TPO-SAA-Ⅱ)和 1 项 ITP 患者中的Ⅲ期临床试验(HR-TPO-Ⅲ-ITP)。共计 526 例患者接受海曲泊帕乙醇胺给药,其中 ITP 患者 471 例(89.5%),SAA患者 55 例(10.5%)。
接受海曲泊帕乙醇胺给药的 526 例患者中所有级别的不良反应发生率为52.3%,常见不良反应(发生率≥3%)包括:丙氨酸氨基转移酶升高(11.2%),天门冬氨酸氨基转移酶升高(10.6%),血小板计数升高(8.9%),血乳酸脱氢酶升高(8.6%),血胆红素升高(4.8%),γ-谷氨酰转移酶升高(3.8%),头痛(3.4%)和血碱性磷酸酶升高(3.0%)。
研究中所报告的大多数不良反应的严重程度均为轻中度。重度不良反应的发生率为 1.3%,包括:丙氨酸氨基转移酶升高(0.6%),血小板计数升高(0.4%),天门冬氨酸氨基转移酶升高(0.4%),血胆红素升高(0.2%),结合胆红素升高(0.2%),血非结合胆红素升高(0.2%),γ-谷氨酰转移酶升高(0.2%),高尿酸血症(0.2%),急性心肌梗死(0.2%)和贫血(0.2%)。
免疫性血小板减少症
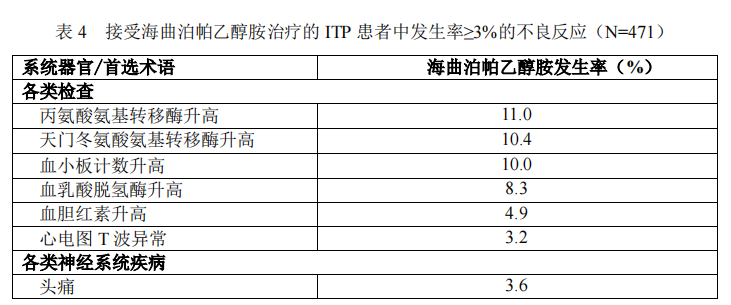
在 ITP 患者中共进行过 3 项临床试验,其中 1 项Ⅲ期临床试验(HR-TPO-Ⅲ-ITP)分为四个阶段:10 周随机、双盲、安慰剂对照期(第一阶段),14 周开放、阳性药对照期(第二阶段),撤药期(第三阶段)和 24 周延长期(第四阶段)。共 471 例 ITP 患者接受过海曲泊帕乙醇胺治疗,其中 340 例患者接受了 24周治疗,258 例患者接受了 48 周治疗。表 4 按照系统器官分类和发生率列出了接受海曲泊帕乙醇胺治疗的 ITP 患者中观察到的常见不良反应(发生率≥3%)。
研究中所报告的大多数不良反应的严重程度均为轻中度。重度不良反应的发生率为 1.3%,包括:丙氨酸氨基转移酶升高(0.6%),血小板计数升高(0.4%),天门冬氨酸氨基转移酶升高(0.4%),结合胆红素升高(0.2%),血胆红素升高(0.2%),血非结合胆红素升高(0.2%),高尿酸血症(0.2%),急性心肌梗死(0.2%)和贫血(0.2%)。
再生障碍性贫血
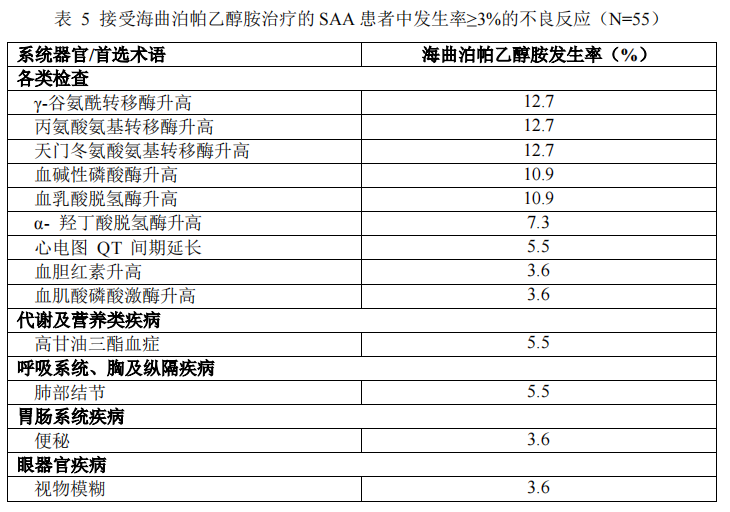
一项在 SAA 患者中的Ⅱ期单臂临床试验中,纳入了 55 例年龄在 19~65 岁的患者,其中 61.8%为男性,有 49 例患者至少完成了 18 周给药,30 例患者完成了 52 周给药。表 5 按照系统器官分类和发生率列出了接受海曲泊帕乙醇胺治疗的 SAA 患者中观察到的常见不良反应(发生率≥3%)。
研究中所报告的大多数不良反应的严重程度均为轻中度。重度不良反应的发生率为 1.8%,为γ-谷氨酰转移酶升高。
特定药物不良反应
血栓形成/血栓栓塞并发症
在所有 ITP 患者临床试验中(N=471),共 3 例患者发生与药物相关的血栓类不良事件,分别为急性心肌梗死 1 例(0.2%),发生在使用海曲泊帕乙醇胺治疗后第 11 天,服药剂量为 5 mg 每日一次,事件发生时血小板计数为 417×109 /L;锁骨下静脉血栓形成 1 例(0.2%),发生在使用海曲泊帕乙醇胺治疗后第 22 周,服药剂量为 3.75 mg 每日一次,事件发生时血小板计数为 78×109 /L;腔隙性脑梗死 1 例(0.2%),发生在使用海曲泊帕乙醇胺治疗后约第 44 周,服药剂量为 2.5
mg 每日一次,事件发生前最近一次血小板计数为 79×109 /L。在 SAA 患者临床试验中(N=55),未出现与药物相关的血栓类不良事件。
肝毒性
在 ITP 患者Ⅲ期临床试验中(N=424),在与安慰剂对照研究期间,海曲泊帕乙醇胺组和安慰剂组与药物相关的丙氨酸氨基转移酶升高的发生率分别为 7.7%和 9.4%,天门冬氨酸氨基转移酶升高的发生率分别为 7.4%和 5.9%,血胆红素升高发生率为 2.1%和 0%,结合胆红素升高发生率为 2.1%和 2.4%,血非结合胆红素升高发生率为 1.8%和 2.4%。上述不良事件均未导致患者永久停药。海曲泊帕乙醇胺组 1 例(0.3%)患者因 ALT 升高、AST 升高导致服药暂停,经治疗后肝酶恢复正常,可继续恢复海曲泊帕乙醇胺治疗。整个海曲泊帕乙醇胺治疗期间(N=339,治疗约 48 周),1 例(0.3%)患者出现 ALT>3 倍正常值上限且胆红素>2 倍正常值上限,发生在使用海曲泊帕乙醇胺后约 6 个月时,给予保肝治疗后,肝功能恢复至基线水平。1 例(0.3%)患者出现 AST 升高>8 倍正常值上限,发生在使用海曲泊帕乙醇胺后约 2 个月时,停止使用海曲泊帕乙醇胺后,患者在 1 周后肝功能自行恢复正常。在 SAA 患者临床试验中(N=55),与药物相关的丙氨酸氨基转移酶升高和天门冬氨酸氨基转移酶升高的发生率均为 12.7%,其中 1 例(1.8%)患者出现ALT>3 倍正常值上限且胆红素>2 倍正常值上限,发生在首次给药 5 个月后。与药物相关的血胆红素升高和结合胆红素升高的发生率分别为 3.6%和 1.8%。上述事件严重程度均为轻中度,经药物治疗后均可恢复正常,未发生导致停药或研究药物减量的情况。
骨髓网硬蛋白形成和骨髓纤维化风险
在所有 ITP 患者临床试验中(N=471),基于骨髓活检中的骨髓纤维化评分结果,整个海曲泊帕乙醇胺治疗期间(治疗约 48 周),共有 3 例(0.6%)患者出现与药物相关的骨髓纤维化,均发生在使用海曲泊帕乙醇胺治疗约 14 周时,严重程度均为轻度,患者未进行干预治疗,并继续服用海曲泊帕乙醇胺,事件在约6 个月后复查时自行恢复或缓解。
在 SAA 患者临床试验中(N=55),未出现与药物相关的骨髓网硬蛋白形成和骨髓纤维化。
停药后血小板下降
在 ITP 患者Ⅲ期临床试验中(N=424),194 例患者接受撤药研究(第三阶段),其中 171 例(88.1%)患者出现复发(复发定义为第三阶段至少一次血小板计数<30×109 /L,或血小板计数未<30×109 /L 但根据研究者判断需要提前加用海曲泊帕乙醇胺),复发的中位时间为 15 天,其中 54 例患者血小板低于基线水平。在撤药阶段,基于 WHO 出血评分,有 71 例(37.8%)患者有出血症状,其中69 例为 1 级出血,未见 3~4 级出血。
对本品活性成分或任何辅料过敏者禁用。
血栓形成/血栓栓塞
当血小板计数高于正常范围时,理论上存在血栓形成/血栓栓塞并发症的风险。在 ITP 患者中开展的临床试验显示,在患者血小板计数正常或低于正常值范围时也有观察到血栓事件发生。在 IST 疗效不佳的 SAA 患者中开展的临床试验中未发现血栓形成/血栓栓塞事件的病例,但是由于暴露患者的数量有限,不能排除在该人群中发生这些事件的风险。由于 SAA 患者的给药剂量最高可达 15mg/日,结合药物作用机制,在该患者人群中也可能会出现预期的血栓相关的并发症。
临床症状或病史提示有易栓症风险因素的患者应慎用本品,包括但不限于因子 V Leiden 突变、ATⅢ缺乏、抗磷脂综合征、恶性肿瘤、避孕和激素替代治疗、长期制动、手术/外伤、高龄、肥胖及吸烟的患者。为了降低发生血栓/栓塞事件的风险,应严格遵守剂量调整方法,维持血小板计数在一定范围内,不应以达到正常血小板计数作为本品的治疗目标。应密切监测血小板计数,并在血小板计数超过一定水平时考虑减少剂量或暂停或终止本品治疗。
肝毒性
在血小板生成素(TPO)受体激动剂的同类药中出现肝胆实验室检查异常。在接受海曲泊帕乙醇胺治疗的 526 例患者中,有 2 例(0.4%)患者出现 ALT>3倍正常值上限且胆红素>2 倍正常值上限,1 例(0.2%)患者出现 AST>8 倍正常值上限。上述患者经停药治疗后,均可恢复正常或恢复至基线水平。在开始本品治疗前,应测定血清 ALT、AST 和胆红素水平。治疗期间,监测肝功能指标,建议剂量调整期间每 2 周测定一次,达到稳定剂量后,每月测定一次。如果患者肝功能指标符合以下任一项标准,则不建议使用本品或终止本品治疗:
· ALT 或 AST>8×ULN;
· ALT 或 AST>5×ULN 持续 2 周;
· ALT 或 AST>3×ULN 且(总胆红素>2×ULN 或 INR>1.5);
· ALT 或 AST>3×ULN 并伴随逐渐加重的疲劳、恶心、呕吐、右上腹疼痛或压痛、发热、皮疹和/或嗜酸性粒细胞增多(>5%)。
腹泻
在接受本品治疗的 526 例患者中,62 例(11.8%)患者发生腹泻,其中 1 例(0.2%)因腹泻暂停试验药物。消化道不良反应在血小板较低的患者中可能增加消化道出血的风险。观察到 1 例 ITP 患者在治疗期间出现腹泻后,由于消化道出血导致死亡。
治疗期间,应关注患者消化道反应。发生腹泻时可首先给予对症治疗并密切监测便常规检查,警惕消化道出血。如患者出现持续腹泻伴并发症(如便血、粪隐血阳性),应立即就医,暂停给药,尽早开始对症止血治疗。
骨髓网硬蛋白形成和骨髓纤维化风险
有报道 TPO 受体激动剂可能会增加骨髓中网硬蛋白纤维形成和发展的风险,但该风险与本类药物的相关性尚未被确定。
开始本品治疗前,应密切检查外周血涂片,明确细胞形态异常的基线水平。
确定本品治疗的稳定剂量后,应每月一次复查全血细胞计数、白细胞计数和白细胞分类。如果发现不成熟的或发育不良的细胞,应随时复查外周血涂片,查看是否有新的形态异常(如泪滴状红细胞,有核红细胞和不成熟的白细胞)、原来的形态异常情况是否加重。如果患者出现新的形态异常或者原来的形态异常情况加重,则应停止本品治疗,可考虑骨髓活检,包括染色检查纤维化情况。
克隆演变或进展风险
TPO 受体激动剂能刺激干细胞,也可能刺激增生不良骨髓中的干细胞或白血病干细胞,从而导致或加速患者的克隆演变,并最终进展为骨髓增生异常综合征(MDS)或急性髓细胞白血病(AML)。同类药在 MDS 患者中进行的临床试验中,观察到了原始细胞计数一过性增加的病例,并报道了 MDS 疾病进展为AML 的病例。在接受本品治疗的 526 例患者中,有 2 例(0.4%)SAA 患者观察到新发的染色体异常,1 例患者在用药 18 周后,出现了-7 染色体异常,最终被确诊转变为 MDS。另 1 例患者在用药 18 周后,出现了+8 染色体异常。由于 SAA患者中本身有 10%~15%的概率会出现克隆演变,故尚不能对本品是否导致克隆演变或加速其进展得出明确结论。建议 SAA 患者,在使用本品前和用药过程中定期进行骨髓检查、骨髓染色体核型分析、荧光原位杂交(FISH)或基因检测,如果检测到新的细胞遗传学异常,则必须评估是否应继续使用本品。如确定克隆演变进展为临床诊断的 MDS或 AML,则应停止本品治疗。
白内障
同类药物在啮齿动物的毒理学研究和 ITP 患者的临床试验中观察到新发白内障或者白内障恶化。在接受本品治疗的 526 例患者中,共有 3 例(0.6%)患者出现晶体混浊,2 例(0.4%)患者出现白内障,1 例(0.2%)患者出现皮质性白内障。建议在使用本品前进行白内障检查并在用药过程中进行规律监测。
QT/QTc 延长
同类药物中有报道导致 QT 间期延长的情况。在啮齿类动物的一般药理作用的实验研究中,本品未见对心血管系统有任何影响。在接受本品治疗的 526 例患者中,共有 4 例(0.8%)患者出现 QT 间期延长。但基于目前结果,尚不能对海曲泊帕乙醇胺是否导致 QT 间期延长得出明确结论。
停药后出血
在 ITP 患者临床试验中,患者撤药研究阶段未出现 3~4 级出血。大多数 ITP患者在停止使用海曲泊帕乙醇胺治疗后 2 周左右血小板下降至基线水平,血小板下降过程中,患者可能会发生出血。在合并使用抗血小板或抗凝治疗时,出血风险会增加。因此,对于停止本品治疗的患者,建议医生根据临床诊疗常规重新开始 ITP 治疗。除此之外,其他医学措施包括停止使用抗血小板和抗凝治疗,拮抗抗凝治疗或输注血小板支持。在停止使用海曲泊帕乙醇胺治疗后,需每周一次监测血小板计数,持续监测 4 周。
海曲泊帕乙醇胺疗效丧失
在海曲泊帕乙醇胺治疗过程中,如有患者在推荐剂量范围内,出现疗效丧失或不能维持血小板反应,应及时查找可能的原因,包括骨髓网硬蛋白增加。
对驾驶和机械操作能力的影响
本品对驾驶和机械操作能力几乎没有影响。在临床试验中有观察到部分患者出现头晕、眩晕、嗜睡、困倦、乏力、疲乏等不良反应。评价本品对判断力、驾驶或认知能力的影响时,应考虑到患者临床状态和本品不良反应特征,避免在眩晕和缺乏警觉性的状态下驾驶或进行机械操作。
本品在临床试验中单次应用的最高剂量为每日 40 mg。尚未报告过药物过量的病例。若出现药物过量,必须密切监测患者不良反应的症状和体征,并进行适当的对症治疗。
因本品经肾脏排泄不显著,且与血浆蛋白高度结合,预计血液透析不能有效增加本品的消除。
避孕 有生育能力的女性在使用本品治疗期间和停用本品治疗至少 7 天内应使用有效的避孕方法。 孕妇 目前尚无本品用于妊娠期女性的相关资料,尚不确定本品对人体妊娠的影响(动物数据参见【药理毒理】)。妊娠期间不应使用本品,除非预期获益超过其对胎儿的潜在风险。如孕妇或有生育能力的妇女接受本品治疗,应充分告知患者本品对胎儿的潜在风险。 生育力 尚未进行海曲泊帕乙醇胺对两性生育力的研究。本品对两性生育力的影响尚不清楚。尚不清楚本品是否分泌到人乳汁中。因为许多药物都经人乳汁排泄,因此必须考虑母乳喂养对婴儿的获益以及本品治疗对母亲的获益,再决定是否停止母乳喂养或继续/停止使用本品治疗。尚无本品用于 18 岁以下患者的临床试验数据。本品用于 65 岁及以上患者的经验有限。在本品的临床试验中,年龄 65 岁及以上的患者共 19 例(3.1%),和较年轻的患者相比,本品的安全性和有效性总体上未观察到临床显著差异。 尚无在 85 岁以上老年患者中的用药经验。
目前尚未进行体内药物相互作用研究,以下为基于体外试验的分析。
本品对其他药品的作用
BCRP 底物
体外研究证实,本品是乳腺癌耐药蛋白(BCRP)的抑制剂,联用本品可能会增加 BCRP 底物的暴露量。他汀类药物如瑞舒伐他汀、阿托伐他汀、氟伐他汀和辛伐他汀均为 BCRP 底物,目前尚无体内药物相互作用的结果,联用时应仔细监测他汀类药物的副作用,如有必要,可考虑减少他汀的用量。
CYP450 酶的底物
在 CYP450 酶体外抑制和诱导实验中,评估了海曲泊帕乙醇胺对多种 CYP酶的作用。结果显示:海曲泊帕乙醇胺对 CYP2C19、CYP2D6 和 CYP2E1 无抑制作用(IC50>50μM),对 CYP1A2、CYP2C9 和 CYP3A4 仅存在较弱的抑制(IC50>10μM),酶诱导实验结果提示其对 CYP1A2、CYP2B6 和 CYP3A4 都不具有诱导作用。
虽然未在人体中评估海曲泊帕乙醇胺对 CYP1A2、CYP2C9 和 CYP3A4 底物药代动力学的影响,根据现有体外研究结果推测,海曲泊帕乙醇胺与 CYP450 底物发生药物相互作用的可能性较低。
其他转运体
现有体外研究表明,本品不是 P-gp、OATP、OAT 和 OCT 转运体的抑制剂。
其他药品对本品的作用
UGT 抑制剂
人体微粒体研究发现多种亚型的 UGT 酶(UGT1A1、1A3、1A4、1A6、1A9、2B7 和 2B15)均参与了海曲泊帕的葡萄糖醛酸化,单个 UGT 酶对其葡萄糖醛酸化的贡献不大,本品和 UGT 抑制剂联用预计不会发生临床药物相互作用。
CYP450 酶的抑制剂和诱导剂
通过体内代谢途径判断,CYP450 代谢酶不参与海曲泊帕乙醇胺原形药物的代谢,因此联合使用本品和 CYP450 的诱导剂或抑制剂,预计不会发生临床药物相互作用。
食物相互作用
与空腹给药相比,单次口服 7.5 mg 本品后 1h 进食高脂肪高热量餐,本品的Cmax 和 AUC0-∞分别降低约 56%和 75%;单次口服 7.5 mg 本品后 2h 进食高脂肪高热量餐,本品的 Cmax和 AUC0-∞分别降低约 44%和 61%。因此建议本品空腹服用,服用 2 小时后方可进餐,避免与餐同服。
江苏恒瑞医药股份有限公司
86901445003253,86901445003239,86901445003246
海曲泊帕乙醇胺为口服可吸收的、小分子人血小板生成素(TPO)受体激动剂。在体外试验中,海曲泊帕乙醇胺可促进 TPO 受体依赖性的 32D-MPL 细胞株的增殖,促进人脐带血 CD34+细胞的增殖和分化。
因 TPO 受体独特的特异性,海曲泊帕乙醇胺不刺激大鼠、犬的血小板生成,因此,动物数据无法完全模拟海曲泊帕乙醇胺在人体中的作用。
遗传毒性
海曲泊帕乙醇胺 Ames 试验、中国仓鼠卵巢细胞基因突变试验、小鼠淋巴瘤细胞基因突变试验和小鼠体内骨髓微核试验结果为阴性
生殖毒性
生育力和早期胚胎发育毒性试验中,雄性大鼠于交配前4周至交配期结束、雌性大鼠于交配前 2 周至妊娠第 7 天经口给予海曲泊帕乙醇胺 10、50、200 mg/kg/天(以体表面积计,分别相当于 SAA 患者 15 mg/天剂量的 6.5、32、129 倍,相当于 ITP 患者 7.5 mg/天剂量的 13、64、258 倍),200 mg/kg/天剂量下精子活动度降低,雌鼠黄体数、着床数降低,活胎数降低,着床后丢失率增加,未见毒性反应剂量(NOAEL)为 50 mg/kg/天。胚胎-胎仔发育毒性试验中,大鼠于妊娠第 6~15 天经口给予海曲泊帕乙醇胺 10、50、200 mg/kg/天(以 AUC 计,分别相当于 SAA 患者在 15 mg/天剂量时稳态暴露量的 1.5、38.2、128.6 倍,相当于 ITP 患者在 7.5 mg/天剂量时暴露量的11.0、281.6、947.9 倍),200 mg/kg/天剂量下胎仔体重降低,未见致畸性。兔于妊娠第 6~19 天皮下注射给予海曲泊帕乙醇胺 0.5、2.5、7.5 mg/kg/天(以 AUC计,相当于 SAA 患者在 15 mg/天剂量时稳态暴露量的 0.2、3 和 11 倍,相当于ITP 患者在 7.5 mg/天剂量时暴露量的 1.8、19.7 和 81.2 倍),可见母体毒性,胎仔动脉分支异常发生率呈剂量相关性升高;兔活胎仔中可检测到药物,说明可通过胎盘屏障。围产期毒性试验中,大鼠于妊娠第 6 天至哺乳期结束(哺乳第 21 天)经口给予海曲泊帕乙醇胺剂量达 50 mg/kg/天(以 AUC 计,相当于 SAA 患者在 15mg/天剂量时稳态暴露量的 26 倍,相当于 ITP 患者在 7.5 mg/天剂量时暴露量的189.6 倍)时,对母体和子代发育未见不良影响;母体乳汁和子代(F1 代)血浆中可检测到药物,母体给药后子代的血药浓度随剂量而升高,说明可通过血乳屏障。
致癌性
在 Tg.rasH2 转基因小鼠 6 个月致癌性试验和大鼠 2 年致癌性试验中,小鼠经口给予海曲泊帕乙醇胺达 300 mg/kg/天(以 AUC 计,相当于 SAA 患者在 15mg/天剂量时稳态暴露量的 9.6 倍,相当于 ITP 患者在 7.5 mg/天剂量时暴露量的70.7 倍),大鼠剂量达 15 mg/kg/天(以 AUC 计,相当于 SAA 患者在 15 mg/天剂量时稳态暴露量的8.5倍,相当于ITP患者在7.5 mg/天剂量时暴露的62.7倍),未见致癌性。
幼龄动物毒性
大鼠于 7~9 日龄开始每天一次连续 8 周灌胃给予海曲泊帕乙醇胺 3、15 和45 mg/kg(以 AUC 计,分别相当于 SAA 患者在 15 mg/天剂量时稳态暴露量的0.3、7、33 倍),15、45 mg/kg 剂量下眼科检查异常发生率略高(玻璃体或晶状体异常),雌性动物自主活动略有减少,未见明显的全身毒性反应和发育毒性。
ITP 患者中Ⅲ期临床试验(HR-TPO-Ⅲ-ITP)
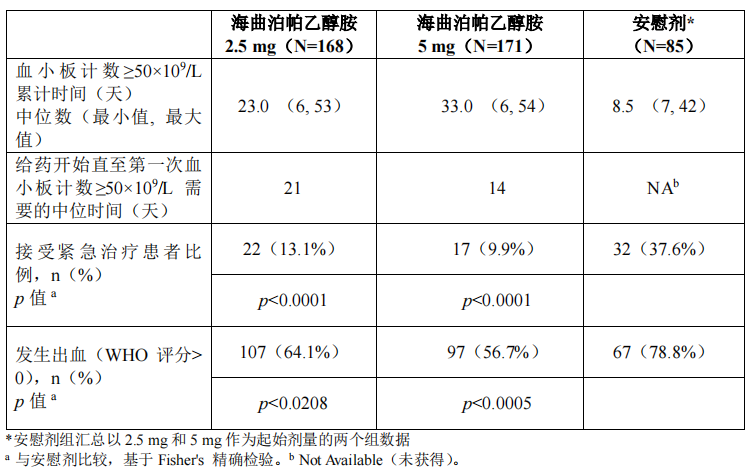
本研究为在既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(ITP)成人患者中进行的多中心、随机、对照Ⅲ期临床试验。研究包含 10 周随机、双盲、安慰剂平行对照研究(第一阶段),有效性评估主要终点为服药 8 周血小板计数≥50×109 /L 的患者百分比。完成第一阶段随机、双盲、安慰剂平行对照研究后,未达到退出标准的患者可自愿参加 14 周的开放、阳性药对照阶段(第二阶段);最多持续 6 周的撤药阶段(第三阶段),及 24 周单臂延伸阶段(第四阶段)。共 424 例患者随机入组,入组患者分别分配到海曲泊帕乙醇胺 A 组(海曲泊帕乙醇胺起始剂量为 2.5 mg,N=168)、海曲泊帕乙醇胺 B 组(海曲泊帕乙醇胺起始剂量为 5 mg,N=171)、安慰剂 A 组(安慰剂起始剂量为 2.5 mg,N=43)、以及安慰剂 B 组(安慰剂起始剂量为 5 mg,N=42)。海曲泊帕乙醇胺 2.5 mg、5 mg 与安慰剂组基线血小板计数平均值相似(分别为 13.64×109 /L、13.67×109 /L和 13.31×109 /L)。治疗期间根据血小板计数进行调整,最高给药剂量为 7.5 mg/日。服药 8 周后,接受海曲泊帕乙醇胺治疗的患者中,81.4%的患者可达到稳定治疗剂量,其中 46.0%的患者稳定在≥5 mg/日治疗剂量。有效性评估主要终点为第一阶段服药 8 周血小板计数≥50×109 /L 的患者百分比,海曲泊帕乙醇胺 2.5 mg 和 5 mg 组分别为 58.9%和 64.3%,均显著高于安慰剂组(5.9%)(p<0.0001)。有效性评估次要终点结果见表 6。
表 6 HR-TPO-Ⅲ-ITP 有效性评估次要终点结果——第一阶段服药后 8 周内(全分析集)
免疫抑制治疗疗效不佳的 SAA 研究(HR-TPO-SAA-Ⅱ)
这是一项多中心、单臂、开放标签的Ⅱ期临床试验,评价了海曲泊帕乙醇胺在免疫抑制治疗(
IST)疗效不佳的重型再生障碍性贫血患者中的有效性和安全性。研究入组既往至少接受过一次标准 IST 治疗,基线血小板计数≤30×109/L,且对前一次标准 IST 治疗反应不佳(定义为 IST 治疗 6 个月后未达到部分反应标准)的成人重型再生障碍性贫血患者。
研究的主要疗效终点为治疗第 18 周时获得血液学应答的患者比例。血液学应答定义为至少达到以下三项中的一项:1)血小板较基线增加≥20×109/L,或依赖血小板输注的患者至少连续 8 周不需输注血小板;2)血红蛋白较基线增加≥1.5g/dL,或依赖红细胞输注的患者连续 8 周红细胞输注量减少 4 个单位及以上;3)中性粒细胞较基线增加一倍及以上或增加>0.5×109 /L,或依赖使用 G-CSF 的患者至少连续 2 周不再使用 G-CSF。共入组 55 例患者,中位年龄为 40.0 岁,年龄小于 65 岁占 98.2%。男性和女性分别占 61.8%和 38.2%。基线时 ECOG 评分 0-1 分占 81.8%,既往接受标准 IST治疗次数均为 1 次。其中 50 例(90.9%)为原发难治患者(定义为首次 IST 治疗6 个月后未达到部分反应标准)。患者基线时血小板计数的中位数为 10.0×109 /L,血红蛋白的中位数为 6.4 g/dL,中性粒细胞的中位数为 0.69×109 /L。90.9%的患者入组前依赖血小板输注,92.7%的患者入组前依赖红细胞输注,52.7%的患者入组前依赖使用 G-CSF。
结果显示,18 周获得血液学应答的患者人数为 23 人,比例为 41.8%(95%CI:28.7%,55.9%),其中获得一系应答的比例为20.0%,两系应答的比例为10.9%,三系应答比例为 10.9%。
24 周获得血液学应答的患者人数为 24 人,比例为 43.6%(95% CI:30.3%,57.7%),其中获得一系应答的比例为 23.6%,两系应答的比例为 3.6%,三系应答比例为 16.4%。24 人中有 22 人(
91.7%)在 52 周仍维持血液学应答。对于研究期间获得血液学应答的患者,由于复发人数少,故中位缓解时间尚未达到。9 个月和 12 个月血液学缓解持续无复发生存率均为 82.2%(95% CI:
62.2%,92.2%)。研究期间 18.0%的患者不再依赖血小板输注,27.5%不再依赖红细胞输注,34.5%不再依赖使用 G-CSF。基于上述Ⅱ期单臂临床试验的结果附条件批准本适应症。该适应症的完全批准将取决于正在进行的确证性临床试验的结果。
吸收
海曲泊帕口服给药后 7~8 小时达到峰浓度。健康人单次给药和多次给药后血药浓度-时间曲线均呈现双峰现象,即给药后 1~2 小时血药浓度首次达峰,在给药后 7~8 小时血药浓度第二次达峰。口服吸收受食物影响十分显著,给药与进食间隔时间越短,暴露量降低的程度越明显(参见【食物相互作用】)。
分布
本品与人血浆蛋白结合率较高(>99%),与血细胞无显著结合。体外现有结果显示,本品是 BCRP 的底物,但不是 P-gp、OATP1B1 或 OATP1B3 的底物。
代谢
本品的代谢主要通过肼键裂解、葡萄糖醛酸结合、乙酰化和丙酰化。在人体内的放射标记药物研究中,海曲泊帕乙醇胺约占血浆中总放射性碳 AUC0-t的24%,血浆中检测到的主要代谢产物为葡萄糖醛酸结合物 M5。肼键裂解产物以及裂解产物的次级代谢产物在粪和尿中被检测到。体外研究提示多种亚型的二磷酸尿苷葡萄糖醛酸转移酶(UGT1A1、1A3、1A4、1A6、1A9、2B7、2B15)参与了葡萄糖醛酸结合反应,胃肠道中的细菌可能参与了药物的肼键断裂反应。
消除
本品吸收后被广泛代谢。其排泄的主要途径是通过粪便排出(89.05%),其中原形药物海曲泊帕乙醇胺约占给药剂量的 49.20%;其次是从尿中排出(8.62%),检测到的原形药物海曲泊帕乙醇胺占给药剂量 1.07%。血浆中海曲泊帕的消除半衰期约为 11.9~40.1 小时。
特殊患者人群
肝功能不全患者:
目前尚未针对肝功能不全患者进行单独的药代动力学研究。
肾功能不全患者:
目前尚未针对肾功能不全患者进行单独的药代动力学研究。健康受试者口服[ 14C]标记海曲泊帕乙醇胺后,不足 10%的放射性物质经尿排泄,提示肾脏排泄不是海曲泊帕乙醇胺的主要消除途径,推测肾功能损害对药物的暴露量影响有限。
片剂
按 C25H22N4O5 计(1)2.5 mg;(2)3.75 mg;(3)5 mg。
本品采用聚氯乙烯固体药用硬片和药用铝箔为泡罩包装材料,外加铝箔 袋(袋内置干燥剂),热合密封包装。7 片/板,2 板/袋/盒。
遮光,密封,25℃以下保存。
5560元起
12 个月。
国药准字H20210021,国药准字H20210022,国药准字H20210023


