孚来美说明书
Polyethylene Glycol Loxenatide Injection
聚乙二醇洛塞那肽
本品主要成份为聚乙二醇洛塞那肽。 化学名称:组氨酰-D-丙氨酰-谷氨酰-甘氨酰-苏氨酰-苯丙氨酰-苏氨酰-丝氨酰-门冬氨酰亮氨酰-丝氨酰-赖氨酰-谷氨酰氨酰-正亮氨酰-谷氨酰-谷氨酰-谷氨酰-丙氨酰-缬氨酰-精氨酰亮氨酰-苯丙氨酰-异亮氨酰-谷氨酰-色氨酰-亮氨酰-赖氨酰-谷氨酰氨酰-甘氨酰-甘氨酰-脯氨酰-丝氨酰-丝氨酰-甘氨酰-丙氨酰-脯氨酰-脯氨酰-脯氨酰-硫-[(3RS)-1-{3-[(2-{Nα,Nε-二[ω-甲氧基聚(氧乙烯基)羰基]赖氨酰胺}-乙基)氨基]-3-氧丙基}-2,5-二氧吡咯烷-3-基]半胱氨酰胺。
分子式:C210H325N55O69S·(C2H4O)2n
分子量:44212.65±4000Da
辅料:醋酸钠、醋酸、甘露醇和注射用水。
化学结构式:
本品为无色或几乎无色的澄明液体。
本品配合饮食控制和运动,单药或与二甲双胍联合,用于改善成人2型糖尿病患者的血 糖控制。
单药治疗:对于饮食控制和运动基础上血糖控制不佳的患者,本品推荐起始剂量为0.1mg,每周(7天)一次腹部皮下注射,如血糖控制效果不满意,可增加到0.2mg,每周一次。 联合治疗:对于二甲双胍基础用药血糖控制不佳的患者,本品推荐剂量为0.1mg,每周一次。 应每周(7天)给药一次,可以在一天中任何时间(进餐前或进餐后)使用。忘记注射时,如果与下次计划注射时间超过3天,可以立即给予补充注射;如果与下次计划注射时间少于或等于3天,则无需补充注射。两针之间应至少间隔3天。改变给药计划后应重新调整注射时间表。 不能静脉或肌肉注射。建议经常变换腹部注射部位,避免长期注射腹部同一部位。 每次注射前应检查药品,如注射液出现颗粒或溶液出现浑浊不透明,切勿使用。 针对预灌封注射器的使用说明:注射时,一手拇指和食指轻轻将注射部位的皮肤及皮下脂肪轻轻提起,另一手持注射器,针头斜面向上,与皮肤保持30~40°倾斜角度或垂直快速刺入皮下(低体重患者建议30~40°角进针)。进针尝试根据皮下脂肪厚度,通常针头刺入深度为0.5~1.0cm,回抽无回血后注入药液。 针对笔式注射器的使用说明:市售的胰岛素注射笔不适用于本品,本品需装配于配套的笔式注射器中使用,使用方法及注意事项详见后附的配套笔式注射器使用说明书。 特殊人群用药说明: 肾功能不全患者:轻度肾功能不全患者无需调整剂量,中度肾功能不全患者如需使用应降低剂量。本品未在重度肾功能不全患者中开展研究。 尚无肝功能不全患者临床数据。 老年人用药剂量无需调整。 不建议18岁以下患者使用本品。
聚乙二醇洛塞那肽的临床研究总共进行了 13 个临床试验,总共约 1200 多人至少注射了 1 次(表 1)。

本品进行了单药治疗及与二甲双胍联合治疗的两个 III 期试验,均包括了 24 周的核心治疗期及 28 周的延伸治疗期,总治疗时间为 52 周。安全性结果均显示本品主要的不良反应为胃肠道不良反应,这与胰高血糖素样肽-1(GLP-1)受体激动剂的药理作用机制有关。胃肠道不良反应主要为:恶心、呕吐、腹泻等,但发生率均较低,而且多为一过性,严重程度多为轻中度,无重度不良反应。临床试验中,有低血糖事件发生,但是发生率较低。详细的不良反应如下:
● 胃肠道不良反应
1.单药治疗
单药治疗 24 周后,安慰剂组、本品 0.1 mg 和 0.2 mg 组总体不良反应发生率分别为 15.45%、13.49%、28.33%。0.2 mg 组不良反应发生率高于安慰剂组和 0.1 mg 组,主要由于较高的胃肠道不良反应所致。常见的胃肠道不良反应包括恶心、呕吐、腹泻等。
其中恶心和呕吐的发生率与剂量成正相关,严重程度多是轻度或者中度,且多为一过性。单药治疗核心期各组发生率 ≥ 5% 的不良反应详情见表 2:
表 2 单药治疗核心期各组发生率 ≥ 5% 的不良反应(%)

2.二甲双胍合并治疗
联合二甲双胍核心期治疗 24 周后,安慰剂组、本品 0.1 mg 组和 0.2 mg 组总体不良反应发生率分别为 7.7%、10.4%、17.4%。和单药治疗试验一样,0.2 mg 治疗组不良反应率与 0.1 mg 组、安慰剂组比有升高趋势,这主要是由较高的胃肠道不良反应所致。延伸期不良反应发生率较核心期明显下降。核心期和延伸期均未发生 ≥ 5% 的不良反应。
● 低血糖
单药治疗各组低血糖发生率均较低,核心期低血糖发生率见表 3,无严重低血糖发生;进入延伸期后,各组低血糖发生率均<2% 且无剂量相关性;无严重低血糖发生。
与二甲双胍合用 24 周,低血糖发生率见表 3。各组低血糖发生率均较低且未见剂量相关性,所有低血糖均为轻度。延伸期各组低血糖发生率均<2% 且无剂量相关性;无严重低血糖发生。
表 3 本品单药及与二甲双胍合并治疗核心期低血糖发生率

● 注射部位不良反应:
单药治疗试验在 0.2 mg 治疗组有一例受试者在核心期内出现 6 次注射部位反应,研究者判断与研究药物可能有关,严重程度为 1 级(轻度)。该受试者完成 52 周随访,在延伸期未出现注射部位不良反应。
与二甲双胍联合治疗试验 0.2 mg 治疗组一例受试者在延伸期出现 1 次注射部位出血,研究者判断与研究药物可能有关,严重程度为 1 级(轻度)。
● 免疫原性:
患者在接受本品治疗后可能会产生抗药抗体。单药和二甲双胍联合治疗试验总共分析了来自 977 名受试者的血清样本,51 名受试者检出阳性抗体,总抗体阳性率为 5.2%,各治疗组抗体发生率不超过 6.73%。
在 24 周时,抗体阳性的受试者 0.1 mg 治疗组(5 例)HbA1c 下降 0.5%、0.2 mg 治疗组(4 例)HbA1c 升高 0.13%,而抗体阴性的受试者在 0.1 mg 治疗组(264 例)HbA1c 下降 1.0%、0.2 mg 治疗组(250 例)HbA1c 下降 1.2%;在 52 周时,抗体阳性的 35 例受试者,平均 HbA1c 降低 0.26%,抗体阴性的 751 例受试者,平均 HbA1c 降低 0.97%。阳性抗体可能对疗效产生一定的影响。
● 肝毒性
本品未对肝脏产生有害影响。两个 III 期试验核心期的肝功能相关不良事件总数为 26 人,占全体受试者 2.9%。核心期肝功能异常不良事件发生率,安慰剂组为 2.0%(6 例),本品 0.1 mg 治疗组为 3.2%(10 例),本品 0.2 mg 治疗组为 3.4%(10 例),在 0.2 mg 治疗组除 1 例受试者因既往合并乙肝、酒精性肝硬化代偿期而肝功能相关异常达到 3 级,研究者判断可能无关,其他肝功能异常均为轻中度,大部分受试者转归为恢复/治愈。延伸期不良事件和核心期相当。
● 脂类代谢
未发现本品对脂类代谢有影响。
● 其它
单药及与二甲双胍合并治疗的两个 III 期试验中发生率 ≥ 1% 的不良反应见下表。


禁用于甲状腺髓样癌、甲状腺髓样癌家族史或有多发性内分泌肿瘤综合征 2 型(MEN-2) 的患者。 对聚乙二醇洛塞那肽或本品中任何组份既往有严重过敏反应的患者禁用。
甲状腺C细胞肿瘤的风险 聚乙二醇洛塞那肽在大鼠中高剂量暴露时可引起甲状腺C细胞肿瘤,但未知在人体中是否会引起甲状腺C细胞肿瘤的发生,包括甲状腺髓样癌(MTC),因为目前未在人体研究中发现与甲状腺C细胞相关的不良事件(见【注意事项】)。 在有甲状腺髓样癌(MTC)个人或嘉泽史患者和多发性内分泌肿瘤综合征2型(MEN-2)患者中禁用聚乙二醇洛塞那肽(见【禁忌】)。
●甲状腺髓样癌(MTC):临床前动物试验中发现本品高剂量下可致大鼠甲状腺C细胞腺瘤。虽然在本品临床试验中未发现与甲状腺C细胞相关的不良反应,而且无充分证据表明本品会导致人体甲状腺C细胞肿瘤的发生,包括MTC,但仍然建议有甲状腺髓样癌、甲状腺髓样癌家族史或有多发性内分泌肿瘤综合征2型(MEN-2)的患者禁用本品。 ●急性胰腺炎:因GLP-1受体激动剂类药物有少数急性胰腺炎不良事件报告,如果患者有明确的胰腺炎病史,不建议使用本品。如接受本品治疗的患者出现剧烈的腹痛并伴有呕吐时,应该怀疑有发生急性胰腺炎的可能,需立即停止使用本品,并同时进行确诊检查及适时的治疗。本品在1200多例受试者中进行过临床试验,仅二甲双胍合并治疗试验中报告1例急性胰腺炎严重不良事件,该受试者为0.2mg剂量组,在急性胰腺炎发作前有暴饮暴食的病史,因此判断与研究药物可能无关。 ●因本品主要不良反应为胃肠道不良反应,包括:恶心、呕吐和腹泻,因此不建议有严重胃肠道疾病患者使用本品。 ●对驾驶和机械操作能力的影响:尚未研究本品对驾驶和机械操作能力的影响。应告知患者在驾驶和操作机械时预防低血糖发生。 ●过敏反应:未在临床研究中发现有过敏反应;如果在使用本品时出现过敏反应,应立即停止使用并给予医学对症处理。 ●本品不得用于1型糖尿病患者或治疗糖尿病酮症酸中毒。 ●建议在中度肾功能不全(肌酐清除率<60ml/min)患者使用本品时降低剂量,当中度肾功能不全患者在使用本品时,从0.1mg上升到0.2mg剂量时需慎重。因未在重度(肌酐清除率<30ml/min)及终末期肾功能不全受试者中进行研究,因此不建议在上述患者中使用本品。 ●对2个III期试验的受试者进行心脑血管不良事件汇总分析,结果显示在核心期各组不良事件发生率未见明显差异,安慰剂、本品0.1mg剂量组、0.2mg剂量组的不良事件发生率分别是2.6%、1.0%和4.4%,不良反应发生率安慰剂组为0.3%(1例),本品治疗组均未见心脑血管不良反应发生,延长用药(最长为52周)亦未见相关不良事件发生率升高。 ●在临床试验中未发现本品对肝脏和脂质代谢的不良影响,而且GLP-1类降糖药物未见报道GLP-1对肝脏引起损害。另外,PEG-肽类物质主要由尿中排出,少量从胆汁和粪中排出,导致肝功能异常也很少有报道。但本品尚无肝功能不全患者中研究数据,不建议肝功能异常患者使用。对于长期使用本品的患者应关注肝功能和脂质代谢的影响。
在发生药物过量的事件中,应按照患者临床体征和症状开始适当支持治疗。
本品尚未在妊娠期妇女中进行充分和对照良好的研究。不建议在妊娠期妇女中使用本品。目前尚未明确本品能否通过乳汁分泌。不建议哺乳期妇女使用本品。尚未明确18岁以下患者中使用本品的安全性和有效性。因此,不建议18岁以下患者使用本品。本品未在年龄大于78岁的患者中进行研究。有限的临床数据显示,老年患者用药无需调整剂量。
关于胃排空 GLP-1受体激动剂类药物通常有延缓胃排空的作用,但同类药物的胃排空试验没有检测到GLP-1对口服药物吸收有任何临床相关程度的影响,因而本品未进行专门的胃排空试验。对于接受需经胃肠道快速吸收的口服药物的患者,建议谨慎使用。对于一些延长释放制剂,由于胃部停留时间延长所致的释放增加可能会略增加药物暴露。 在健康受试者中分别进行了本品与地高辛、华法林和辛伐他汀的药物间相互作用研究。在这些试验中,本品对上述药物的药代动力学不存在具有临床意义的影响,地高辛、华法林和辛伐他汀在临床上与本品合并使用时无需调整剂量。 地高辛 在健康受试者中,与单独服用地高辛相比,地高辛(0.5mg、单剂量)与重复剂量的本品(每次0.2mg、每周1次、连续5周)合用,地高辛的Tmax、Cmax和AUC无明显改变,合并用药时地高辛的肾清除率略微降低(12.8%,5.82±1.25L/h相对于6.68±1.23L/h)。 华法林 在健康受试者中,与单独服用华法林相比,华法林(5mg、单剂量)与重复剂量的本品(每次0.2mg、每周1次、连续5周)合用后,S-华法林和R-华法林的Cmax和AUC均无明显变化,也未观察到华法林药效学(根据PT、INR反应评估)特性的显著改变。 辛伐他汀 在健康受试者中,与单独服用辛伐他汀相比,辛伐他汀(40mg、单剂量)合用重复剂量的本品(每次0.2mg、每周1次、连续5周)后,辛伐他汀在合并用药和单独给药条件下Cmax的几何均数比为97.9%(73.2%,131%),AUC0-24的几何均数比为81.9%(64.8%,103%);辛伐他汀酸在合并用药和单独给药条件下Cmax的几何均数比为132%(107%,164%),AUC0-24的几何均数比为121%(102%,143%)。结果显示,本品可使辛伐他汀体内暴露量略降低,辛伐他汀酸体内暴露量略增加,但未呈现明显临床意义,建议临床使用无需进行剂量调整。
江苏豪森药业集团有限公司
86901444001014,86901444001007
聚乙二醇洛塞那肽是一种 GLP-1 受体激动剂。GLP-1 是内源性肠促胰岛素激素,聚乙 二醇洛塞那肽特异性作用于 GLP-1 受体,促进胰腺 β 细胞葡萄糖依赖性胰岛素分泌,减少 胰高血糖素分泌,延缓胃排空。
一般毒理
猴180天重复给药毒性试验:猕猴每周1次皮下注射给予聚乙二醇洛塞那肽,3.0 mg/kg
剂量下可见对外周免疫系统的抑制作用。
猴 270 天重复给药毒性试验:恒河猴每周 1 次皮下注射给予聚乙二醇洛塞那肽 0.05、
0.15、0.3mg/kg(以洛塞那肽计),各给药组均可见药理作用相关的一过性血糖降低和摄食
量下降。≥0.15mg/kg 剂量组动物可见血液学指标轻度异常改变,给药结束和恢复期可检测
到中和抗体。
遗传毒性
聚乙二醇洛塞那肽 Ames 试验、中国仓鼠肺成纤维(CHL)细胞染色体畸变试验、小鼠
骨髓细胞微核试验结果均为阴性。
生殖毒性
雄性大鼠于交配前 4 周开始、雌性大鼠于交配前 2 周至妊娠第 7 天,皮下注射给予聚乙二醇洛塞那肽 1、3、10mg/kg(以洛塞那肽计),每周 2 次,≥1mg/kg 剂量下雌雄大鼠
均可见体重/增重降低、摄食量减少,雄性大鼠可见附睾重量轻微降低。10mg/kg 剂量下未
见对大鼠生育力和胚胎发育的不良影响。
妊娠大鼠于胚胎着床至硬腭闭合期皮下注射给予聚乙二醇洛塞那肽 1.5、5、15mg/kg
(以洛塞那肽计),每周 2 次,在>1.5mg/kg 剂量下可见母鼠体重和摄食量降低,在 15mg/kg
剂量下未见明显致畸性。妊娠兔于胚胎着床至硬腭闭合期皮下注射给予聚乙二醇洛塞那肽
0.01、0.05、0.15mg/kg(以洛塞那肽计),每周 2 次,在≥0.05mg/kg 剂量下可见孕兔体重
/增重、摄食量下降,活胎体重、顶臀长、胎盘重量降低,胎仔发育迟缓。在 0.01mg/kg 剂
量下未见母体和胚胎-胎仔毒性。
妊娠大鼠于妊娠第 6 天至离乳皮下注射给予聚乙二醇洛塞那肽 0.03、0.1、0.3mg/kg(以
洛塞那肽计),每周 2 次,在≥0.1mg/kg 剂量下可见母鼠体重/增重和摄食量降低,哺乳期
幼仔死亡率明显增高,可能与药理作用导致的食欲低下有关。在≥0.03mg/kg 剂量下可见幼
仔出生后体重降低和发育迟缓。
致癌性
大鼠2年致癌性试验:大鼠皮下注射给予聚乙二醇洛塞那肽 0.01、0.05、0.30mg/kg
(以洛塞那肽计),每周2次,连续给药104周。结果未见恶性肿瘤发生率升高,肿瘤潜伏
期未见变化,肿瘤的多发性未受影响。与给药相关的病理学改变是在0.30mg/kg剂量下甲
状腺C细胞腺瘤、注射部位皮肤及皮下组织炎性细胞浸润及纤维组织增生。
转基因小鼠 26 周致癌性试验:Tg.rasH2 转基因小鼠皮下注射给予聚乙二醇洛塞那肽
0.05、0.15、0.50mg/kg(以洛塞那肽计),每周 2 次,连续 26 周。≥0.15mg/kg 剂量下可见
脾脏恶性淋巴瘤、白血病、肠系膜淋巴结癌,在 0.05~0.50mg/kg 剂量下小鼠肾积水发生率
升高。
1.单药治疗
在单药治疗 2 型糖尿病患者的 III 期试验中,一共随机入组 406 例受试者,分别接受本品 0.1 mg、0.2 mg 或安慰剂每周一次皮下注射治疗,总的研究时间包括 24 周的核心治疗期及 28 周 延伸治疗期,疗效结果显示如下:
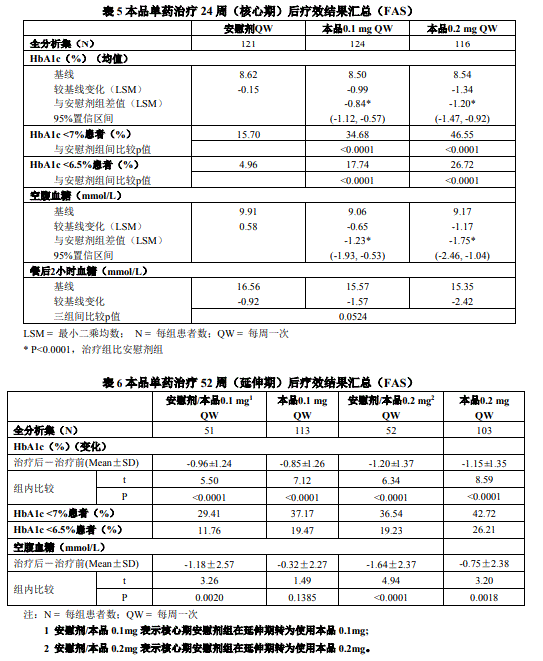
● 主要疗效指标:用药 24 周后,本品 0.1 mg、0.2 mg 相对于安慰剂组能够更显著地改善 HbA1c 水平,且 0.2 mg 组降低 HbA1c 的效果强于 0.1 mg 组;
● 用药 24 周后,本品 0.1 mg 组、0.2 mg 组 HbA1c<6.5% 和<7% 达标率、给药后空腹血浆葡萄糖两治疗组均优于安慰剂组且有显著差异;用药 24 周及 52 周,与安慰剂组相比,各组体重、血压、血脂方面的下降均不显著;
● 本品 0.1 mg、0.2 mg 持续治疗 52 周时仍能维持 HbA1c 的降低水平。
● 单药治疗核心期(24 周)各疗效指标结果请参见表 5,单药治疗延伸期(25-52 周)各疗效指标结果请参见表 6 。
2.与二甲双胍合用治疗
在本品和二甲双胍( ≥ 1500 mg/日)联合治疗的 III 期试验中,总共随机入组 573 例受试者,分别接受每周一次本品 0.1 mg、0.2 mg 或安慰剂皮下注射治疗,总的研究时间包括 24 周的核心治疗期及 28 周延伸治疗期。疗效结果显示如下:
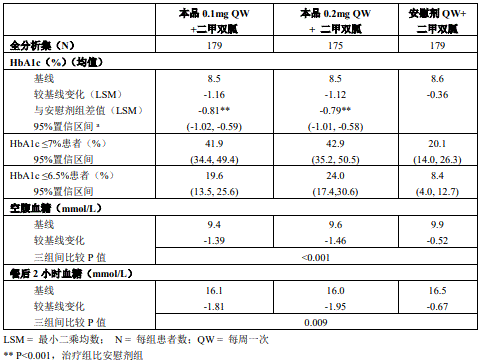
● 主要疗效指标:用药 24 周后,安慰剂组、本品 0.1 mg 组、0.2 mg 组相对于安慰剂能够显著地改善 HbA1c 水平,但本品两个剂量组之间未见明显差别;
● 用药 24 周后,本品 0.1 mg 组、0.2 mg 组 HbA1c<6.5% 和 < 7% 达标率、给药后空腹及餐后 2 小时血浆葡萄糖均优于安慰剂组且有显著差异;
● 与安慰剂相比,本品在体重、血压、血脂方面的下降均不显著;
● 本品 0.1 mg、0.2 mg 持续治疗 52 周时仍能维持 HbA1c 的降低水平。
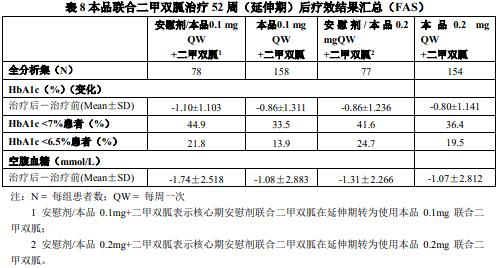
与二甲双胍联合治疗(24 周)各治疗组疗效指标结果详情请参见表 7,联合治疗延伸期(28-52 周)各疗效指标结果请参见表 8:
表 7 本品联合二甲双胍治疗 24 周(核心期)后疗效结果汇总(FAS)
吸收
健康受试者单次上臂皮下注射本品 0.1 mg~0.3 mg 后,平均达峰时间约为 118 小时,暴露量(以 Cmax和 AUC 计)与剂量呈比例增加。与低剂量相比,0.3 mg 多次给药后的暴露量增加幅度低于剂量增加比例。
与腹部皮下注射相比,上臂皮下注射暴露量(以 Cmax和 AUC 计)均降低,相对生物利用度约为 70%,两种给药方式达峰时间无显著差异。
2 型糖尿病患者上臂皮下多次注射本品 0.05 mg~0.3 mg 后,平均达峰时间约为 67 小时。暴露量(以 AUC 和 Cmax计)随剂量增大而增加,但增加幅度低于剂量增加比例。0.05 mg 组 2 型糖尿病患者连续五次给药后,血药浓度达稳态,0.1 mg~0.3 mg 组 2 型糖尿病患者连续四次给药后血药浓度达稳态。
0.05 mg~0.3 mg 多次给药的稳态暴露量相对于单次给药的暴露量有蓄积,平均蓄积比约为 2.555~3.266。
分布
健康受试者中,0.1 mg~0.3 mg 单次给药的平均表观分布容积为 2.91~3.13L。2 型糖尿病患者中,0.1 mg~0.3 mg 多次给药的平均表观分布容积为 2.72~5.43L。
代谢和清除
聚乙二醇洛塞那肽是一种化学合成多肽 PEG 衍生化产物,经典生物转化研究尚未进行。
临床前研究已证实,聚乙二醇洛塞那肽在大鼠体内,主要以原形通过肾脏清除。健康受试者 0.1 mg~0.3 mg 单次给药体内平均药物清除率约为 13.37~14.73 mL/h,平均半衰期约为 144~155 小时。2 型糖尿病患者 0.1 mg~0.3 mg 单次给药体内平均清除率约为 14.55~19.54 mL/h,平均半衰期约为 104~121 小时。
特殊人群
肾功能不全:
肾功能不全受试者药代动力学研究结果显示,相对于正常肾功能受试者,轻度肾功能不全患者使用本品 0.2 mg 后 AUC0-inf 增加 13.1%,Cmax降低 14.4%;中度肾功能不全患者使用本品后 AUC0-inf增加 100.7%,Cmax增加 29.1%。
肝功能不全:
本品未进行急性或慢性肝功能受损患者的药代动力学研究。
老年患者:未在老年患者中进行 PK 研究。
儿童:未在儿童患者中进行 PK 研究。
性别:
根据人体药代动力学研究和 III 期临床试验人群亚组分析的结果,性别未对本品药代动力学产生有临床意义的影响。
体重:
无需根据体重指数调整剂量。本品单药和联合二甲双胍合并治疗 2 型糖尿病的 2 个 III 期试验中,按体重指数(BMI) ≥ 24 kg/m2及<24 kg/m2对受试者进行分层亚组分析,结果未显示两亚组之间疗效的差别。临床研究未纳入 BMI<20.0 kg/m2和 > 40.0 kg/m2的受试者。
注射剂
0.5ml:0.1mg(以C187H288N50O59S计);0.5ml:0.2mg(以C187H288N50O59S计)
(1)预灌封注射器组合件(带注射针),1支/盒。 (2)笔式注射器单独包装。笔芯(卡式瓶)由笔式注射器用硼硅玻璃套筒、笔式注射 器用溴化丁基橡胶活塞、笔式注射器用铝盖组成,1支/盒。
遮光,密闭,冷藏(2~8℃)保存。
255.00元起
18个月
国药准字H20190024,国药准字H20190025