欧狄沃说明书
Nivolumab Injection
纳武利尤单抗
活性成份:纳武利尤单抗(Nivolumab),一种针对程序性死亡 1(PD-1)受体的人源化单克隆抗体(IgG4亚型)。 辅料:枸橼酸钠二水合物、氯化钠、甘露醇、喷替酸、聚山梨酯80、盐酸、氢氧化钠、注射用水。
澄清至乳光,无色至淡黄色液体,可能存在少量(极少)颗粒。
非小细胞肺癌(NSCLC)
本品单药适用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
头颈部鳞状细胞癌(SCCHN)
本品单药适用于治疗接受含铂类方案治疗期间或之后出现疾病进展且肿瘤PD-L1 表达阳性(定义为表达 PD-L1 的肿瘤细胞≥1%)的复发性或转移性头颈部鳞状细胞癌(SCCHN)患者。
该适应症是基于 CheckMate 141 临床研究中 PD-L1 阳性头颈部鳞癌受试者的分析结果给予的附条件批准。该适应症的完全批准将取决于后续开展临床试验证实本品在中国人群的临床获益(见【临床试验】)。
胃或胃食管连接部腺癌本品可用于治疗既往接受过两种或两种以上全身性治疗方案的晚期或复发
性胃或胃食管连接部腺癌患者。
恶性胸膜间皮瘤(MPM)
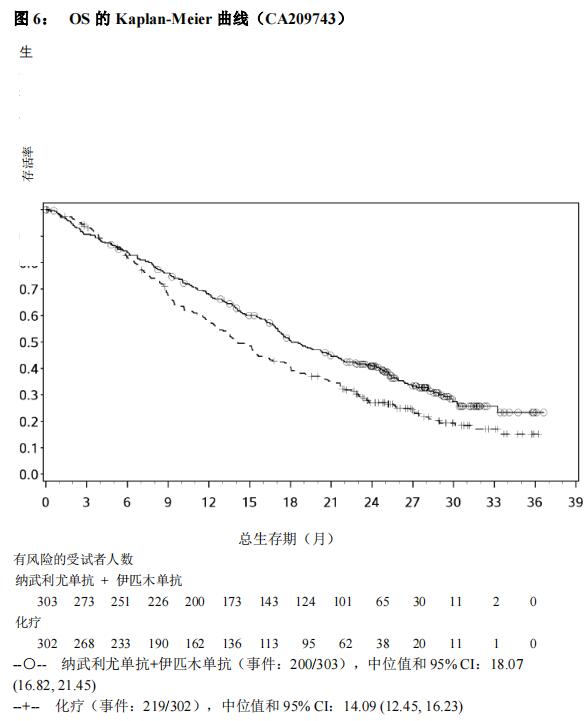
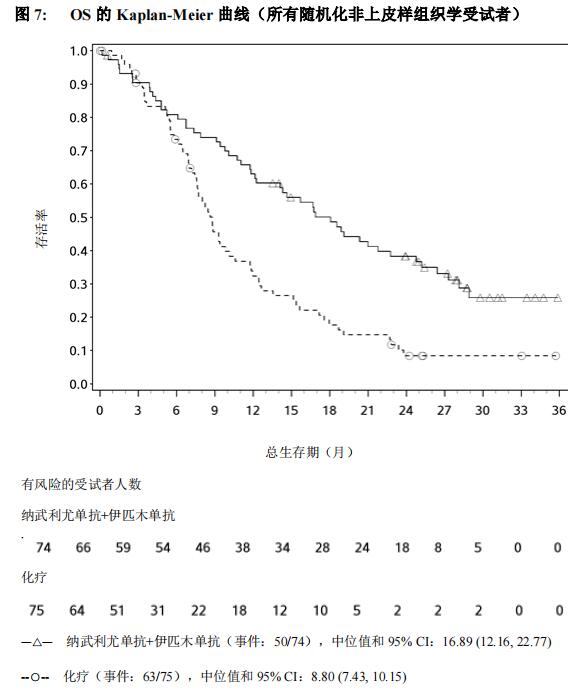
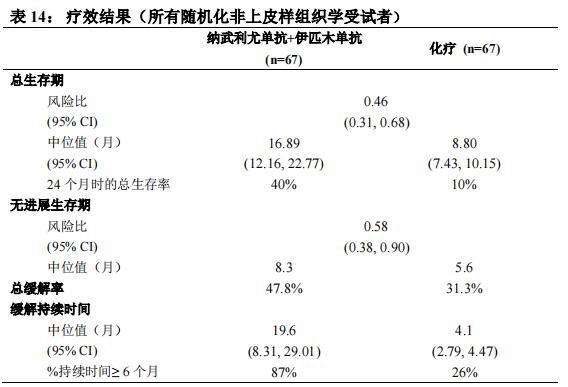
本品联合伊匹木单抗用于不可手术切除的、初治的非上皮样恶性胸膜间皮瘤成人患者。
该适应症是基于 CheckMate 743 临床研究中非上皮样恶性胸膜间皮瘤受试者的分析结果给予的附条件批准。该适应症的完全批准将取决于后续开展临床试验证实本品在中国人群的临床获益(见【临床试验】)。
患者选择
头颈部鳞状细胞癌患者使用本品前,必须获得经充分验证的检测方法证实的PD-L1 阳性评估结果。
推荐剂量
本品单药治疗
本品推荐剂量为 3mg/kg 或 240 mg 固定剂量,静脉输注每 2 周一次,直至出现疾病进展或产生不可接受的毒性。
推荐剂量和输注时间如表 1 所示。
本品与伊匹木单抗联合治疗
恶性胸膜间皮瘤
本品的推荐剂量为 360 mg,每 3 周 1 次,或 3 mg/kg,每 2 周 1 次,静脉输注 30 分钟,联合伊匹木单抗 1 mg/kg,每 6 周 1 次,静脉输注 30 分钟。对于没有疾病进展的患者,治疗持续最长至 24 个月。

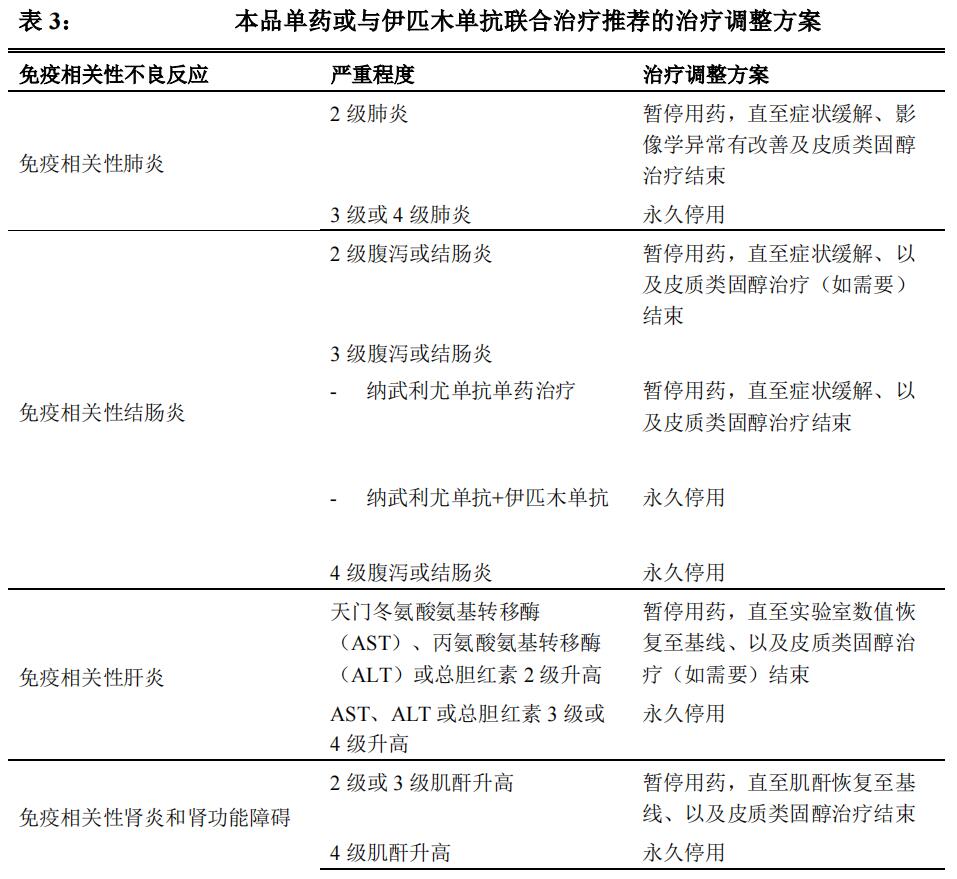
以下情况应永久性停用本品单药或与伊匹木单抗联合治疗:
4 级或复发性 3 级不良反应
虽然进行治疗调整但仍持续存在 2 级或 3 级不良反应当本品与伊匹木单抗联合治疗时,若暂停任一药物,则应同时暂停另一药物。若在暂停后重新开始给药,则应根据个体患者的评估情况重新开始联合治疗或本品单药治疗。
特殊人群
儿童人群
尚未确立本品在 18 岁以下儿童的安全性和疗效。
老年人群
老年患者(≥ 65 岁)无需调整剂量(参见【药理毒理】和【药代动力学】)。
来自 75 岁或以上 NSCLC 患者的数据有限,不能就该人群得出相关结论。
肾损伤
根据群体药代动力学结果,轻或中度肾损伤患者无需调整剂量(参见【药代动力学】)。重度肾损伤患者的数据有限,不能就该人群得出相关结论。
肝损伤
根据群体药代动力学结果,轻或中度肝损伤患者无需调整剂量(参见【药代动力学】)。没有对重度肝损伤患者进行本品的相关研究。重度(总胆红素 > 3倍 ULN 和任何 AST)肝损伤患者必须慎用本品。
给药方法
本品仅供静脉注射使用。在 30 分钟时间静脉输注本品(推荐剂量和输注时间参见【用法用量】推荐剂量和输注时间)。输注时所采用的输液管必须配有一个无菌、无热原、低蛋白结合的输液管过滤器(孔径 0.2-1.2μm)。
本品不得采用静脉推注或单次快速静脉注射给药。
本品可采用 10mg/ml 溶液直接输注,或者采用注射用氯化钠溶液(9mg/ml,0.9%)或注射用葡萄糖溶液(50mg/ml,5%)稀释,浓度可低至 1mg/ml。总输注量一定不能超过 160mL。
• 对于体重≥40 kg 的患者,总输注量不得超过 160 mL。
• 对于体重<40 kg 的患者,总输注量按体重计算不得超过 4 ml/kg。
• 本品与其他治疗药物联合给药:与伊匹木单抗联用时,应先输注本品,之后同一天输注伊匹木单抗。
每次输注需使用单独的输液袋和过滤器。
输注结束时冲洗输液管。
请勿通过同一根输液管同时给予其他药物。
本说明书描述了在临床试验中观察到的判断为可能由纳武利尤单抗引起的不良反应及其近似的发生率。由于临床试验是在各种不同条件下进行的,在一个临床试验中观察到的不良反应的发生率不能与另一个临床试验观察到的不良反应发生率直接比较,也可能不能反映临床实践中的实际发生率。
本品单药治疗
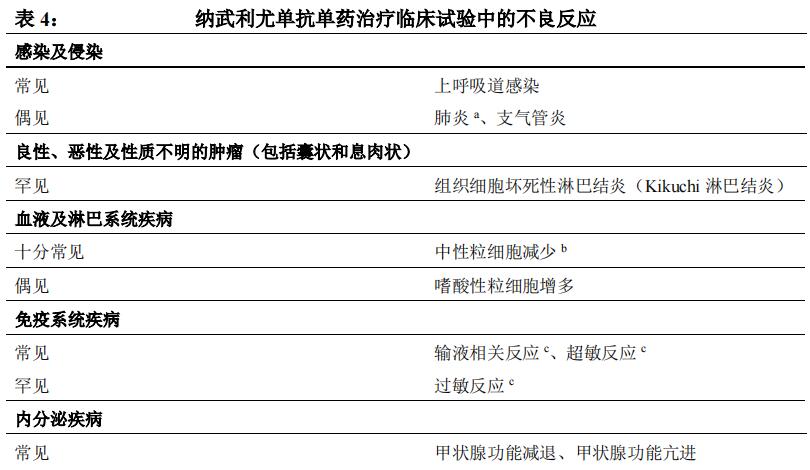
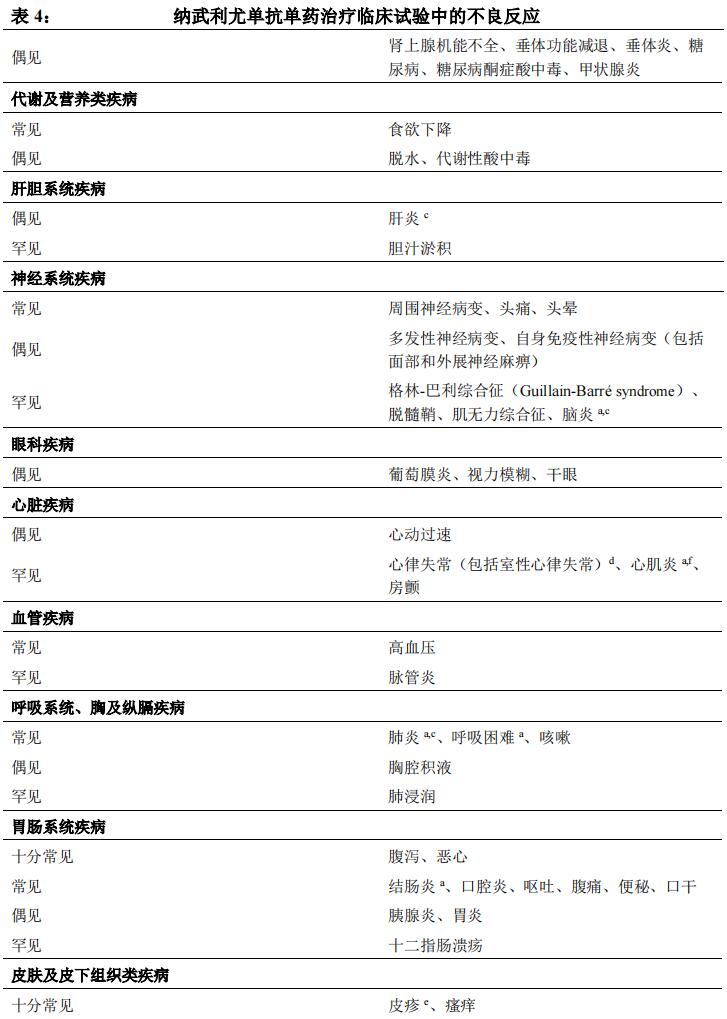
安全性特征总结
在不同肿瘤类型汇总数据集中(纳武利尤单抗 3 mg/kg 单药治疗,n=2950,包括黑色素瘤、鳞状和非鳞状 NSCLC、肾细胞癌、经典型霍奇金淋巴瘤、头颈部鳞状细胞癌、尿路上皮癌和胃/胃食管连接部腺癌),最常见的不良反应(≥ 10%)为疲乏(28%)、皮疹(16%)、瘙痒(13%)、腹泻(12%)、中性粒细胞减少(12%)和恶心(11%)。大多数不良反应为轻至中度(1 级或 2 级)。NSCLC患者至少 24 个月随访未发现新的安全性信号。
不良反应汇总表
纳武利尤单抗单药治疗患者(n=2950)汇总数据集中报告的不良反应参见表4。按照不良反应受累器官系统分类及发生频率进行分组展示。发生频率定义为:十分常见(≥ 1/10);常见(≥ 1/100 至< 1/10);偶见(≥ 1/1,000 至< 1/100);罕见(≥ 1/10,000 至< 1/1,000);十分罕见(<1/10,000)。在每一发生频率组,按严重程度从高到低依次排列。








对活性成份或【成份】所列的任何辅料存在超敏反应的患者。
当纳武利尤单抗与伊匹木单抗联合治疗时,请在开始治疗前查阅伊匹木单抗的产品说明书。相比纳武利尤单抗单药治疗,纳武利尤单抗与伊匹木单抗联合治疗时,免疫相关性不良反应的发生率更高。多数免疫相关性不良反应经过适当的治疗后(包括给予皮质类固醇和治疗调整)可改善或缓解(参见【用法用量】)。
联合治疗时也报告过心脏和肺不良事件(包括肺栓塞)。应持续监测患者的心肺不良反应,并在治疗前以及治疗过程中定期监测提示电解质紊乱和脱水的临床症状、体征和实验室异常。若出现危及生命或复发性重度心肺不良反应,应停止纳武利尤单抗和伊匹木单抗联合治疗(参见【用法用量】)。
纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗可引起免疫相关性不良反应。应持续进行患者监测(至少至末次给药后 5 个月),因为不良反应可能在纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗期间或治疗停止后的任何时间发生。
对于疑似免疫相关性不良反应,应进行充分的评估以确认病因或排除其他病因。根据不良反应的严重程度,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗并给予皮质类固醇。若使用皮质类固醇免疫抑制疗法治疗不良反应,症状改善后,需至少 1 个月的时间逐渐减量至停药。快速减量可能引起不良反应恶化或复发。如果虽使用了皮质类固醇但仍恶化或无改善,则应增加非皮质类固醇性免疫抑制治疗。
在患者接受免疫抑制剂量的皮质类固醇或其他免疫抑制治疗期间,不可重新使用纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。在接受免疫抑制治疗的患者中,应使用预防性抗生素预防机会性感染。
若出现任何重度、复发的免疫相关性不良反应以及任何危及生命的免疫相关性不良反应,必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。
免疫相关性肺炎
已经在纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗中观察到了重
度肺炎或间质性肺病,包括致死病例(参见【不良反应】)。应监测患者是否有
肺炎症状和体征,如放射学改变(例如,局部毛玻璃样混浊、斑块样浸润)、呼
吸困难和缺氧。应排除感染和疾病相关性病因。
对于 3 级或 4 级肺炎,必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木
单抗联合治疗,应按照 2-4mg/kg/天甲泼尼龙当量开始皮质类固醇治疗。
对于 2 级(症状性)肺炎,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单
抗联合治疗,按照 1mg/kg/天甲泼尼龙当量开始皮质类固醇治疗。一旦病情改善,
可在皮质类固醇减量后重新开始纳武利尤单抗或纳武利尤单抗与伊匹木单抗联
合治疗。如果虽给予皮质类固醇但病情恶化或无改善,则应将皮质类固醇剂量增
加至 2-4mg/kg/天甲泼尼龙当量,并必须永久停止纳武利尤单抗或纳武利尤单抗
与伊匹木单抗联合治疗。
免疫相关性结肠炎
已经在纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗中观察到重度腹泻或结肠炎(参见【不良反应】)。应监测患者是否有腹泻和其他结肠炎症状,如腹痛和粘液便或血样便。应排除感染和疾病相关性病因。皮质类固醇难治性免疫相关结肠炎患者中已有报道巨细胞病毒(CMV)感染/再激活。应当排除腹泻的感染性病因和其他病因,因此必须进行适当的实验室检查和其他检查。如果确诊为皮质类固醇难治性免疫相关结肠炎,应考虑在皮质类固醇治疗中添加替代免疫抑制剂或替代皮质类固醇治疗。应在出现腹泻或结肠炎时进行粪便感染检查(包括 CMV、其他病毒病因学、培养物、艰难梭菌、寄生虫或虫卵),以排除感染或其他病因。
对于 4 级腹泻或结肠炎,必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,按照 1-2mg/kg/天甲泼尼龙当量开始皮质类固醇治疗。
对于 3 级腹泻或结肠炎,应暂停纳武利尤单抗单药治疗,按照 1-2mg/kg/天甲泼尼龙当量开始皮质类固醇治疗。一旦病情改善,可在皮质类固醇减量后重新开始纳武利尤单抗单药治疗。如果虽给予皮质类固醇但病情恶化或无改善,必须永久停止纳武利尤单抗单药治疗。若在纳武利尤单抗与伊匹木单抗联合治疗中观察到 3 级腹泻,需要永久停用并按照 1-2 mg/kg/天甲泼尼龙当量开始皮质类固醇治疗。
对于 2 级腹泻或结肠炎,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。若有持续腹泻或结肠炎,应按照 0.5-1mg/kg/天甲泼尼龙当量开始皮质类固醇治疗。一旦病情改善,可在皮质类固醇减量(若需要)后重新开始纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。如果虽给予皮质类固醇但病情恶化或无改善,则应将皮质类固醇剂量增加至 1-2mg/kg/天甲泼尼龙当量,并必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。
免疫相关性肝炎
已经在纳武利尤单抗单药治疗或纳武利尤单抗与伊匹木单抗联合治疗中观察到重度肝炎(参见【不良反应】)。应监测患者是否有肝炎的症状和体征,如转氨酶和总胆红素升高。应排除感染和疾病相关性病因。
对于 3 级或 4 级转氨酶或总胆红素升高,必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,应按照 1-2mg/kg/天甲泼尼龙当量开始皮质类固醇治疗。
对于 2 级转氨酶或总胆红素升高,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。若该类实验室数值持续升高,应按照 0.5-1mg/kg/天甲泼尼龙当量给予皮质类固醇治疗。一旦病情改善,可在皮质类固醇减量(若需要)后重新开始纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。如果虽给予皮质类固醇但病情恶化或无改善,则应将皮质类固醇剂量增加至 1-2mg/kg/天甲泼尼龙当量,并必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。
在一项晚期肝细胞癌研究中有 262 名患者接受了纳武利尤单抗治疗,其中23%感染 HCV,25%感染 HBV。慢性 HBV 感染患者需要同时应用有效的抗病毒治疗以维持病毒载量< 100 IU/ml。根据这些数据,给予 HCV 或有效抗病毒治疗的 HBV 感染患者应用纳武利尤单抗治疗的安全性特征与非感染患者相似。
免疫相关性肾炎或肾功能障碍
已经在纳武利尤单抗单药治疗或纳武利尤单抗与伊匹木单抗联合治疗中观察到重度肾炎或肾功能障碍(参见【不良反应】)。应监测患者是否有肾炎和肾功能障碍的症状和体征。多数无症状患者出现血清肌酐升高。应排除疾病相关性病因。
对于 4 级血清肌酐升高,必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,并按照 1-2mg/kg/天甲泼尼龙当量开始皮质类固醇治疗。
对于 2 级或 3 级血清肌酐升高,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,按照 0.5-1mg/kg/天甲泼尼龙当量给予皮质类固醇治疗。一旦病情改善,可在皮质类固醇减量后重新开始纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。如果虽给予皮质类固醇但病情恶化或无改善,则应将皮质类固醇剂量增加至 1-2mg/kg/天甲泼尼龙当量,并必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。
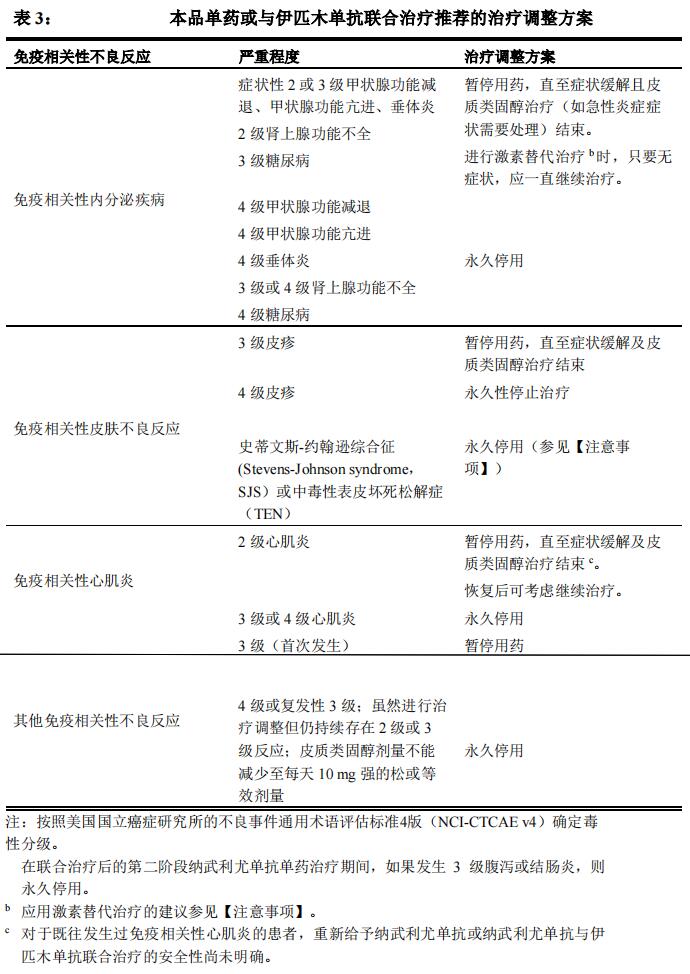
免疫相关性内分泌疾病
已经在纳武利尤单抗单药治疗或纳武利尤单抗与伊匹木单抗联合治疗中观察到重度内分泌病,包括甲状腺功能减退、甲状腺功能亢进、肾上腺功能不全(包括继发性肾上腺皮质功能不全)、垂体炎(包括垂体功能减退)、糖尿病和糖尿病酮症酸中毒(参见【不良反应】)。
应监测患者是否有内分泌病和高血糖的临床症状和体征,以及是否有甲状腺功能改变(治疗开始时、治疗过程中定期以及临床评估提示需要时)。患者可能出现疲乏、头痛、精神状态改变、腹痛、不寻常的排便习惯和低血压,或可能类似于脑转移或基础疾病等其他病因的非特异性症状。除非鉴别到了其他病因,否则应考虑内分泌病的症状和体征具有免疫相关性。
对于有症状性甲状腺功能减退,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,应根据需要开始甲状腺激素替代治疗。对于症状性甲状腺功能亢进,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,并根据需要给予抗甲状腺药物。如果怀疑有甲状腺急性炎症,也应考虑按照 1-2mg/kg/天甲泼尼龙当量开始皮质类固醇治疗。一旦病情改善,可在皮质类固醇减量(若需要)后重新开始纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。应继续监测甲状腺功能,以确保采用适当的激素替代治疗。对于危及生命的甲状腺功能亢进或甲状腺功能减退,必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。
对于症状性 2 级肾上腺功能不全,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,并根据需要开始生理性皮质类固醇替代治疗。对于重度(3级)或危及生命(4 级)的肾上腺功能不全,必须永久停止纳武利尤单抗治疗。
应继续监测肾上腺功能和激素水平,以确保采用适当的皮质类固醇替代治疗。对于症状性 2 级或 3 级垂体炎,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,并根据需要开始激素替代治疗。如果怀疑有垂体急性炎症,也应考虑按照 1-2mg/kg/天甲泼尼龙当量开始皮质类固醇治疗。一旦病情改善,可在皮质类固醇减量(若需要)后重新开始纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。对于危及生命的(4 级)垂体炎,必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。应继续监测垂体功能和激素水平,以确保采用适当的激素替代治疗。
对于症状性糖尿病,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,并根据需要开始胰岛素替代治疗。应继续监测血糖水平,以确保采用适当的胰岛素替代治疗。但对于危及生命的糖尿病,必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。
免疫相关性皮肤不良反应
在纳武利尤单抗治疗和纳武利尤单抗与伊匹木单抗联合治疗中观察到严重皮疹,纳武利尤单抗单药治疗中该事件较为少见。。若出现 3 级皮疹,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,若出现 4 级皮疹,则停用。重度皮疹时,应使用 1-2mg/kg/天甲泼尼龙当量给予高剂量皮质类固醇进行治疗。已经观察到过罕见的史蒂文斯-约翰逊综合征(SJS)和中毒性表皮坏死松解症(TEN)病例,其中有些甚至出现死亡结局。如果出现 SJS 或 TEN 的症状或体征,应停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,将患者转至专科机构进行评估和治疗。如果患者在纳武利尤单抗使用中出现 SJS 或 TEN,建议永久停用纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。
患者在既往接受其他抗癌免疫激动剂治疗中出现过严重或威胁生命的皮肤不良反应,应谨慎使用纳武利尤单抗。
其他免疫相关性不良反应
在不同剂量、给药方案和肿瘤类型的临床试验中,有小于 1%的纳武利尤单抗单药治疗或纳武利尤单抗与伊匹木单抗联合治疗患者报告了以下免疫相关性不良反应:胰腺炎、葡萄膜炎、脱髓鞘、自身免疫性神经病变(包括面部和外展神经麻痹)、格林-巴利综合征(Guillain-Barré syndrome)、重症肌无力、肌无力综合征、无菌性脑膜炎、脑炎、胃炎、结节病、十二指肠炎、肌炎、心肌炎和横纹肌溶解症。纳武利尤单抗上市使用后已有伏格特-小柳-原田综合征(VogtKoyanagi-Harada syndrome)和甲状旁腺功能减退的病例报告。
对于疑似免疫相关性不良反应,应进行充分的评估以确认病因或排除其他病因。根据不良反应的严重程度,应暂停纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗并给予皮质类固醇。一旦病情改善,可在皮质类固醇减量后重新开始纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。若出现任何复发的重度免疫相关性不良反应及任何危及生命的免疫相关性不良反应,必须永久停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。
纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合临床使用中已有肌肉毒性(肌炎、心肌炎和横纹肌溶解症)的报告,有些出现死亡结局。因为某些心肌炎病例可能无症状,所以对心肌炎的诊断需要高度警觉。因此,有心脏或心肺症状的患者应及时进行诊断检查和评估,同时要密切监测。对于心肌炎,肌钙蛋白是一项敏感的但不是确诊性的标记物。如果疑似出现心肌炎,应立即开始使用高剂量类固醇(强的松 1-2 mg/kg/天或甲泼尼龙 1-2 mg/kg/天),并立即进行心内科会诊,同时进行全面的诊断检查,包括心电图、肌钙蛋白和超声心动图等。根据心内科医生的指导可进行进一步检查,包括心脏磁共振成像。一旦确诊后,应暂停使用纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗。对于 3 级心肌炎,应永久停用纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗(参见治疗调整方案,表 2)。
上市后接受 PD-1 抑制剂的患者,报告有实体器官移植排斥反应。接受纳武利尤单抗治疗会增加实体器官移植排斥的风险。在此类患者中应考虑纳武利尤单抗治疗的获益/可能的器官排斥风险。
对于既往接受过异体干细胞移植并随后接受 PD-1/PD-L1 抑制剂的 cHL 患者,在上市后报道了快速发作和严重的移植物抗宿主病(GVHD),其中一些具有致命的结果。(参见“不良影响,上市后经验“)。
在纳武利尤单抗单药治疗和纳武利尤单抗联合伊匹木单抗治疗中均观察到噬血细胞性淋巴组织细胞增生症(HLH)。当纳武利尤单抗作为单药治疗或与伊匹木单抗联合给药时,应谨慎使用。如果确诊为 HLH,应停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合给药,并开始 HLH 治疗。
输液反应
已经在纳武利尤单抗或纳武利尤单抗联合伊匹木单抗临床试验中观察到重度输液反应(参见【不良反应】)。如果出现重度或危及生命的输液反应,必须停止纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗,给予适当的药物治疗。
出现轻或中度输液反应的患者在接受纳武利尤单抗或纳武利尤单抗与伊匹木单抗联合治疗时应给予密切监测,并依照输液反应预防的本地治疗指南预防用药。
疾病特异性注意事项
非小细胞肺癌
基线体质状况评分≥ 2、有活动性脑转移或自身免疫性疾病、症状性间质性肺病的患者,以及在进入研究前曾接受过全身性免疫抑制剂治疗的患者,排除在NSCLC 临床试验之外(参见【药物相互作用】和【临床试验】)。因无相关数据,该类人群应在认真考虑个体可能的获益/风险后慎用纳武利尤单抗。
胃/胃食管连接部腺癌
ECOG 体质状况评分≥2 或 KPS<70%,患有自身免疫性疾病、活动性脑转移(或软脑膜转移)、憩室炎、症状性胃肠溃疡、需要治疗的腹水或既往接受过全身性免疫抑制剂治疗的患者,排除在研究之外。因无相关数据,该类人群应在认真考虑个体可能的获益/风险后慎用纳武利尤单抗。
恶性胸膜间皮瘤
患有原发性腹膜、心包、睾丸或鞘膜间皮瘤、间质性肺病、活动性自身免疫病、需要全身免疫抑制的医学病症和脑转移(除非手术切除或接受立体定向放疗,并且在入组前 3 个月内无进展)的患者被排除在一线治疗 MPM 的关键试验之外(参见【临床试验】)。因无相关数据,该类人群应在认真考虑个体可能的获益/风险后慎用纳武利尤单抗与伊匹木单抗联合治疗。
药物类特异性警告和注意事项
在沙利度胺类似物联合地塞米松用药方案中加入 PD-1 阻断抗体时,多发性骨髓瘤[未获批准的适应症]患者的死亡率增加
在多发性骨髓瘤患者的随机临床试验中,向沙利度胺类似物联合地塞米松的给药方案(该方案未使用 PD-1 阻断抗体)中添加 PD-1 阻断抗体(包括纳武利尤单抗),结果显示死亡率增加。在对照临床试验之外,不建议在沙利度胺类似物联合地塞米松的方案基础上再联合 PD-1 阻断抗体用于多发性骨髓瘤患者的治疗。
控制钠摄入的患者
本品每毫升含 0.1mmol(或 2.5mg)钠。在对控制钠摄入的患者进行治疗时,应考虑这一因素。对驾驶和操作机器能力的影响
基于药效学特性,纳武利尤单抗不可能会影响驾驶和操作机器的能力。由于可能出现疲乏等不良反应(参见【不良反应】),因此,建议患者在驾驶或操作机器期间慎用本品,直至确定纳武利尤单抗不会对其产生不良影响。
配伍禁忌
在没有进行配伍性研究的情况下,本品不得与其他医药产品混合。本品不应
与其它医药产品经相同的静脉通道合并输注。
若内包装瓶密封破损或缺失,请勿使用。
临床试验中尚未报告过药物过量病例。若出现药物过量,应密切监测患者是否出现不良反应的症状或体征,并立即给予适当的对症治疗。
尚无妊娠女性使用纳武利尤单抗的数据。动物研究已经显示具有胚胎胎儿毒性(参见【药理毒理】)。已知人IgG4会穿过胎盘屏障,而纳武利尤单抗是一种IgG4;所以,纳武利尤单抗有可能会经母体传输至发育中的胎儿。不建议在妊娠期间、在不采用有效避孕措施的育龄期女性中使用纳武利尤单抗,除非临床获益大于潜在风险。应在最后一次应用纳武利尤单抗后至少5个月内采用有效避孕措施。 生育力 尚未进行评估纳武利尤单抗对生育力影响的研究。因此,纳武利尤单抗对男性和女性生育力的影响不详。尚不清楚纳武利尤单抗是否会经人乳分泌。由于许多药品(包括抗体)会在人乳中分泌,因此,无法排除会对新生儿/婴儿造成风险。在考虑母乳喂养对孩子的益处以及治疗对妇女的益处后,必须做出是停止母乳喂养还是停止纳武利尤单抗治疗的决定。尚未确立本品在18岁以下儿童中的安全性和疗效。无相关数据。老年患者(≥ 65岁)无需调整剂量(参见【临床试验】和【药代动力学】)。在老年患者(≥ 65岁)和年轻患者(< 65岁)间,未报告安全性或疗效总体上存在差异。来自75岁或以上NSCLC患者的数据有限,无法就该人群得出相关结论(参见【临床试验】)。
纳武利尤单抗是一种人单克隆抗体,尚未进行药代动力学相互作用研究。因单克隆抗体不经细胞色素P450(CYP)酶或其他药物代谢酶代谢,因此,合并使用的药物对这些酶的抑制或诱导作用预期不会影响纳武利尤单抗的药代动力学。 其他相互作用形式 全身性免疫抑制 因可能干扰药效学活性,应避免在基线开始纳武利尤单抗治疗前使用全身性皮质类固醇及其他免疫抑制剂。不过,为了治疗免疫相关性不良反应,可在开始纳武利尤单抗治疗后使用全身性皮质类固醇及其他免疫抑制剂。初步结果显示,纳武利尤单抗治疗开始后应用全身性免疫抑制治疗不会影响纳武利尤单抗疗效。
Bristol-Myers Squibb Holdings Pharma, Ltd. Liability Company
86979518000218,86979518000201
T 细胞中表达的 PD-1 受体与其配体 PD-L1 和 PD-L2 结合,可以抑制 T 细胞增殖和细胞因子生成。部分肿瘤细胞的 PD-1 配体上调,通过这个通路信号传导可抑制激活的 T 细胞对肿瘤的免疫监视。纳武利尤单抗是一种人类免疫球蛋白 G4(IgG4)单克隆抗体(HuMAb),可与 PD-1 受体结合,阻断其与 PD-L1和 PD-L2 之间的相互作用,阻断 PD-1 通路介导的免疫抑制反应,包括抗肿瘤免疫反应。在同源小鼠肿瘤模型中,阻断 PD-1 活性可抑制肿瘤生长。
纳武利尤单抗(抗 PD-1)和伊匹木单抗(抗 CTLA-4)联合治疗介导的抑制作用可改善转移性黑色素瘤的抗肿瘤反应。在同源小鼠肿瘤模型中,PD-1 和CTLA-4 的双重阻断可产生协同抗肿瘤活性。
生殖毒性
PD-1/PD-L1 通路的一个主要功能是维持妊娠母体对胎儿的免疫耐受。在妊娠小鼠模型中,阻断 PD-L1 信号通路会破坏母体对胎鼠的耐受性,增加胎鼠流产。食蟹猴从妊娠初期的器官形成期起至分娩,每周给予纳武利尤单抗 2 次,可见非剂量依耐性地增加流产和胎仔死亡率,纳武利尤单抗在猴中的暴露量为临床剂量 3mg/kg 时暴露量的 9~42 倍(以 AUC 计)。基于其作用机制,胎仔暴露于纳武利尤单抗可增加发生免疫介导紊乱或改变正常免疫应答的风险,在 PD-1 基因敲除小鼠中已有免疫介导紊乱的报道。纳武利尤单抗给药组存活的猴胎仔(给药组 18/32,溶媒对照组 11/16)未见明显致畸作用,从出生到 6 个月,给药组胎仔的神经行为、免疫学和临床病理学参数与溶媒对照组相当。尚未开展纳武利尤单抗的生育力研究,在 1 个月和 3 个月的食蟹猴重复给药毒性试验中,纳武利尤单抗对雄性和雌性生殖器官未见明显影响,但研究中的大部分动物尚未性成熟。
其他毒性
在动物模型中,抑制 PD-1 信号通路可增加一些感染的严重程度和增强炎症反应。与野生型小鼠比,感染结核分枝杆菌的 PD-1 基因敲除小鼠存活率明显降低,这与 PD-1 基因敲除小鼠体内细菌增殖和炎症反应增加有关。PD-1 基因敲除小鼠感染脑膜炎病毒后存活率同样降低。
非小细胞肺癌
鳞状 NSCLC
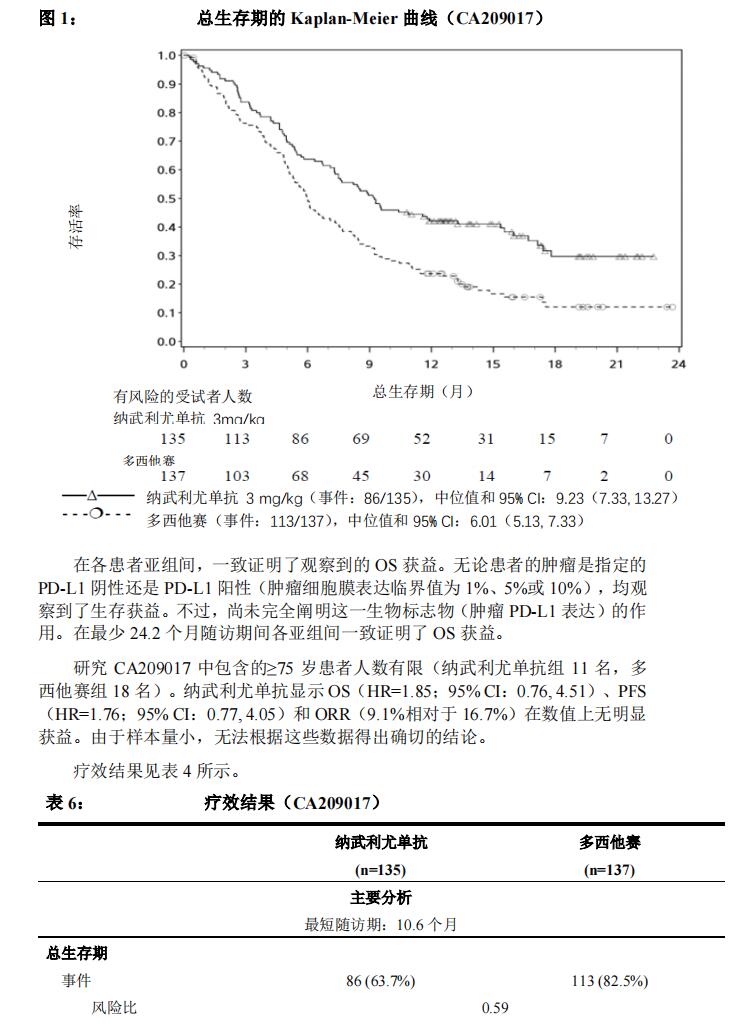
1. 与多西他赛比较的随机、3 期研究(CA209017)
在一项 3 期、随机、开放性研究(CA209017)中评估了纳武利尤单抗 3mg/kg作为单药治疗晚期或转移性鳞状 NSCLC 的安全性和疗效。研究中纳入了一种含铂两药化疗方案治疗过程中或治疗后出现疾病进展且 ECOG 体质状况评分为 0或 1 的患者(18 岁或以上)。无论患者的肿瘤 PD-L1 状态如何,均可入选。存在活动性自身免疫性疾病、症状性间质性肺病或活动性脑转移患者,排除在研究之外。如果在入选前至少 2 周其神经系统症状已经恢复至基线水平、停用皮质类固醇或者按照<10mg/天强的松当量的剂量稳定治疗或减少剂量,则接受过治疗的脑转移患者有资格参加。
将总计 272 名患者随机分组,接受纳武利尤单抗 3mg/kg(n = 135)60 分钟静脉给药,2 周一次,或多西他赛(n = 137) 75mg/m2、3 周一次。只要观察到临床获益,持续进行治疗,或者直至患者不再能够耐受治疗。于随机分组后 9 周依照 RECIST 1.1 版进行肿瘤评估,并在之后每 6 周评估一次。主要疗效结局评估指标是总生存期(OS)。关键的次要疗效结局评估指标是研究者评价的客观缓解率(ORR)和无进展生存期(PFS)。此外,使用肺癌症状评分(LCSS)平均症状负荷指数和 EQ-5D 视觉类比量表(EQ-VAS)评估了症状改善和总体健康状况。
两组间的基线特征基本均衡。中位年龄为 63 岁(范围:39-85),其中 44%≥65 岁,11% ≥75 岁。大多数患者是白人(93%)和男性(76%)。31%的患者将疾病进展报告为其最近所用既往方案的最佳缓解,45%在完成其最近既往方案后3 个月内接受了纳武利尤单抗治疗。基线 ECOG 体质状况评分为 0(24%)或 1(76%)。
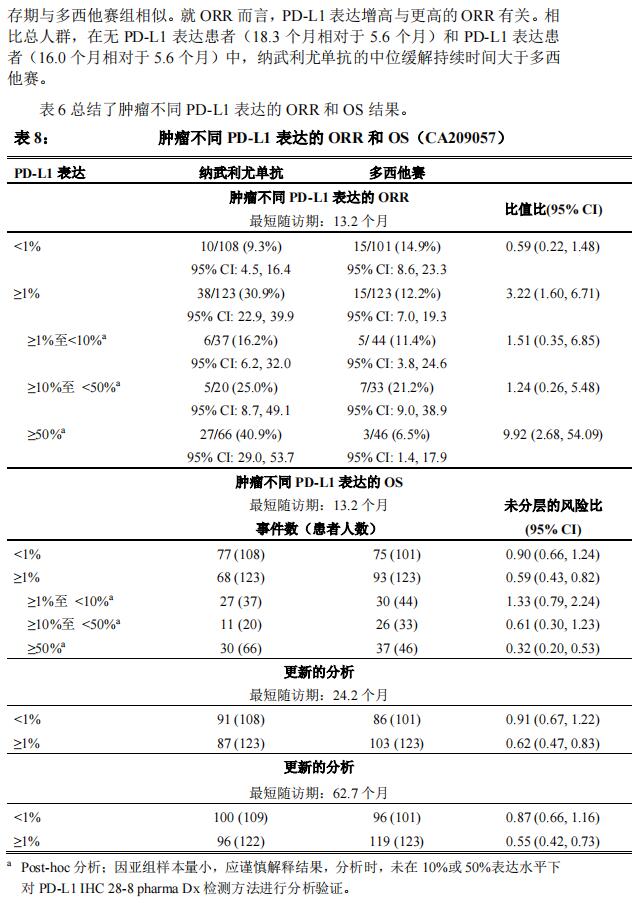
总生存期的 Kaplan-Meier 曲线见图 1 所示。

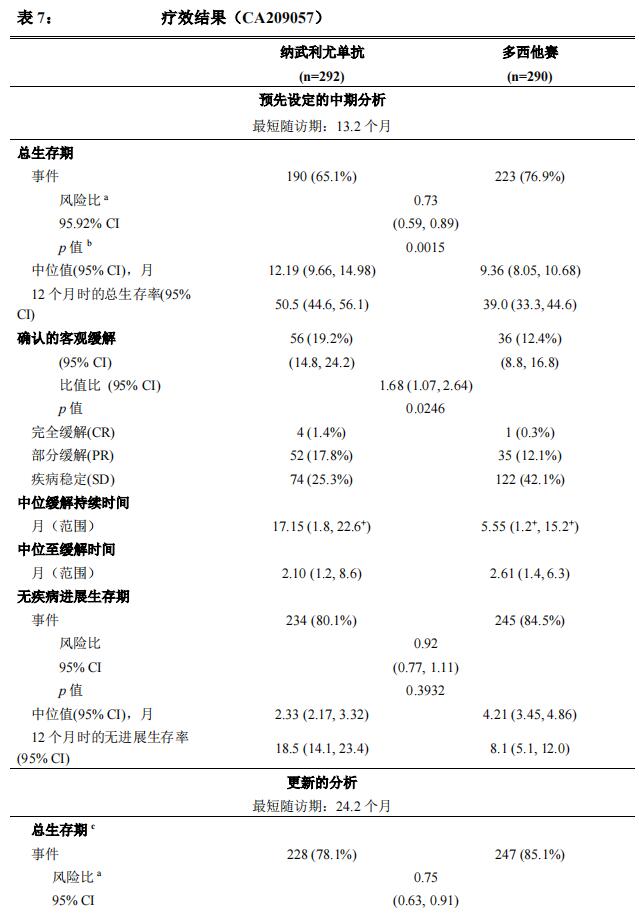






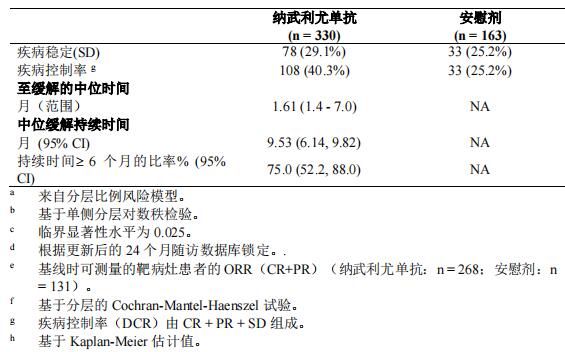
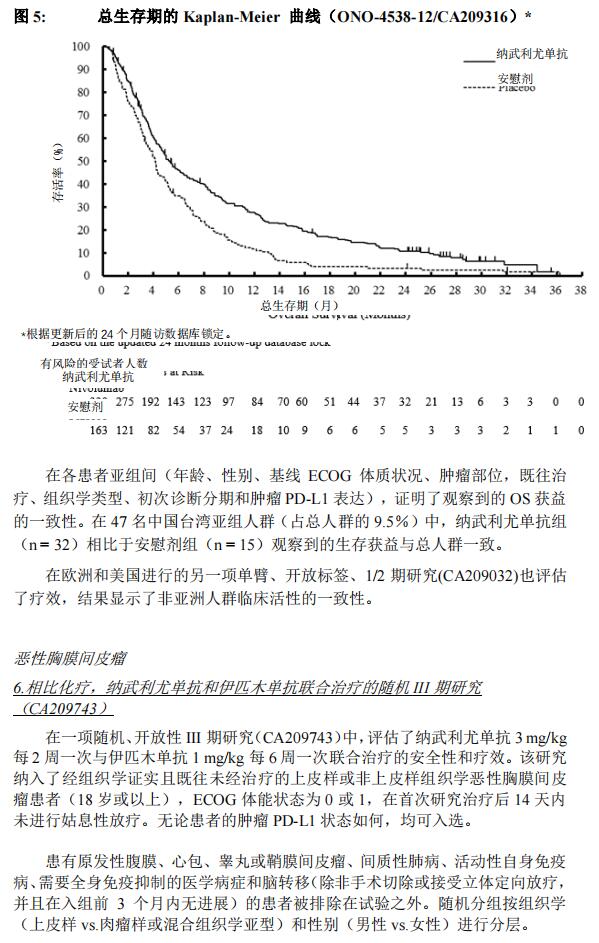


全球患者数据:
纳武利尤单抗单药治疗
纳武利尤单抗的药代动力学(PK)特征在 0.1 至 10mg/kg 的剂量范围内呈线性。根据群体 PK 分析,几何平均(% 变异系数[CV%])清除率(CL)、几何平均稳态分布容积(Vss)和几何平均消除半衰期(t1/2)分别为 7.91 ml/h(46%)、6.6 L(24.4%)和 25 天(55.4%)。
尚未对纳武利尤单抗的代谢途径进行评估。作为一种完全人 IgG4 单克隆抗体,预期纳武利尤单抗采用与内源性 IgG 相同的方式,通过代谢途径被降解成小肽和氨基酸。
纳武利尤单抗与伊匹木单抗联合治疗
当纳武利尤单抗 3 mg/kg 每 2 周一次与伊匹木单抗 1 mg/kg 每 6 周一次联合给药时,纳武利尤单抗的清除率与其单药治疗时相比增加了 12%,伊匹木单抗的清除率与其单药治疗时相比升高了 11%。这些变化不被认为具有临床相关性当纳武利尤单抗 3 mg/kg 每 2 周一次与伊匹木单抗 1 mg/kg 每 6 周一次联合给药时,纳武利尤单抗的清除率在存在抗纳武利尤单抗抗体的情况下升高了 12%,被认为无临床相关性。
特殊人群
群体 PK 分析表明,基于年龄、性别、种族、肿瘤类型、肿瘤大小和肝损伤,纳武利尤单抗的清除率无差异。虽然 ECOG 状态、基线肾小球滤过率(GFR)、白蛋白和体重对纳武利尤单抗清除率有影响,但其影响不具有临床意义。
肾损伤
在群体 PK 分析中,通过与肾功能正常患者相比较(GFR≥90 ml/min/1.73m2;n = 1354),评估了轻度(GFR <90 和≥60ml/min/1.73m2;n = 1399)、中度(GFR<60 和≥30 ml/min/1.73m2;n = 651)或重度(GFR <30 和≥15 ml/min/1.73m2;n =6 时)肾损伤对纳武利尤单抗清除率的影响。轻度或中度肾损伤患者和肾功能正常患者之间纳武利尤单抗的清除率没有临床重要差异。重度肾损伤患者的数据有限,无法得出该人群的结论(见【用法用量】)。
肝损伤
在群体 PK 分析中,通过将不同肿瘤类型(非小细胞肺癌、小细胞肺癌、肾细胞癌、头颈部鳞状细胞癌、尿路上皮癌、胃癌以及经典型霍奇金淋巴瘤)的轻度肝损伤患者(总胆红素>1.0 至 1.5 倍 ULN 或 AST > ULN,n=351)和中度肝损伤患者(总胆红素>1.5 至 3 倍 ULN 和任何 AST,n=10)与肝功能正常患者(总胆红素和 AST ≤ ULN,n=3096)进行比较,评估了肝损伤对纳武利尤单抗清除率的影响。轻度或中度肝损伤患者和肝功能正常患者之间纳武利尤单抗的清除率没有临床相关差异。在肝癌(轻度肝损伤:n=152;中度肝损伤:n=13)患者中观察到相似结果。尚未在重度肝损伤患者(总胆红素>3 倍 ULN 和任何 AST)中开展纳武利尤单抗研究(见【用法用量】)。
中国患者数据:
纳武利尤单抗单药治疗的药代动力学评估通过群体药代动力学(PPK)方法在一项既往经过治疗的晚期实体瘤中国患者的 1/2 期研究(CA209077,n=35,包含 3 mg/kg 每 2 周一次和 240 mg 每 2 周一次剂量组),和一项既往经过治疗的NSCLC 患者 3 期研究(CA209078,n=276,纳武利尤单抗剂量为 3 mg/kg 每 2 周一次)。纳武利尤单抗的药代动力学也在研究 CA209077 中通过非房室模型分析进行了评估(为 3 mg/kg 每 2 周一次,240 mg 每 2 周一次,和 360mg 每 3 周一次)。纳武利尤单抗的药代动力学在中国患者与其他亚洲和非亚洲患者中相似,未观察到纳武利尤单抗药代动力学具有种族差异。
纳武利尤单抗联合伊匹木单抗治疗的药代动力学在研究 CA209672 中通过非房室模型分析进行了评估,给药剂量:包括纳武利尤单抗 3 mg/kg 每 2 周一次联合伊匹木单抗 1 mg/kg 每 6 周一次(n=9);纳武利尤单抗 3 mg/kg 联合伊匹木单抗 1 mg/kg 每 3 周一次共 4 次,之后给予纳武利尤单抗 240 mg 每 2 周一次(n=9);纳武利尤单抗 1 mg/kg 联合伊匹木单抗 3 mg/kg 每 3 周一次共 4 次,之后给予纳武利尤单抗 240 mg 每 2 周一次(n=9)。在中国受试者中,纳武利尤单抗联合伊匹木单抗给药时的药代动力学,或伊匹木单抗联合纳武利尤单抗给药时的药代动力学,分别与纳武利尤单抗或伊匹木单抗单药治疗时的药代动力学相似。
注射剂
40 mg/4ml(10 mg/ml); 100 mg/10 ml(10 mg/ml)。
玻璃瓶装,1瓶/盒。
2~8℃避光贮存,不可冷冻。 配制后溶液的保存条件,参见【有效期】。
3960元起
未开封 36个月。 开封后 按照微生物学观点,药品一旦开封应立即进行输注或稀释输注。 配制后溶液 按照微生物学观点应立即使用药品。 如果配制后的溶液不能立即使用,本品稳定性研究表明,2~8ºC避光可保
S20180014,S20180015

