维加特说明书
Nintedanib esilate soft capsules
尼达尼布
本品主要成份为:乙磺酸尼达尼布
化学名称:1H-吲哚-6-羧酸,2,3-二氢-3-[[[4-[甲基[(4-甲基-1-哌嗪基)乙酰基]氨基]苯基]氨基]苯基亚甲
基]-2-氧-,甲酯,(3Z)-,乙磺酸盐 (1:1)
化学结构式:

分子式:C31H33N5O4·C2H6O3S或C33H39N5O7S
分子量:649.76g/mol(乙磺酸盐)
539.62g/mol(游离碱)
本品为淡粉棕色(100mg规格)或棕色(150mg规格)不透明的椭圆形软胶囊,内容物为亮黄色黏稠混悬液。
用于特发性肺纤维化(IPF)。 用于系统性硬化病相关间质性肺疾病(SSc-ILD)。 用于具有进行性表型的慢性纤维化性间质性肺疾病。
推荐剂量 应该由具有诊断和治疗本品适应症经验的医师启动本品的治疗。在开始本品治疗前,进行肝功能检查和 妊娠试验。 本品推荐剂量为每次 150 mg,每日两次,给药间隔大约为 12 小时。 本品应与食物同服,用水送服整粒胶囊。本品有苦味,不得咀嚼或碾碎服用。尚不清楚咀嚼或碾碎胶囊 对尼达尼布药代动力学的影响。 如果漏服了一个剂量的药物,应在下一个计划服药时间点继续服用推荐剂量的药物,不应补服漏服的剂 量。不应超过推荐的每日最大剂量300 mg。 有轻度肝损伤(Child Pugh A)的患者慎用,推荐尼达尼布剂量为100mg,每日两次,相隔约12小时, 并与食物同服。 剂量调整 如可适用,除了对症治疗以外,本品的不良反应处理(参见【注意事项】、【不良反应】)可包括降低剂 量和暂时中断给药,直至特定不良反应缓解至允许继续治疗的水平。可采用标准推荐剂量(每次 150 mg, 每日两次)或降低的剂量(每次 100 mg,每日两次)重新开始本品治疗。如果患者不能耐受每次 100 mg, 每日两次,则应停止本品治疗。 肝酶升高可能需要调整剂量或中断治疗。使用本品治疗前、前3个月治疗期内定期、以及之后周期性或 根据临床指征开展肝功能检查(天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)和胆红素)。 如果患者报告了可能指示肝损害的症状,包括疲乏、厌食、右上腹部不适、小便黄赤或黄疸,应立即检 测肝功能。当天冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)增高> 3倍正常值上限(ULN) 并伴有中度肝损伤(Child Pugh B)的体征或症状,或>5倍正常值上限(ULN)时,应停用本品。当天 冬氨酸氨基转移酶(AST)或丙氨酸氨基转移酶(ALT)增高在大于3倍至小于5倍正常值上限(ULN) 之间,且无中度肝损伤(Child Pugh B)迹象时,可中断治疗,或将本品降低剂量至每次100mg,每日 两次。当肝酶恢复至基线值时,重新使用本品降低剂量(每次100mg,每日两次)治疗,随后可增加至 完整剂量(每次150 mg,每日两次)。 对于轻度肝损伤患者(Child Pugh A 级)慎用。在进行不良反应管理时,应考虑中断或停止治疗。 特殊人群 儿童人群: 尚未确定在儿童患者中安全性和有效性。 老年患者(≥ 65 岁): 与年龄小于 65 岁的患者相比,未在老年患者中观察到安全性和有效性的总体差异。无需根据患者年龄 调整起始剂量(参见【药代动力学】)。对≥ 75 岁的患者更有可能需要通过降低剂量的方式来管理不良 反应。 人种: 基于群体药代动力学(PK)分析,无需根据人种调整本品的推荐剂量(参见【特殊人群】、【注意事项】、 【药代动力学】)。黑人患者的安全性数据有限。 年龄、体重和性别: 根据群体药代动力学分析,年龄和体重与尼达尼布暴露量有关。然而,它们对暴露量的影响不大,无需 调整剂量。性别对尼达尼布的暴露量没有影响(参见【药代动力学】)。 肾损伤:单剂量尼达尼布中小于 1%的部分是通过肾脏排泄的(参见【药代动力学】)。无需对轻度至中度肾损伤 患者的起始剂量进行调整。尚未在重度肾损伤(肌酐清除率< 30 ml/min)患者中对尼达尼布的安全性、 有效性和药代动力学进行研究。 肝损伤: 尼达尼布主要通过胆汁/粪便排泄(> 90%);其暴露量在肝损伤患者(Child Pugh A、Child Pugh B)中 有所增加(参见【药代动力学】)。 轻度肝损伤(Child Pugh A)患者应慎用,建议使用剂量为尼达尼布 100mg,每日两次,相隔约 12 小时, 并与食物同服。 在轻度肝损伤(Child Pugh A)的患者中,在进行不良反应管理时,应考虑中断或停止治疗。 尚未在分类为 Child Pugh B 和 C 级的肝损伤患者中进行尼达尼布的安全性和有效性的研究。因此,不 建议将本品用于中度(Child Pugh B)和重度(Child Pugh C)肝损伤患者(参见【药代动力学】)。 吸烟者: 吸烟与本品的暴露量减少有关。这可能改变本品的疗效。鼓励患者在接受本品治疗前停止吸烟,在使用 本品期间应避免吸烟。
安全性概要
以下提供的安全性数据基于:
• 涉及 1061 例 IPF 患者的对比给予尼达尼布 150 mg,每日两次和安慰剂的两项为期 52 周的 3 期、
随机化、双盲、安慰剂对照试验(INPULSIS-1 和 INPULSIS-2)。
• 涉及 663 例具有进行性表型的慢性纤维化性间质性肺疾病患者的对比给予尼达尼布 150 mg,每日
两次和安慰剂的一项为期至少 52 周的 3 期、随机化、双盲、安慰剂对照试验(INBUILD)。
• 涉及576例SSc-ILD患者的对比给予尼达尼布150 mg,每日两次和安慰剂的为期至少52周的3期、
随机化、双盲、安慰剂对照试验(SENSCIS)。
• 上市后观察到的数据。
在临床试验中,与使用尼达尼布相关的最常见不良事件包括腹泻、恶心和呕吐、腹痛、食欲减退、体重
下降和肝酶升高。相应的不良反应的管理请参见【注意事项】。
一项在 IPF 患者中开展的长期延长试验中,本品治疗 1 至 5 年的安全性特征与 3 期试验中观察到的结果
保持一致【临床试验】。
不良反应列表
按药事管理标准医学术语集(MedDRA)系统器官分类(SOC)提供了不良反应总结和频率分类(如表
1)。
按照以下频率分类的定义:十分常见:≥ 1/10;常见:≥ 1/100 至< 1/10;偶见:≥ 1/1,000 至< 1/100;罕
见:≥ 1/10,000 至< 1/1,000;十分罕见:< 1/10,000;未知(无法从现有数据中估算)。
在每个频率组,不良反应均按照严重程度逐渐降低的顺序列出。

特定不良反应的描述
腹泻
在临床试验中,腹泻是最常见的胃肠道事件。 在大多数患者中,事件强度为轻度至中度。 超过三分之
二的患者腹泻的首次发生是在治疗的前三个月。大多数患者可以通过止泻治疗,降低剂量或中断治疗来
控制该类事件(参见【注意事项】)。表 2 总结出了临床试验中报告的腹泻不良事件:

肝酶升高
在INPULSIS试验中,尼达尼布和安慰剂治疗患者分别有13.6%和2.6%报告发生肝酶升高(参见【注意事
项】)。在INBUILD 试验中,尼达尼布和安慰剂治疗患者分别有22.6%和5.7%报告发生肝酶升高。在
SENSCIS试验中,尼达尼布和安慰剂治疗患者分别有13.2%和3.1%报告发生肝酶升高。肝酶的升高是可
逆的,并且与具有临床表现的肝脏疾病没有关联。
关于一旦出现肝酶升高和腹泻,针对特殊人群、推荐措施和剂量调整的更多信息请参见【注意事项】和
【用法用量】。
血小板减少症
血小板减少症可能会发生,导致出血的严重病例已有报道。仔细观察患者,例如定期进行血液测试。如
果观察到任何异常情况,应采取适当的措施,比如停止本品的治疗。
本品禁用于已知对尼达尼布、花生、大豆或任何本品辅料过敏的患者。 妊娠期间禁用本品(参见【孕妇及哺乳期妇女用药】以及【药理毒理】)。
胃肠道疾病
- 腹泻
在临床试验中(参见【临床试验】), 腹泻为最常见的胃肠道事件。在大多数患者中, 该事件的程度为轻度至中度, 并且在治疗的前 3 个月内发生。在治疗 IPF 患者的 INPULSIS 试验中,腹泻分别在 62.4% 的本品治疗的患者和 18.4% 的安慰剂治疗的患者中被报告。腹泻导致 10.7% 的患者减量使用本品,导致 4.4% 的患者停止本品治疗。在对具有进行性表型的慢性纤维化性间质性肺疾病患者开展的 INBUILD 试验中,分别有 66.9% 和 23.9% 接受本品和安慰剂治疗的患者报告出现腹泻。腹泻导致 16.0% 的患者减量使用本品,导致 5.7% 的患者停止本品治疗。在治疗 SSc-ILD 患者的 SENSCIS 试验中,腹泻分别在 75.7% 本品治疗的患者和 31.6% 安慰剂治疗的患者中被报告。 腹泻导致 22.2%的患者减量使用本品,并且 6.9%的患者停止本品治疗 (参见【不良反应】)。
应在首次出现腹泻时采用适当的补液和止泻药物,例如洛哌丁胺,进行治疗,并可能需要减量或中断治疗。可采用降低的剂量(每次 100 mg,每日两次)或完整剂量(每次 150 mg,每日两次)恢复本品治疗。如果即使接受了对症治疗,重度腹泻仍持续存在,则应停止本品治疗。
- 恶心和呕吐
恶心和呕吐是常被报告的不良事件(参见【不良反应】)。在大多数恶心和呕吐患者中,该事件的程度为轻度至中度。在 INPULSIS 试验中,恶心导致 2.0% 的患者停止尼达尼布治疗,呕吐导致 0.8% 的患者停止尼达尼布治疗。在 INBUILD 试验中,恶心和呕吐分别导致 0.3% 和 0.9% 的患者停止尼达尼布治疗。在 SENSCIS 试验中,恶心和呕吐分别导致 2.1% 和 1.4% 的患者停止尼达尼布治疗。
如果尽管接受了适当的支持疗法(包括止吐治疗),症状仍持续存在,那可能需要减量或中断治疗。
可采用降低的剂量(每次 100 mg,每日两次)或完整剂量(每次 150 mg,每日两次)恢复治疗。
如果即使接受了对症治疗,重度症状仍持续存在,则应停止本品治疗。 腹泻和呕吐可能导致脱水,伴有或不伴有电解质紊乱,这可能进展为肾功能损伤。
肝功能
尚未在中度(Child Pugh B)或重度(Child Pugh C)肝损伤患者中研究本品的安全性和有效性。因此,中度、重度肝损伤患者不建议使用本品。轻度肝损伤患者(Child Pugh A)应该接受降低剂量治疗(参见【用法用量】、【药代动力学】)。
在尼达尼布治疗中,对药物导致的肝损伤病例进行了临床观察。药品上市后阶段已报告非严重和严重的药物诱导的肝损伤病例,包括在本品治疗期间出现的有致命性结局的重度肝损伤。绝大多数的肝脏事件发生在开始本品治疗的前 3 个月临床试验中,本品给药与肝酶(丙氨酸氨基转移酶(ALT)、和天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALKP)、γ-谷氨酰转移酶(GGT))和胆红素升高有关。大多数病例在调整剂量或中断治疗后,肝酶和胆红素升高可逆转。绝大多数(94%)ALT 和/或 AST 升高的患者,ALT 和/或 AST 的升高<正常值上限 5 倍。绝大多数(95%)胆红素升高患者,胆红素的升高 <正常值上限 2 倍(参见【不良反应】、【药代动力学】)。
体重低于 65 kg、亚洲人及女性患者具有更高的肝酶升高的风险。尼达尼布暴露量随着患者年龄呈线性增加,这也可能导致肝酶升高的风险增加(参见【药代动力学】)。建议密切监测具有上述危险因素的患者。
出血
对血管内皮生长因子受体(VEGFR)的抑制可能伴有出血风险升高。在使用本品的临床试验中,接受本品治疗的患者中发生出血不良事件的频率略高或各治疗组之间相当(INPULSIS 试验:本品治疗组:10.3%,安慰剂组:7.8%;INBUILD 试验:本品治疗组:11.1%,安慰剂组:12.7%,SENSCIS 试验:本品治疗组:11.1%,安慰剂组:8.3%)。报告最常见的出血事件为非严重的鼻衄。两治疗组严重出血事件的频率较低(INPULSIS 试验:本品治疗组:1.3%,安慰剂组:1.4%;INBUILD 试验:本品治疗组: 0.9%,安慰剂组:1.5%;SENSCIS 试验:本品治疗组:1.4%,安慰剂组:0.7%)。
临床试验并未入选具有已知出血风险的患者,出血风险包括伴有先天性出血倾向或者接受完整剂量抗凝剂治疗。因此,仅在预期获益超过潜在风险的情况下,才给予这些患者本品治疗。在上市后期间,已观察到非严重和严重的出血事件,其中一部分是致死性的。
胚胎-胎儿毒性
根据动物研究结果及其作用机制,妊娠女性给药后,本品会对胎儿造成危害。在器官形成期给予低于(大鼠)和接近(家兔)5 倍的成人人体最大推荐剂量(MRHD)时,尼达尼布导致大鼠和家兔的胚胎-胎仔死亡和结构异常。请告知妊娠女性本品对胎儿的潜在风险。应告知有生育能力的女性,接受本品治疗期间应避免怀孕,在本品治疗期间及末次给药后至少 3 个月内,应采取有效避孕措施。接受本品给药前,要检查妊娠状态。
动脉血栓栓塞
临床试验排除了伴有近期心肌梗死或中风病史的患者。在临床试验中,所报告的动脉血栓栓塞事件很少(INPULSIS 试验:本品治疗组为 2.5%,安慰剂组为 0.7%;INBUILD 试验:本品治疗组为 0.9%,安慰剂组为 0.9%;在 SENSCIS 试验中,不常报告动脉血栓栓塞事件:本品治疗组为 0.7%,安慰剂组为 0.7%。
在 INPULSIS 试验中,尽管反映缺血性心脏病的不良事件在尼达尼布治疗组与安慰剂组之间是平衡的,但尼达尼布治疗组中发生心肌梗死的患者百分数(1.6%)与安慰剂组(0.5%)相比更高;在 INBUILD 试验和 SENSCIS 试验中,观察到心肌梗死的发生频率较低:在 INBUILD 试验中,本品治疗组为 0.9%,安慰剂组为 0.9%;在 SENSCIS 试验中,本品治疗组为 0%,安慰剂组为 0.7%。对具有较高心血管风险的患者,包括已知伴有冠心病的患者,应谨慎治疗。对出现急性心肌缺血体征或症状的患者,应考虑中断治疗。
静脉血栓栓塞
在临床试验中,在接受尼达尼布治疗的患者中未观察到静脉血栓栓塞的风险升高。考虑到尼达尼布的作用机制,患者发生血栓栓塞事件的风险可能会增加。
胃肠道穿孔
在临床试验中,接受尼达尼布治疗的患者中未观察到胃肠道穿孔的风险增加。考虑到尼达尼布的作用机制,患者出现胃肠道穿孔的风险可能会增加。在上市后期间,已经有胃肠道穿孔病例的报告,其中有一些是致命的。对既往接受过腹部手术的患者、近期有空腔脏器穿孔病史的患者、有消化性溃疡史的患者、憩室性疾病、或合并使用皮质类固醇药物或非甾体类抗炎药(NSAIDs)的患者进行治疗时,尤其应谨慎。应在重大手术(包括腹部手术)后至少 4 周才开始本品治疗。在出现胃肠道穿孔的患者中应永久性停止本品治疗。对于已知有胃肠道穿孔风险的患者,仅在预期获益超过潜在风险时使用本品。
高血压
本品可能会引起血压升高。应定期检测全身血压,在出现临床表现时也应进行检测。
肺动脉高压
在肺动脉高压患者中,有关本品用药的数据有限。
SENSCIS 试验中排除了患有严重肺动脉高压的患者(心脏指数 ≤ 2 L/min/m2,或者使用依前列醇/曲前列尼尔胃肠外用药,或者严重右心衰竭)。因此,只有在预期获益大于潜在风险时,才能在重度肺动脉高压患者中使用本品。建议密切监测患有肺动脉高压的患者。
伤口愈合并发症 在临床试验中并未观察到影响伤口愈合的频率有所增加。考虑到作用机制,尼达尼布可能会影响伤口愈合。关于尼达尼布对伤口愈合影响的特定研究尚未实施。因此,只能根据伤口充分愈合的临床判断开始,或者在围手术期间中断用药之后恢复本品的治疗。
QT 间期影响
在临床试验计划中,未发现尼达尼布延长 QT 间期的证据(参见【临床试验】)。因为某些其他酪氨酸激酶抑制剂具有延长 QT 间期的作用,当给予可能出现 QTc 延长的患者尼达尼布治疗时,应该比较谨慎。
大豆卵磷脂
本品软胶囊含有大豆卵磷脂,对大豆过敏的患者食用大豆类产品可引发过敏反应,包括严重速发过敏反应。对花生蛋白过敏的患者对于大豆制品发生严重反应的风险也同时增加(参见【禁忌】)。
对驾驶和操纵机器能力的影响 尚无本品对于驾驶和操纵机器能力影响的研究。建议患者在使用本品治疗期间应谨慎驾驶或操纵机器。
对本品药物过量尚无特效解毒剂或治疗方法。在1期试验中所给予的尼达尼布的单次最大剂量为450 mg, 每日一次。另外,其他试验项目中的2例患者出现了最大给予600 mg,每日两次,共8天的药物过量。观 察到的不良反应与已知的尼达尼布安全性特征一致,即肝酶升高和胃肠道症状。两例患者均已从这些不 良反应中恢复。 在INPULSIS试验中,1例患者意外暴露于600 mg剂量,每日一次,共21天。在错误给药期间,出现了非 严重不良事件(鼻咽炎),随后恢复,未报告其他事件。 在药物过量的情况下,应中断治疗,并根据需要启动常规支持性措施。
尚无在妊娠妇女中使用本品的资料,但在动物中实施的临床前研究显示了该药物的生殖毒性(参见【药理毒理】)。由于尼达尼布也可能对人类的胎儿造成伤害,故妊娠期间不得使用,至少在使用本品治疗前应进行妊娠试验。 如果女性患者在接受本品治疗期间怀孕,建议患者通知她们的医生或药剂师。 如果患者在接受本品治疗期间怀孕,应告知患者胎儿可能受到的潜在性危害。应考虑终止治疗。尚无尼达尼布及其代谢产物在人类乳汁中排泄的资料。临床前研究显示少量的尼达尼布及其代谢产物(≤ 0.5%给药剂量)被分泌至哺乳大鼠的乳汁中。无法排除本品对新生儿/婴儿的风险。使用本品治疗期间应停止哺乳。尚未确定在儿童患者中安全性和有效性。与年龄小于 65 岁的患者相比,未在老年患者中观察到安全性和有效性的总体差异。无需根据患者年龄。调整起始剂量。对≥ 75 岁的患者更有可能需要通过降低剂量的方式来管理不良反应(参见【药代动力学】)。
P-糖蛋白(P-gp) 尼达尼布是P-gp的底物(参见【药代动力学】)。在一项药物相互作用的专项研究中,联合给予P-gp强效 抑制剂酮康唑,若按药时曲线下面积(AUC)计,可使尼达尼布暴露量增加至原来的1.61倍,按峰浓度 (Cmax)计,可使其暴露量增加至原来的1.83倍。 在一项联合使用 P-gp 强效诱导剂利福平的药物相互作用研究中,联合使用利福平与单独给予尼达尼布 相比,尼达尼布的暴露量按药时曲线下面积(AUC)计下降至原来的 50.3%;按峰浓度(Cmax)计下降 至原来的 60.3%。 如果与本品联合给药,P-gp 强效抑制剂(例如,酮康唑或红霉素)可增加尼达尼布暴露量。在这些病 例中,应密切监测患者对尼达尼布的耐受性。处理不良反应可能需要中断、降低剂量或停止本品治疗(参 见【用法用量】)。 P-gp 强效诱导剂(例如,利福平、卡马西平、苯妥英和圣约翰草)可降低尼达尼布暴露量。应考虑选 择无 P-gp 诱导作用的或诱导作用极小的替代性合并用药。 食物 建议本品与食物同时服用(参见【药代动力学】)。 细胞色素(CYP)酶 尼达尼布的生物转换仅少量依赖 CYP 途径。在临床前研究中,尼达尼布及其代谢产物(游离酸部分 BIBF 1202 及其葡糖苷酸化合物 BIBF 1202 葡糖苷酸)不会抑制或诱导 CYP 酶(参见【药代动力学】)。因此, 认为基于 CYP 代谢的与尼达尼布发生药物相互作用的可能性很低。与其他药物联合给药 尼达尼布与波生坦联合给药并未改变尼达尼布的药代动力学(参见【药代动力学】)。 尼达尼布与口服激素避孕药联合给药对口服激素避孕药的药代动力学的影响未达到具有相关性的程度 (参见【药代动力学】)。尼达尼布具有pH-依赖的溶解特性,在pH< 3的酸性环境时,溶解度增加。然 而,在临床试验中,与质子泵抑制剂或组胺H2拮抗剂联合给药对尼达尼布的暴露量(谷浓度)没有影 响。 抗凝剂 尼达尼布是一种VEGFR抑制剂,可能会增加出血风险。应密切监测接受全剂量抗凝治疗的患者以防出 血,必要时调整抗凝治疗。 吡非尼酮 一项在IPF患者中开展的尼达尼布与吡非尼酮联合用药研究结果表明,没有显示有药代动力学相关的药 物相互作用(参见【药代动力学】)。
Catalent Germany Eberbach GmbH
86980023000327,86980023000310
尼达尼布是一种小分子酪氨酸激酶抑制剂,具有抗纤维化和抗炎活性。尼达尼布可抑制多种受体酪氨酸激酶(RTK):血小板衍生生长因子受体α和β(PDGFRα、β)、成纤维细胞生长因子受体1-3(FGFR1-3)、 血管内皮生长因子受体1-3(VEGFR1-3)及Fms样酪氨酸激酶-3(FLT3),其中FGFR、PDGFR和VEGFR 与IPF的发病机制有关,尼达尼布可竞争性结合于这些胞内受体激酶结构域上的三磷酸腺苷(ATP)结 合位点,阻滞胞内信号传导,抑制成纤维细胞的增殖、迁移和转化。此外,尼达尼布还可抑制以下非受 体酪氨酸激酶(nRTK):Lck、Lyn和Src激酶。尚不清楚其抑制FLT3和nRTK对IPF药效的作用。
遗传毒性
尼达尼布 Ames 试验、体外小鼠淋巴瘤细胞试验、体内大鼠微核试验结果均为阴性。
生殖毒性
大鼠经口给予尼达尼布 100mg/kg/天(大鼠体内暴露量接近成人最大推荐剂量 MRHD 下 AUC 的 3 倍)
可引起雌性生育功能损伤,可见吸收胎和胚胎着床后丢失数量增加、妊娠指数降低;未见对雄性生殖系
统和生育力的不良影响。大鼠和小鼠经口重复给予尼达尼布,可见雌性卵巢内黄体数量和大小改变,仅
在 20mg/kg/天剂量下(暴露量相当于 MRHD 剂量下 AUC 的 1 倍)可见胚胎再吸收的雌鼠数量增加。
在胚胎-胎仔发育毒性试验中,妊娠大鼠和兔分别经口给予尼达尼布 2.5mg/kg/天和 15mg/kg/天(暴露量
分别为<MRHD 剂量下 AUC 和相当于 MRHD 剂量下 AUC 的 5 倍)可引起胚胎-胎仔死亡以及血管、
泌尿生殖系统和骨骼畸形。畸形主要表现为大血管缺失或增生;胸椎、腰椎和尾椎(半椎体、缺失或不
对称骨化)、肋骨(分叉或融合)及胸骨(融合、分裂或单侧骨化)畸形;部分胎仔的泌尿生殖系统器
官缺失。兔经口给予尼达尼布 60mg/kg/天(暴露量相当于 MRHD 剂量下 AUC 的 15 倍)时,可见胎仔
雌性性别比例显著增加(雌性对比雄性约为 71% 对比 29%)。大鼠经口给予尼达尼布 10mg/kg/天(母
体暴露量<MRHD 剂量下 AUC)可降低新生仔鼠产后 4 天内的存活率。约≤ 0.5%给药剂量的尼达尼布和
其代谢产物可泌入大鼠乳汁。
致癌性
在 2 年致癌性试验中,小鼠和大鼠分别经口给予尼达尼布 10mg/kg/天和 30mg/kg/天(暴露量分别为
<MRHD 剂量下 AUC 和相当于 MRHD 剂量下 AUC 的 4 倍)未见致癌性。
在两项设计相同的 3 期、随机、双盲、安慰剂对照研究(INPULSIS-1 和 INPULSIS-2)中研究了尼达尼布在 IPF 患者中的临床有效性。临床试验中排除了基线 FVC<正常预计值 50% 或肺一氧化碳弥散功能(DLCO,经血红蛋白校正)<正常基线预计值 30% 的患者。以 3:2 的比例随机给予患者本品 150 mg 或安慰剂,每日两次,共 52 周。
主要终点为用力肺活量(FVC)年下降率。关键次要终点为 52 周时圣乔治呼吸问卷(SGRQ)总分相对于基线的变化值以及至首次 IPF 急性加重的时间。
FVC 的年下降率
与接受安慰剂治疗的患者相比,接受尼达尼布治疗的患者中 FVC 的年下降率(以 mL 计)显著降低。两项研究的治疗效果一致。单个和汇总的研究结果见表 2。
表 2 试验 INPULSIS-1、INPULSIS-2 及其汇总数据中 FVC 的年下降率(mL)– 治疗集
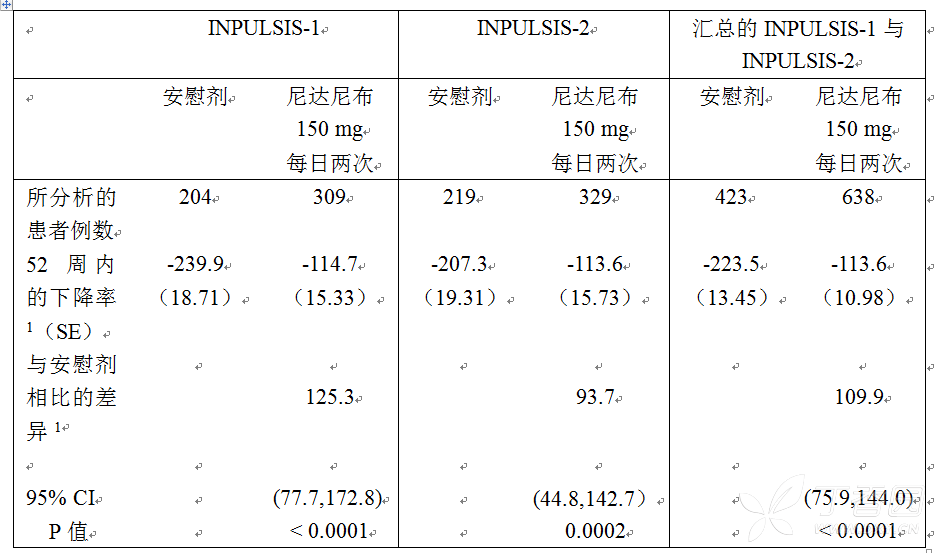
1 基于随机系数回归模型的估计。
在所有预先设定的敏感性分析中证实了尼达尼布对 FVC 年下降率影响的稳健性。
另外,其他肺功能终点例如第 52 周时 FVC 相对于基线的变化以及进一步证实尼达尼布对延缓疾病进展作用的 FVC 应答者分析中,都观察到了相似的结果。基于对研究 INPULSIS-1 和 INPULSIS-2 的汇总分析,两治疗组中相对于基线的变化随时间的演变见图 1。
图 1 所观察到的 FVC 相对于基线(mL)变化的平均值(SEM)随时间的变化,INPULSIS-1 和 INPULSIS-2 的汇总研究
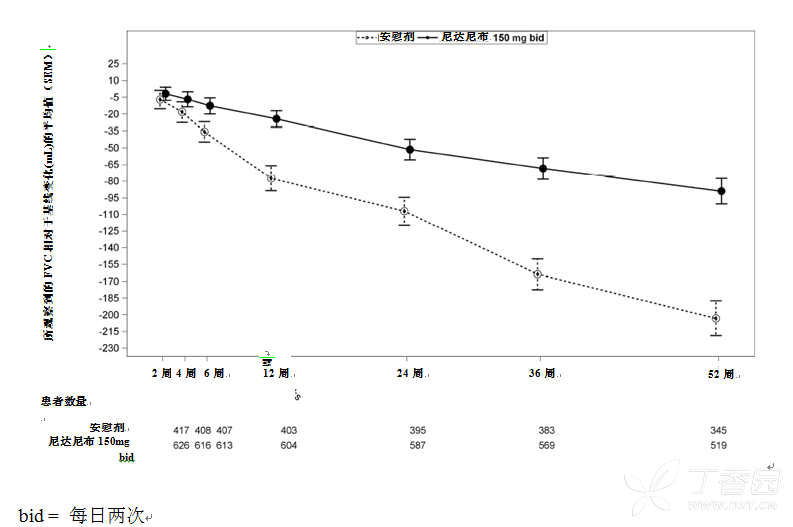
表 3 在 INPULSIS-1、INPULSIS-2 及其汇总数据中 52 周时的 FVC 应答者的比例 – 治疗集
1 根据临界值和第 52 周时的评价,应答者为绝对降幅不超过 FVC% 预测值的 5% 或 10% 的患者。
2 基于逻辑回归
至进展(FVC% 预测绝对值下降 ≥ 10% 或死亡)时间
在单独的两项 INPULSIS 试验中,与安慰剂相比,接受尼达尼布治疗的患者的进展风险呈统计学显著性降低。在汇总分析中,风险比(HR)是 0.60,表明接受尼达尼布治疗的患者的进展风险与安慰剂相比减少了 40%,见表 4。
表 4 在 52 周内,FVC% 预测绝对值下降 ≥ 10% 或死亡的患者比例和试验 INPULSIS-1、INPULSIS-2 及其汇总数据至进展时间-治疗集
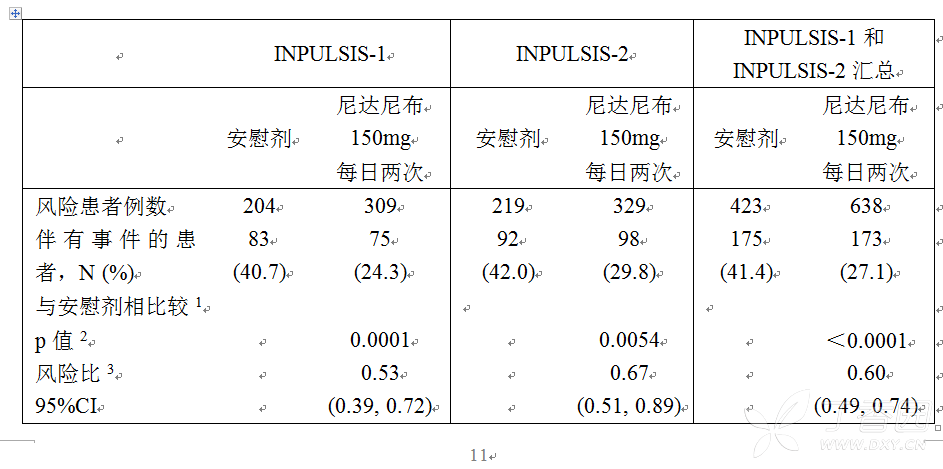
基于收集至 372 天的数据(52 周 + 7 天)。
2 基于 Log-rank 检验。
3 基于 Cox’s 回归模型。
第 52 周时 SGRQ 总评分相对于基线的变化
在第 52 周时对测量与健康相关的生活质量(HRQoL)的圣乔治呼吸问卷(SGRQ)总评分进行了分析。在 INPULSIS-2 中,与接受尼达尼布 150 mg 每日两次治疗的患者相比,接受安慰剂治疗的患者的 SGRQ 总评分相对于基线的增加更大。尼达尼布组中 HRQoL 的恶化更小;两治疗组间的差异具有统计学显著性(-2.69;95% CI:-4.95,-0.43;p = 0.0197)。
在 INPULSIS-1 中,尼达尼布与安慰剂组间第 52 周时 SGRQ 总评分相对于基线的增加是相当的(治疗组间的差异:-0.05;95% CI:-2.50,2.40;p = 0.9657)。在两项 INPULSIS 试验的汇总分析中,尼达尼布组中 SGRQ 总评分从基线至第 52 周的估计平均变化(3.53)与安慰剂组(4.96)相比更小,治疗组间差异为-1.43(95% CI:-3.09,0.23;p = 0.0923)。总体上,尼达尼布对采用 SGRQ 总评分测量的与健康相关的生活质量产生了一定程度的影响,表明与安慰剂组相比恶化更慢。
至首次 IPF 急性加重的时间
在 INPULSIS-2 试验中,接受尼达尼布治疗的患者在 52 周期间内首次 IPF 急性加重的风险与安慰剂组相比显著降低,在 INPULSIS-1 试验中,两治疗组间无差异。在两项 INPULSIS 试验的汇总分析中,在接受尼达尼布治疗的患者中观察到的首次急性加重的风险与安慰剂组相比在数值上更低。单个与汇总的研究结果见表 5。
表 5 基于试验 INPULSIS-1、INPULSIS-2 及其汇总数据中研究者报告的事件,52 周内至首次急性加重的时间 – 治疗集

1 基于收集至 372 天的数据(52 周 + 7 天)。
2 基于 Log-rank 检验。
3 基于 Cox 回归模型。
研究者报告的所有 IPF 急性加重不良事件由盲态裁定委员会裁定。采用汇总数据对至首次裁定为“确证”或“疑似”IPF 急性加重时间进行了预先设定的敏感性分析。在 52 周内出现至少一次被裁定为加重的患者频率,尼达尼布组(1.9% 的患者)小于安慰剂组(5.7% 的患者)。采用汇总数据对裁定为加重事件进行至事件时间分析获得的风险比(HR)为 0.32(95% CI: 0.16,0.65;p = 0.0010)。这表明在所有时间点,和安慰剂组相比,尼达尼布组首次 IPF 急性加重的风险下降具有统计学显著意义。
生存分析
在对 INPULSIS 试验的生存数据进行的预先设定的汇总分析中,尼达尼布组在 52 周内的总死亡率(5.5%)与安慰剂组(7.8%)相比更低。至死亡时间分析结果是风险比(HR)为 0.70(95% CI: 0.43,1.12;p = 0.1399)。所有生存终点的结果(例如治疗期间死亡率和呼吸系统死亡率)显示了有利于尼达尼布的一致性数值差异,见表 6。
表 6 试验 INPULSIS-1、INPULSIS-2 及其汇总数据的 52 周内全因死亡率–治疗集

1 基于收集至 372 天的数据(52 周 + 7 天)。
2 基于 Log-rank 检验。
3 基于 Cox 回归模型
来自 2 期试验(TOMORROW)本品 150 mg,每日两次的结果的支持性证据:
一项包含了尼达尼布 150 mg 每日两次剂量组的随机、双盲、安慰剂对照、剂量探索性 2 期试验提供了额外的有效性证据。尼达尼布组的主要终点 52 周内 FVC 的下降率(-0.060 L/年,N = 84)低于安慰剂组(-0.190 L/年,N = 83)。两治疗组间的估计差异为 0.131 L/年(95% CI :0.027,0.235)。两治疗组间的差异达到了名义统计学显著性(p = 0.0136)。
安慰剂组 52 周时 SGRQ 总评分相对于基线的估计平均变化为 5.46,表明与健康相关的生活质量恶化,尼达尼布组为-0.66,表明与健康相关的生活质量稳定。尼达尼布组与安慰剂组相比的估计平均差异为-6.12(95% CI:-10.57,-1.67;p = 0.0071)。
尼达尼布组 52 周时出现 IPF 急性加重的患者例数(2.3%,N = 86)与安慰剂组(13.8%,N = 87)相比更少。尼达尼布与安慰剂相比的估计风险比为 0.16(95% CI: 0.04,0.71;p = 0.0054)。
对 QT 间期的影响
在肾细胞癌患者中实施的一项尼达尼布单药治疗对比舒尼替尼单药治疗的专项研究中,记录并分析了 QT/QTc 测量值。在该研究中,单次口服尼达尼布 200 mg 和多次口服尼达尼布 200 mg,每日两次,共 15 天,均未延长 QTc 间期。
尼达尼布的药代动力学(PK)特征在健康志愿者、IPF患者和SSc-ILD患者中相似。尼达尼布的PK呈线
性。尼达尼布暴露量随着剂量的增加而增加,且展现了剂量与暴露量的等比例增加特征(剂量范围50-450
mg,每日一次;150 -300 mg,每日两次),证明了剂量比例关系。多次给药后,IPF患者的药时曲线下
面积(AUC)蓄积量为1.76倍。在给药1周内达到稳态血药浓度。尼达尼布谷浓度保持稳定超过1年。尼
达尼布的PK个体间变异程度为中度至高度(标准PK参数的变异系数在30%-70%的范围内),而个体内变
异程度为低度至中度(变异系数低于40%)。
吸收
尼达尼布在进食状态下以软胶囊口服给药后大约 2 - 4 小时达到最大血浆浓度(范围 0.5 - 8 小时)。在健
康志愿者中 100 mg 剂量的绝对生物利用度为 4.69%(90% CI:3.615 - 6.078)。转运子效应和显著的首
过代谢使吸收和生物利用度下降。
剂量与尼达尼布暴露量增加成比例(剂量范围 50 - 450 mg 每日一次和剂量范围 150 - 300 mg 每日两次)。
至少在给药后 1 周内达到稳态血浆浓度。
与空腹状态服药相比,在饭后服药时尼达尼布暴露量增加了约20%(CI:95.3 - 152.5%),并且吸收延迟
(空腹中位tmax为2.00小时;餐后:3.98小时)。
分布
尼达尼布符合至少双相处置动力学。静脉输注后,在终末相观察到了较大的分布容积(Vss:1050 L,45.0% gCV)。
在人体血浆中,尼达尼布的体外蛋白结合率较高,结合部分为97.8%。血清白蛋白被认为是主要结合蛋
白。尼达尼布优先分布于血浆中,血液与血浆分布之比为0.869。
生物转化
尼达尼布的主要代谢反应为通过酯酶的水解分裂,产生了游离碱基团 BIBF 1202。BIBF 1202 随后通过
UGT 酶(即 UGT 1A1、UGT 1A7、UGT 1A8 和 UGT 1A10)葡糖醛酸化为 BIBF 1202 葡糖苷酸。
尼达尼布仅在很小程度上经CYP途径进行生物转化,CYP 3A4为主要的参与酶。在人体ADME(吸收、
分布、代谢、消除)研究中无法测得血浆中的主要CYP依赖性代谢产物。在体外研究中,CYP依赖性代
谢大约占5%,与之相比,酯裂解大约占25%。由于尼达尼布、BIBF 1202和BIBF 1202葡糖苷酸在临床
前研究中不抑制或诱导CYP酶。因此,尼达尼布与CYP底物、CYP抑制剂或CYP诱导剂之间不存在药物
相互作用。
消除
静脉输注后的总血浆清除率较高(CL:1390 mL/min,28.8% gCV)。口服给药后48小时内药物原形经尿
液排泄大约为剂量的0.05%(31.5% gCV),静脉注射给药后大约为剂量的1.4%(24.2% gCV);肾脏清
除率为20 mL/min(32.6% gCV)。口服给予[
14C]尼达尼布后药物相关的放射活性的主要消除途径为通过
粪便/胆汁排泄(剂量的93.4%,2.61% gCV)。肾脏排泄对总清除率的贡献较低(剂量的0.649%,26.3%
gCV)。给药4天内的总回收率被认为是完全的(超过90%)。尼达尼布的终末半衰期为10至15小时(gCV%
大约为50%)。
转运
尼达尼布是P-gp的底物。尼达尼布与该转运体之间的潜在相互作用参见【药物相互作用】。尼达尼布在
体外显示并非OATP-1B1、OATP-1B3、OATP-2B1、OCT-2或MRP-2的底物或抑制剂。尼达尼布也非BCRP
的底物。在体外仅观察到了对OCT-1、BCRP和P-gp具有较弱的抑制作用,其临床意义较低。临床意义
较低的结论也适用于尼达尼布作为OCT-1底物时的研究。
暴露-应答关系
暴露应答分析表明在IPF、具有进行性表型的慢性纤维化性间质性肺疾病和SSc-ILD 患者中的暴露范围
和FVC的年下降率之间存在Emax样关系,EC50约为3ng/mL(相对标准误:55%)。与之相比,尼达尼布
150 mg 每日两次中观察到的尼达尼布谷浓度的中位数为约10ng / mL。
在安全性方面,尼达尼布血浆暴露量和ALT和/或AST升高之间的关系看似较弱。即使无法排除血浆暴
露量为确定的风险因素,实际给药剂量可能会更好的预测发生任何强度的腹泻的风险(参见【注意事项】)。
特殊人群中的群体药代动力学分析
尼达尼布在健康志愿者、IPF患者和SSc-ILD患者中的药代动力学特性相似。基于在IPF、具有进行性表
型的慢性纤维化性间质性肺疾病、SSc-ILD和其他患者(N = 1191)中实施的群体药代动力学(Pop PK)
分析和描述性研究的结果,性别(校正了体重)、轻中度肾损伤(通过肌酐清除率预估)、肿瘤肝转移、
ECOG体能状态评分、饮酒或P-gp基因型不影响尼达尼布暴露量。群体药代动力学分析表明,对尼达尼
布暴露产生的中度影响取决于年龄、体重和人种(见以下描述)。根据临床试验中观察到的较高的个体
间暴露量的差异,认为这些影响没有临床意义(参见【注意事项】)。
年龄
尼达尼布的暴露量随年龄呈线性增加。相对于中位年龄62岁的患者,AUCτ,ss在45岁的患者(第5百分位
数)中下降了16%,在76岁的患者(第95百分位数)中增加了13%。该分析涵盖的年龄范围为29至85岁;
大约5%的人群年龄超过75岁。基于PopPK 模型,与65岁以下患者相比,年龄≥ 75岁的患者尼达尼布暴
露量增加约为20 - 25%。尚未在儿童人群中进行研究。
23
体重
体重与尼达尼布的暴露量呈负相关。相对于中位体重为71.5 kg的患者体重
体重与尼达尼布的暴露量呈负相关。相对于中位体重为71.5 kg的患者,AUCτ,ss在体重50 kg的患者(第5
百分位数)中增加了25%,在体重100 kg的患者(第95百分位数)中下降了19%。
人种
与高加索人相比,尼达尼布群体平均暴露量(校正了体重)在中国、中国台湾和印度患者中升高了33-50%,
在日本人中升高了16%,在韩国人中下降了16-22%。
来自黑人个体的数据极为有限,但与高加索人处于相同的范围内。
肾损伤
根据933例IPF患者数据的群体药代动力学分析,轻度(肌酐清除率:60-90 mL/min;n=399)或中度(肌
酐清除率:30-60 mL/min;n=116)肾功能损害不影响尼达尼布的暴露量。重度肾功能损害(肌酐清除
率低于30 mL/min)的数据有限。
肝损伤
在一项关于本品的1期单剂量临床药代动力学研究中,对8例轻度肝功能损害受试者(Child Pugh A级)
和8例中度肝功能损害受试者(Child Pugh B级)与17例肝功能正常的受试者进行了比较。轻度肝损害受
试者的尼达尼布平均暴露量,按照峰浓度(Cmax),是肝功能正常受试者的2.4倍(90%CI:1.6-3.6);而
按照AUC0-inf,是肝功能正常受试者的2.2倍(90%CI:1.4-3.5)。对于中度肝损害受试者,按照峰浓度(Cmax),
平均尼达尼布暴露量是肝功能正常受试者的6.9倍(90%CI:4.4-11.0);而按照AUC0-inf,是肝功能正常
受试者的7.6倍(90%CI:5.1- 11.3)。没有对重度肝功能损害受试者(Child Pugh C级)进行研究。
吸烟者
在群体PK分析中,与既往吸烟者和从未吸烟者相比,当前吸烟者尼达尼布的暴露量降低了21%。这种
影响不足以需要调整剂量。
与吡非尼酮联合治疗
在一项专门的药代动力学研究中,在IPF患者中进行了尼达尼布联合吡非尼酮治疗的研究。第1组患者在
吡非尼酮剂量升高至801 mg,每日三次稳态治疗之前和之后,接受单次尼达尼布150 mg给药。第2组患
者接受吡非尼酮801 mg、每日三次稳态治疗,并联合使用尼达尼布150 mg,每日两次,持续至少7天,
在尼达尼布给药之前和之后接受PK特征分析。第1组中,尼达尼布的Cmax和AUC0-tz的调整后几何平均
比(90%置信区间(CI))分别为93%(57% - 151%)和96%(70% - 131%)(n = 12)。第2组中,吡非尼
酮的Cmax,ss和AUCτ,ss的调整后几何平均比(90% CI)分别为97%(86%-110%)和95%(86%-106%)(n =
12)。
基于这些结果,联合治疗时,没有证据表明尼达尼布和吡非尼酮之间存在相关药代动力学药物 - 药物
相互作用。
与波生坦联合使用
在专门的药代动力学研究中,在健康志愿者中进行了尼达尼布联合波生坦的研究。受试者接受多次给药
的波生坦125 mg,每日两次,并进入稳态,在这之前和之后接受一剂尼达尼布150 mg治疗。尼达尼布的
Cmax和AUC0-tz的校正的几何平均比(90%置信区间(CI))分别为103%(86%- 124%)和99%(91%-107%)
(n = 13), 这表明尼达尼布与波生坦的联合使用并未改变尼达尼布的药代动力学。
口服激素避孕药合并治疗
在一项专门的药代动力学试验中,SSc-ILD女性患者在尼达尼布150 mg,每日两次给药至少10天之前和
之后接受30 μg炔雌醇和150 μg左炔诺孕酮复方制剂单次给药。炔雌醇的校正几何均值比(90%置信区间
[CI])分别为117%(108%-127%;Cmax)和101%(93%-111%;AUC0-tz),左炔诺孕酮的分别为101%(90%-113%;Cmax)和96%(91%-102%;AUC0-tz)(n = 15),表明联合尼达尼布治疗对炔雌醇和左炔
诺孕酮血浆暴露量的影响未达到具有相关性的程度。
胶囊剂
按C31H33N5O4计算150mg;按C31H33N5O4计算 100mg
铝/铝泡罩包装。 30 粒/盒、 60 粒/盒。
请保存于25℃以下。 请存放于儿童无法触及和看到的安全位置!
3150.00元
36个月。
H20170355,H20170354